Acétaldéhyde: Réactions chimiques et utilisations
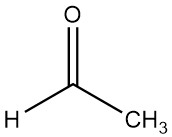
L’acétaldéhyde (éthanal), de formule chimique CH3CHO, a été observé pour la première fois par SCHEELE en 1774 lorsque le dioxyde de manganèse et l’acide sulfurique ont réagi avec l’alcool. Sa structure a ensuite été expliquée par LIEBIG en 1835, qui a obtenu de l’acétaldéhyde pur en oxydant l’éthanol avec de l’acide chromique.
L’acétaldéhyde est un liquide volatil, à faible point d’ébullition et hautement inflammable caractérisé par sa forte odeur.
En raison de sa remarquable réactivité chimique, l’acétaldéhyde joue un rôle important en tant qu’intermédiaire dans la fabrication de divers composés, dont l’acide acétique, l’anhydride acétique, l’acétate d’éthyle, l’acide peracétique, le butanol, le 2-éthylhexanol, le pentaérythritol, les acétaldéhydes chlorés (chloral), le glyoxal , alkylamines, pyridines et autres produits chimiques.
Sa première application commerciale était la production d’acétone par synthèse d’acide acétique, qui eut lieu entre 1914 et 1918 en Allemagne (Wacker-Chemie et Hoechst) ainsi qu’au Canada (Shawinigan).
L’acétaldéhyde est également présent dans les processus métaboliques des plantes et des animaux, bien qu’en petites quantités. Des niveaux plus élevés d’acétaldéhyde peuvent perturber les processus biologiques.
On le trouve naturellement à l’état de traces pendant la fermentation alcoolique, contribuant à la saveur des boissons comme la bière, le vin et les spiritueux. De plus, l’acétaldéhyde a été détecté dans les jus de plantes, les huiles essentielles, le café torréfié et la fumée de tabac.
Diverses méthodes commerciales sont employées pour produire de l’acétaldéhyde. Celles-ci comprennent la déshydrogénation ou l’oxydation de l’éthanol, l’addition d’eau à l’acétylène, l’oxydation partielle des hydrocarbures et l’oxydation directe de l’éthylène.
Table des matières
2. Propriétés physiques de l’acétaldéhyde
L’acétaldéhyde, de formule moléculaire C2H4O et d’une masse molaire de 44,054 g/mol, est un liquide transparent caractérisé par une odeur forte et suffocante. Dilué, il dégage un parfum légèrement fruité.
L’acétaldéhyde est entièrement soluble dans l’eau et la plupart des solvants organiques. Il ne forme aucun azéotrope avec l’eau, le méthanol, l’éthanol, l’acétone, l’acide acétique ou le benzène.
Cependant, il forme des azéotropes binaires avec le butane (point d’ébullition -7 °C, contenant 84 % en poids de butane) et l’éther diéthylique (point d’ébullition 18,9 °C, contenant 23,5 % en poids d’éther).
Certaines propriétés physiques de l’acétaldéhyde sont énumérées ci-dessous :
- Point d’ébullition à 101,3 kPa = 20,16 °C
- Point de fusion = -123,5 °C
- Température critique = 181,5 °C
- Densité relative (t) = 0,8045-0,001325.t (t en °C)
- Indice de réfraction (t) = 1,34240-0,0005635.t (t en °C)
- Viscosité du liquide à 20 °C = 0,21 mPa.s
3. Réactions chimiques et utilisations de l’acétaldéhyde
L’acétaldéhyde est un composé remarquablement réactif qui présente toutes les réactions caractéristiques des aldéhydes, ainsi que celles associées à un groupe alkyle dans lequel les atomes d’hydrogène sont activés par la présence d’un groupe carbonyle en position α.
Lorsqu’il est chauffé à des températures supérieures à 420 °C, l’acétaldéhyde subit une décomposition, entraînant la formation de méthane et de monoxyde de carbone.
3.1. Réactions d’addition
L’acétaldéhyde réagit facilement avec l’eau, formant un hydrate instable. Cependant, les hydrates isolables solides ne sont connus qu’avec les acétaldéhydes chlorés. Les alcools peuvent s’ajouter à l’acétaldéhyde, produisant des hémiacétals qui, en présence d’acides et d’élimination ultérieure de l’eau, peuvent former des acétals lorsqu’ils sont combinés avec de l’alcool supplémentaire.
Les diols conduisent à la formation d’acétals cycliques. Par exemple, l’éthylène glycol et l’acétaldéhyde donnent du 2-méthyl-1,3-dioxolane, tandis que le 1,3-propanediol et l’acétaldéhyde produisent du 2-méthyl-1,3-dioxane.

La réaction entre l’acétaldéhyde et une solution aqueuse de bisulfite de sodium donne un produit d’addition cristallin, à partir duquel l’acétaldéhyde peut être libéré.
L’ammoniac sec réagit avec l’acétaldéhyde, entraînant la formation d’ammoniac acétaldéhyde cristallin.
L’acétaldéhyde et l’acide cyanhydrique subissent une réaction pour produire du lactonitrile (α-hydroxypropionitrile), qui est un intermédiaire dans la production d’acrylonitrile.
La réaction entre l’acétaldéhyde et l’anhydride acétique donne du diacétate d’éthylidène, un intermédiaire du procédé à l’acétate de vinyle réalisé par Celanese Corp.
3.2. Dérivés de l’addition d’aldol
En présence de catalyseurs alcalins ou avec un chauffage doux, deux molécules d’acétaldéhyde se combinent pour former l’acétaldol. À des températures plus élevées, l’eau est facilement éliminée de l’acétaldol, entraînant la formation de crotonaldéhyde. Cependant, l’importance industrielle d’une condensation supplémentaire pour former des résines aldéhydiques, telles que la gomme laque synthétique, a diminué.
L’urée et l’acétaldéhyde peuvent se condenser en présence de H2SO4, entraînant la formation de crotonylidènediurée (6-méthyl-4-uréidohexahydropyrimidin-2-one), qui est utilisée comme engrais azoté à long terme.

L’acétaldéhyde sert d’intermédiaire dans la synthèse du butadiène. Il commence par l’acétylène et passe par l’acétaldol et son produit d’hydrogénation, le 1,3-butanediol. Ce procédé a été introduit au début du XXe siècle et est encore pratiqué à l’échelle commerciale dans certains pays d’Europe de l’Est.
L’acroléine est obtenue par la condensation aldolique de l’acétaldéhyde et du formaldéhyde, suivie d’une élimination de l’eau, similaire à la formation de crotonaldéhyde. Cependant, cette méthode manque de signification commerciale contemporaine.
La production de pentaérythritol à partir d’acétaldéhyde et d’une quantité quadruple de formaldéhyde en présence de Ca(OH)2 ou de NaOH présente une importance industrielle significative.
3.3. Réaction avec les composés azotés
Les amines primaires réagissent avec l’acétaldéhyde pour former des bases de Schiff, représentées par CH3CH=NR. Les composés azotés tels que l’hydroxylamine, l’hydrazine, la phénylhydrazine et le semicarbazide peuvent réagir avec l’acétaldéhyde, produisant des composés facilement cristallisables utilisés pour la détermination analytique et la caractérisation des aldéhydes. Les exemples incluent la semicarbazone (pf 162 – 163 °C), la p-nitrophénylhydrazone (pf 128,5 °C), la 2,4-dinitrophénylhydrazone (pf 168 °C) et l’oxime (pf 47 °C).
Des méthodes similaires peuvent être employées pour la caractérisation d’autres aldéhydes et cétones, car leurs dérivés analogues possèdent généralement des points de fusion distincts et bien définis.
La synthèse de pyridine et de dérivés de pyridine a pris une importance croissante. La 5-éthyl-2-méthylpyridine peut être obtenue en faisant réagir de l’ammoniaque avec de l’acétaldéhyde en présence d’ions fluorure. Le paraldéhyde, qui libère progressivement le monomère, peut également être utilisé. Un mélange de pyridine et d’alkylpyridines se forme en présence de formaldéhyde ou d’acroléine.

3.4. Oxydation
Une partie importante de l’acétaldéhyde produit commercialement est utilisée dans la fabrication de l’acide acétique par oxydation avec de l’oxygène ou de l’air.
Le monoperacétate d’acétaldéhyde est un produit intermédiaire qui se décompose en acide peracétique et en acétaldéhyde à des températures élevées et en présence de quantités catalytiques de sels de fer ou de cobalt. En présence de sels de Mn2+, l’acide acétique est obtenu à partir du monoperacétate d’acétaldéhyde. De plus, l’anhydride acétique peut être formé en utilisant des sels de Co2+ et Cu2+.

L’oxydation avec l’acide nitrique entraîne la formation de glyoxal, tandis que les acétaldéhydes halogénés peuvent être préparés par halogénation.
Les mono-, di- et trichloroacétaldéhyde, ainsi que le tribromoacétaldéhyde (brome), trouvent une utilité dans la production d’insecticides (par exemple, DDT, DDD), de produits pharmaceutiques et de colorants.
3.5. Réduction
L’acétaldéhyde peut être facilement hydrogéné pour donner de l’éthanol. Avant 1939, lorsque l’éthylène produit par voie pétrochimique est devenu disponible en Europe, cette réaction était utilisée industriellement pour produire de l’éthanol à partir d’acétaldéhyde et, par conséquent, d’acétylène.
La monoéthylamine, diethylamine et triéthylamine peut être synthétisée à partir d’acétaldéhyde, d’ammoniac et d’hydrogène en présence d’un catalyseur d’hydrogénation. Pour plus d’informations, se référer à la production d’amines aliphatiques
3.6. Réactions diverses
La réaction de Tishchenko de l’acétaldéhyde, catalysée par l’alcoolate d’aluminium, aboutit à la production de l’acétate d’éthyle, un solvant commercialement important.
L’acétaldéhyde sert d ‘agent de piégeage des radicaux dans la polymérisation des composés vinyliques, contrôlant la longueur de chaîne des polymères.
3.7. Polymères d’acétaldéhyde
3.7.1. Paraldéhyde
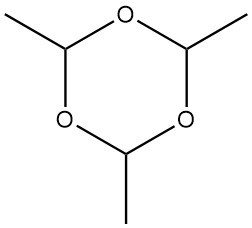
Le paraldéhyde, le 2,4,6-triméthyl-1,3,5-trioxane d’un poids moléculaire de 132,161, est un trimère cyclique de l’acétaldéhyde. Il possède un aspect incolore et dégage une odeur éthérée et pénétrante.
Le paraldéhyde peut être synthétisé à partir d’acétaldéhyde en présence de catalyseurs acides, tels que l’acide sulfurique, l’acide phosphorique, l’acide chlorhydrique ou des échangeurs de cations acides. Dans une réaction homogène, l’acétaldéhyde est ajouté au paraldéhyde contenant une petite quantité d’acide sulfurique sous agitation et refroidissement.
Une fois terminé, l’agitation continue pour établir l’équilibre et l’acide sulfurique est neutralisé avec précision à l’aide d’un sel de sodium comme l’acétate de sodium, le carbonate de sodium ou le bicarbonate de sodium. La distillation fractionnée sépare le mélange réactionnel en acétaldéhyde, eau et paraldéhyde.
Pour une production continue, de l’acétaldéhyde liquide à des températures de 15 à 20 °C ou de la vapeur d’acétaldéhyde à des températures de 40 à 50 °C passe sur un échangeur de cations acide, atteignant un taux de conversion supérieur à 90 %. La distillation est ensuite utilisée pour séparer l’acétaldéhyde du paraldéhyde.
La dépolymérisation implique une distillation lente de l’acétaldéhyde en présence de catalyseurs acides. Alternativement, le paraldéhyde peut être décomposé en phase gazeuse à l’aide de catalyseurs tels que HCl, HBr, H3PO4 ou des échangeurs de cations. La réaction de dépolymérisation suit une vitesse de premier ordre.
Le paraldéhyde trouve des applications dans la synthèse chimique comme source d’acétaldéhyde, éliminant la formation de résine et d’autres réactions secondaires. Cette synthèse est utilisée dans la production de pyridines et la chloration du chloral.
Entre 1939 et 1945, le paraldéhyde a été utilisé comme carburant.
3.7.2. Métaldéhyde

Le métaldéhyde est le tétramère cyclique de l’acétaldéhyde. Il forme des prismes tétragonaux avec un point de fusion de 246,2 °C (capillaire fermé) et une température de sublimation de 115 °C. La chaleur de combustion à volume constant est de 3370 kJ/mol.
Le métaldéhyde est insoluble dans l’eau, l’acétone, l’acide acétique et le disulfure de carbone.
La dépolymérisation du métaldéhyde en acétaldéhyde commence à 80 °C et se termine au-dessus de 200 °C. Des catalyseurs acides comme H2SO4 ou H3PO4 dilué sont utilisés dans le processus de dépolymérisation.
Le métaldéhyde ne présente pas la réactivité typique de l’acétaldéhyde. Il est stabilisé par du carbonate d’ammonium ou d’autres composés faiblement basiques qui neutralisent les catalyseurs acides potentiels.
Le métaldéhyde est obtenu, aux côtés de quantités importantes de paraldéhyde, lors de la polymérisation de l’acétaldéhyde en présence de HBr et de bromures de métaux alcalino-terreux comme CaBr2 à des températures inférieures à 0 °C.
Cependant, les rendements sont rarement supérieurs à 8 %. Des rendements plus élevés de 14 à 20 % ont été obtenus lorsque 7 à 15 % d’un éther aliphatique ou cyclique est présent à des températures allant de 0 à 20 °C. Le métaldéhyde insoluble est ensuite filtré.
L’acétaldéhyde est ensuite distillé du filtrat après dépolymérisation du paraldéhyde et peut être recyclé dans le processus de polymérisation. Cependant, ce recyclage de grandes quantités d’acétaldéhyde entraîne une augmentation des coûts de procédé en raison des pertes.
Le métaldéhyde sous forme de pastilles est disponible dans le commerce sous forme de combustible sec (Meta). Lorsqu’il est combiné avec un appât, le métaldéhyde est utilisé comme molluscicide.
3.7.3. Polyacétaldéhyde
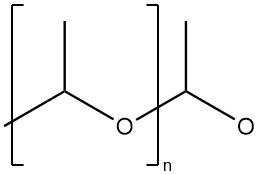
Le polyacétaldéhyde est un polymère de masse moléculaire élevée à structure acétal (structure polyoxyméthylène).
En utilisant des initiateurs cationiques, on obtient principalement un polymère amorphe. Des températures inférieures à -40 °C sont préférées dans ce cas. Au-dessus de -30 °C, principalement du paraldéhyde et du métaldéhyde sont produits.
L’activité amorceur dépend également du solvant utilisé. Des initiateurs appropriés comprennent H3PO4 dans l’éther et le pentane, ainsi que HCl, HNO3, CF3COOH, AICI3 dans l’éther, et en particulier BF3 dans l’éthylène liquide. Al2O3 et SiO2 semblent également être de bons initiateurs.
Le polymère a une consistance caoutchouteuse et est soluble dans les solvants organiques courants. Il se dépolymérise à température ambiante, libérant de l’acétaldéhyde. Il s’évapore complètement en quelques jours ou semaines. Les composés acides accélèrent la dépolymérisation et les amines (par exemple, la pyridine) stabilisent le polyacétaldéhyde dans une certaine mesure.
3.8. Consommation
Aux États-Unis, à partir de 1993, l’acétaldéhyde a cessé d’être utilisé dans les procédés de fabrication de l’acide acétique, du butanol et du 2-éthylhexanol, car des méthodes alternatives sont désormais utilisées pour leur production.
Cependant, la demande d’acétaldéhyde a augmenté pour d’autres substances telles que l’acide peracétique et les bases pyridiniques.
Consommation d’acétaldéhyde (t) en 2003
| Produit | Consommation (t) |
|---|---|
| Acide acétique/anhydride acétique | 147,000 |
| Esters d’acétate | 321,000 |
| Pentaerythritol | 80,000 |
| Pyridine et bases pyridiniques | 83,000 |
| Acide Peracétique | 23,000 |
| 1,3-Butylène glycol | 14,000 |
| Autres | 98,000 |
Référence
- Acetaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2
