Le butanol, également connu sous le nom de n-butanol ou butan-1-ol, est un alcool primaire de formule chimique C4H9OH. C’est un liquide incolore avec une odeur forte et désagréable, semblable à celle du whisky brûlé.
Le butanol existe naturellement sous forme liée et concentré dans les huiles de fusel dérivées de la fermentation. Sa production industrielle a commencé en 1912 avec la découverte de Clostridium acetobutylicum Weizmann, une bactérie transformant les glucides principalement en acétone et en 1-butanol.
La demande croissante de 1-butanol a stimulé le développement de nouvelles méthodes de production, notamment :
- Hydrogénation du crotonaldéhyde : formé via une acétaldéhyde aldolisation.
- Synthèse de Reppe (carbonylation du propène).
- Hydrogénation du n-butyraldéhyde : facile à obtenir par hydroformylation du propène qui est la méthode dominante actuelle.
Table of Contents
1. Propriétés physiques du 1-Butanol
Le n-Butanol est un liquide incolore avec une odeur caractéristique. Ses vapeurs irritent les muqueuses et deviennent narcotiques à forte concentration. Il est totalement miscible avec les solvants organiques courants.
Le tableau 1 compile les principales propriétés physiques caractéristiques du n-butanol.
| Propriété | Valeur |
|---|---|
| Masse molaire | 74,12 g/mol |
| Point de fusion | -89,3 °C |
| Point d'ébullition | 117,7 °C |
| Densité (20°C) | 0,8098 g/cm³ |
| Indice de réfraction (20°C) | 1.3991 |
| Viscosité (20°C) | 3,0 mPa·s |
| Chaleur spécifique (30–80 °C) | 2,437 J g⁻¹ K⁻¹ |
| Chaleur de vaporisation | 591,64 J/g |
| Chaleur de fusion | 125,2 J/g |
| Chaleur de combustion | 36,111 kJ/g |
| Pression critique | 44,2 hPa |
| Température critique | 289 °C |
| Tension superficielle (température ambiante) | 22,3 mN/m |
| Constante diélectrique (température ambiante) | 17.8 |
| Indice d'évaporation (éther = 1) | 33 |
| Solubilité dans l'eau (20°C, % en poids | 7,7 % en poids |
| Solubilité dans l'eau (30°C, % en poids | 7,08 % en poids |
| Solubilité de l'eau dans le 1-butanol (20°C, % en poids | 20 % en poids |
| Solubilité de l'eau dans le 1-butanol (30°C, % en poids | 20,62 % en poids |
| Point d'éclair | 34 °C |
| Limites d'inflammation dans l'air, vol% | 1.4 à 11.3 |
| Température d'inflammation | 380 °C |
2. Propriétés chimiques du 1-Butanol
En tant qu’alcool primaire, le 1-butanol est un produit chimique réactif qui sert de matière première pour un large éventail de réactions.
2.1. Déshydratation du 1-butanol
Le 1-butanol peut être déshydraté en un mélange de butènes (1-butène, cis-2-butène et trans-2-butène) à l’aide de catalyseurs comme le γ-Al2O3 à haute température (300-350 °C). À plus basse température et en présence de catalyseurs de déshydratation, de l’éther dibutylique est produit.

2.2. Oxydation du 1-butanol
Le 1-Butanol peut être déshydrogéné en 1-butanal (butanal) à l’aide d’agents oxydants tels que l’oxyde de manganèse (IV) dans l’acide sulfurique, l’acide nitrique , l’acide chromique ou le dioxyde de sélénium à basse température ou avec uniquement des catalyseurs appropriés à haute température.
L’oxydation du n-butanol en acide carboxylique peut être réalisée par réaction avec l’hydroxyde de sodium à 275 °C, formant le sel de sodium. d’acide butyrique avec de l’hydrogène et du 2-éthylhexanol.
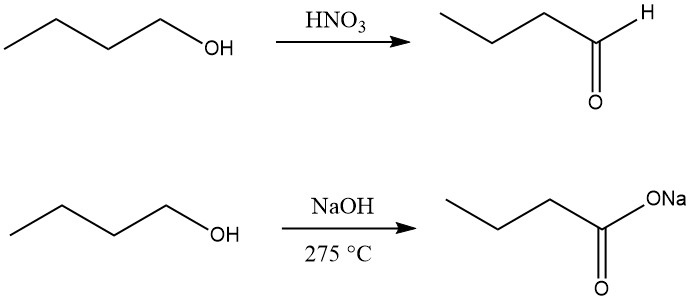
2.3. Alkylation
Le 1-butanol peut être utilisé dans diverses réactions d’alkylation pour produire des N-alkyl-, N,N-dialkyl- ou N,N,N-trialkylamines avec de l’ammoniac et des amines. Il peut également être utilisé dans l’alkylation cyclique d’hydrocarbures aromatiques avec des catalyseurs de Friedel-Crafts.
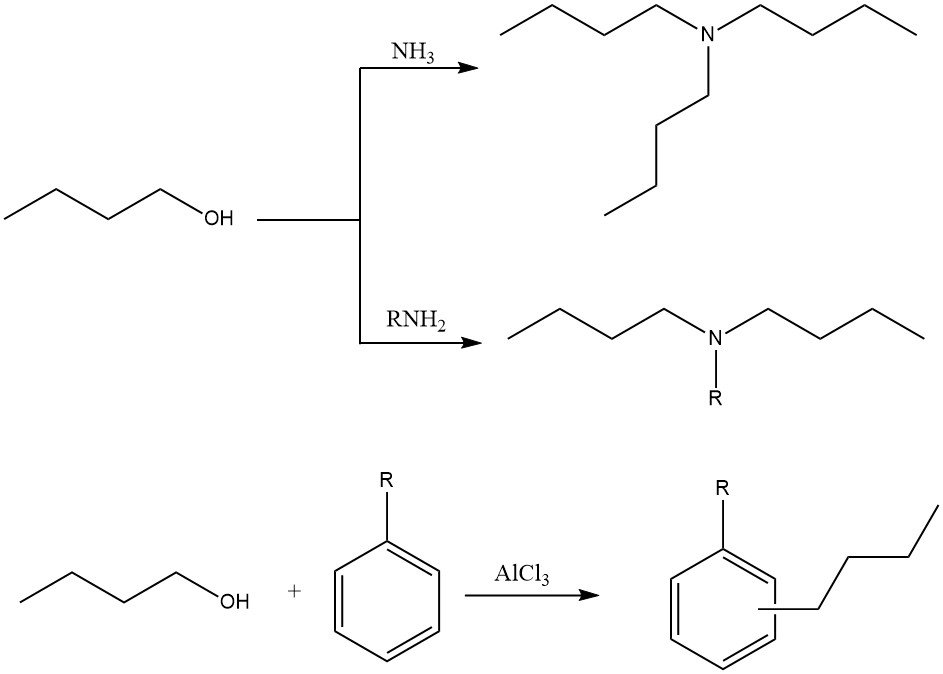
2.4. Estérification du 1-butanol
Le 1-butanol réagit avec les acides inorganiques et organiques pour former des esters butyliques, généralement catalysés par des acides. il peut également produire des esters avec des chlorures d’acide et des anhydrides d’acide.
3. Production de 1-Butanol
Parmi les différentes voies de production du 1-butanol, les trois suivantes dominent l’industrie :
- Hydroformylation du propène (synthèse oxo)
- Synthèse Reppe
- Hydrogénation du crotonaldéhyde
3.1. Production de 1-Butanol par Oxo Synthesis
La principale méthode utilisée dans la production de 1-butanol est l’hydroformylation du propène, suivie de l’hydrogénation des aldéhydes résultants. Lors de l’hydroformylation, du monoxyde de carbone et de l’hydrogène sont ajoutés à la double liaison du propène dans la phase liquide à l’aide de catalyseurs tels que des hydrocarbonyles ou des hydrocarbonyles substitués de Co, Rh ou Ru.
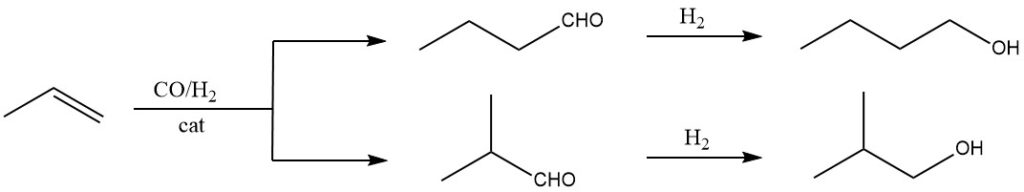
Cette étape initiale produit des aldéhydes avec un atome de C supplémentaire par rapport aux oléfines d’origine. Des mélanges isomères d’aldéhydes sont généralement obtenus, tels que le 1-butanal et le 2-méthylpropanal dans le cas du propène.
Différents procédés d’hydroformylation existent avec différentes conditions de réaction (pression, température) et systèmes catalytiques.
La méthode traditionnelle à haute pression, existante jusqu’au début des années 1970, fonctionne à des pressions de 20 à 30 × 106 Pa CO/H2 et à des températures de 100 à 180 °C, en utilisant du Co comme catalyseur. Ce procédé donne environ 75 % de 1-butanol et 25 % de 2-méthyl-1-propanol.
Les progrès récents ont conduit à de nouvelles variations de processus. Les méthodes à basse pression (1–5 × 106 Pa) employant des catalyseurs Rh modifiés donnent des rapports isomères d’environ 92 : 8 ou 95 : 5 pour le 1-butanol et le 2-méthyl-1-propanol. Cependant, l’utilisation de Rh non modifié peut augmenter le pourcentage de 2-méthyl-1-propanol jusqu’à environ 50 %.
L’hydrogénation catalytique des aldéhydes est l’étape ultérieure conduisant à la formation des alcools correspondants. En 2010, les principaux producteurs de butanol comprenaient BASF, Oxea Group et Dow Chemical Company.
3.2. Production de 1-Butanol par Reppe Process
Une méthode alternative pour la production de 1-butanol est la carbonylation du propène, une technique inventée par REPPE en 1942. Dans ce procédé, les oléfines, le monoxyde de carbone et l’eau subissent une réaction sous pression en présence d’un catalyseur tel que le sel d’ammonium tertiaire. d’hydrures de fer carbonyle polynucléaires.

Ce procédé utilise des conditions de réaction différentes de celles de l’hydroformylation catalysée avec Co conventionnelle. À une température plus basse (environ 100 °C) et une pression réduite (0,5 à 2 × 106 Pa), le butanol est directement formé à partir du propène.
Semblable à la synthèse oxo, le monoxyde de carbone peut être ajouté aux deux atomes de carbone de la double liaison. Par conséquent, lorsque le propène est utilisé comme matière première, le 1-butanol et le 2-méthyl-1-propanol sont obtenus dans un rapport de 86:14.
Le catalyseur utilisé, le triferrate de carbonyle, est sensible à la fois à l’air et aux températures élevées. En présence d’eau et de CO2, il se décompose en carbonate de fer.
Pour maintenir des vitesses de réaction suffisantes, le catalyseur doit être présent à des concentrations d’environ 10 % dans la solution réactionnelle, condition obtenue grâce à l’utilisation d’agents dissolvants tels que la N-alkylpyrrolidine.
Malgré des rapports n-iso favorables dans les produits résultants et des conditions de réaction plus douces, le procédé Reppe n’a pas atteint le même niveau de succès que l’hydroformylation du propène avec des catalyseurs au Co en raison du coût élevé de la technologie du procédé impliqué.
3.3. Production de 1-Butanol par hydrogénation de crotonaldéhyde
Jusqu’au milieu du XXe siècle, la production de 1-butanol à partir de crotonaldéhyde était la méthode privilégiée, mais elle a perdu de son importance en raison du développement de procédés plus compétitifs.

Ce processus impliquait des réactions en plusieurs étapes, comme suit :
- Condensation aldolique : l’acétaldéhyde subit une condensation aldolique à température et pression ambiantes, produisant de l’acétaldol avec une sélectivité d’environ 95 % et une conversion d’environ 60 %. L’acétaldéhyde n’ayant pas réagi peut être récupéré pour une utilisation ultérieure.
- Déshydratation : l’acétaldol avec de l’acide acétique ou de l’acide phosphorique favorise l’élimination de l’eau et la formation de crotonaldéhyde. Cette étape permet d’obtenir un rendement quasi quantitatif de crotonaldéhyde comme distillat primaire.
- Hydrogénation : divers procédés en phase gazeuse et liquide utilisent des catalyseurs au cuivre pour l’hydrogénation efficace du crotonaldéhyde en 1-butanol. Un rendement d’environ 1 000 kg de 1-butanol pour 1 350 kg d’acétaldéhyde est réalisable.
La viabilité économique de cette route dépend du coût des matières premières. À mesure que le pétrole brut, principale matière première de la synthèse oxo, devient rare et coûteux, l’éthanol dérivé de la fermentation peut émerger comme une alternative compétitive.
L’abondance et le caractère abordable de la biomasse dans les pays tropicaux et les pays en développement manquant de réserves de pétrole rendent cette voie particulièrement attrayante. L’éthanol peut être déshydrogéné en acétaldéhyde, servant de matière première pour ce processus.
3.4. Production de 1-Butanol par fermentation de biomasse
La production de 1-butanol via la fermentation de la biomasse était un processus industriel important qui a dominé le XXe siècle. Après l’isolement de Clostridium acetobutylicum par Chaim Weizmann en 1914, la fermentation dite ABE (acétone, butanol, éthanol) est devenue le deuxième processus biotechnologique en importance, dépassé seulement par la fermentation à l’éthanol.
D’autres souches de Clostridium productrices de butanol, comme C. beijerinckii et C. saccharoperbutylacetonicum, ont également émergé et ont été utilisées.
La fermentation ABE classique utilisait un processus discontinu d’une durée de 40 à 60 heures, utilisant de la biomasse contenant de l’amidon comme de la purée de maïs ou de la mélasse comme substrats. Les produits ont été récupérés et fractionnés par distillation, donnant des rendements totaux de 25 à 33 kg/100 kg de substrat.
Les concentrations de solvants ont atteint 12 à 20 g/L, avec une concentration maximale de butanol de 14 g/L. Cependant, la faiblesse des prix du pétrole brut et les coûts élevés des substrats à la fin du 20e siècle ont conduit au déclin de la fermentation industrielle ABE, les dernières usines ayant fermé en Afrique du Sud et en Chine en 2004.
Cependant, l’intérêt croissant pour les biocarburants et les produits chimiques a suscité un intérêt commercial pour la fermentation ABE, en particulier pour le butanol. De nouvelles usines de fermentation ont vu le jour au Brésil et en Chine, tandis que des sociétés comme Gevo et Butamax recherchent activement la production de butanol à partir de matières premières renouvelables.
Les efforts de recherche se concentrent sur la maximisation du rendement en butanol en tant que seul produit de fermentation, sur l’amélioration de la tolérance au butanol de l’organisme de production et sur l’exploration de substrats alternatifs non alimentaires comme la cellulose et l’hémicellulose.
Théoriquement, C. acetobutylicum peut générer 0,41 g de butanol par gramme de glucose en fonction de ses voies de fermentation. Les chercheurs étudient l’amélioration des souches et des conditions de croissance pour augmenter le rapport butanol/acétone, en utilisant l’ingénierie métabolique et le transfert de gènes pour améliorer la production de butanol dans d’autres organismes comme E. coli.
De plus, surmonter la faible tolérance au butanol de C. acetobutylicum implique la sélection de souches et des modifications de fermentation comme le dégazage ou l’absorption.
Le succès passé et la récente résurgence de la fermentation ABE mettent en évidence son potentiel pour une production durable de butanol. Les recherches en cours pour optimiser les rendements, la tolérance et l’utilisation du substrat ouvrent la voie à une industrie renouvelée du butanol d’origine biologique.
4. Utilisations du 1-Butanol
Aux États-Unis, environ 85 % du 1-butanol est utilisé principalement dans les revêtements de surface. Il sert directement de solvant aux vernis ou est transformé en solvants dérivés ou monomères. Il est mélangé avec du toluène, de l’éthanol ou des esters spécifiques pour la fabrication de laques nitrocellulosiques et utilisé seul comme diluant.
Le 1-Butanol est ajouté à une concentration de 5 à 10 % pour éviter le « rougissement » (opacité blanche indésirable) causé par les diluants, en particulier les plus volatils.
Il aide à réguler la viscosité et améliore les propriétés d’écoulement des vernis, et réduit les stries dans les peintures et laques à base de gomme/résine solubles dans l’alcool.
Le 1-Butanol est utilisé sous forme de mélange jusqu’à 20 % pour diluer les solvants courants (principalement les esters d’acides carboxyliques saturés, en particulier les acétates) pour le polystyrène et le caoutchouc chloré.
L’ester acrylique de 1-butanol est un composant clé des peintures au latex qui a gagné en importance depuis les années 1990 en raison de sa durabilité et de sa rentabilité.
Les esters butyliques des acides phtalique, adipique, sébacique, oléique, azélaïque, stéarique et phosphorique servent de plastifiants et d’additifs dans les revêtements de surface, le phtalate de di-1-butyle (DBP) étant le plus important. Toutefois, la consommation de DBP a stagné ou légèrement diminué depuis 2000 dans certains pays.
Le 1-Butanol est utilisé dans la production de butylamines, notamment aux États-Unis, en Allemagne et en Belgique. Il agit également comme bain de coagulation pour le filage des fibres acryliques et pour la teinture des fibres d’alcool polyvinylique.
5. Toxicologie du 1-Butanol
Toxicité aiguë :
- Le 1-butanol présente une toxicité modérée, les doses mortelles les plus faibles signalées étant de 790 mg/kg (orale, rat) et 3 400 mg/kg (cutanée, lapin).
- L’inhalation de concentrations élevées peut provoquer une irritation respiratoire et oculaire, un manque de coordination et une narcose. La concentration létale la plus basse publiée est de 24,3 mg/L (rats, inhalation, 4 heures).
- Le contact oculaire direct avec le 1-butanol provoque une grave irritation de la cornée.
- L’irritation cutanée est légère à modérée chez le lapin.
- Les tests génétiques (test d’Ames) indiquent des propriétés non mutagènes.
Effets chroniques :
- L’exposition professionnelle aux vapeurs de 1-butanol à 200 ppm et plus a été associée à une inflammation cornéenne, une sensation de brûlure, une vision floue et une perte auditive.
- Une exposition répétée à 100 ppm peut provoquer une légère irritation des yeux.
- Des concentrations plus faibles (25 ppm) auraient provoqué une légère irritation et des maux de tête chez certaines personnes.
- Une dermatite des doigts et des mains peut survenir en cas de contact direct avec la peau.
Limites d’exposition :
- Limite plafond de la valeur limite de seuil (TLV) : 50 ppm (peau) [ACGIH]
- Concentration maximale admissible (valeur MAK) : 100 mL/m³ [Commission allemande pour la détermination des substances dangereuses]
- Valeur TRGS 900 : 100 mL/m³ [Règles techniques allemandes pour les substances dangereuses]
Références
- Butanols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_463.pub3
- Butyl Alcohols; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0221202502091212.a01.pub2




