Qu’est-ce que l’éthanol ?
L’éthanol, également connu sous le nom d’alcool éthylique, est l’un des alcools les plus importants, dont la formule chimique est CH3CH2OH. Il s’agit d’un liquide incolore et volatil à l’odeur caractéristique, largement utilisé dans une large gamme d’applications. Les autres noms de l’éthanol comprennent l’alcool spiritueux, l’alcool de vin, l’alcool de grain, l’alcool absolu et l’hydrate d’éthyle.
L’alcool éthylique est un composant bien connu des boissons alcoolisées, qui sont produites par la fermentation de glucides fermentescibles. Le bouillon de fermentation lui-même peut être consommé comme boisson, comme dans le cas de la bière ou du vin, ou l’alcool peut être concentré pour produire des spiritueux à teneur en alcool plus élevée.
La bière contient normalement 4 à 6 % en volume d’éthanol, le vin en contient 12 à 14 % et les spiritueux peuvent en contenir entre 30 et 50 % en volume. D’autres boissons alcoolisées contiennent différentes quantités d’éthanol.
Pour les utilisations industrielles et commerciales autres que les boissons alcoolisées, l’éthanol est dénaturé en ajoutant des substances telles que le méthanol, la pyridine, le formaldéhyde ou le sublimé. L’éthanol dénaturé est utilisé comme solvant, matière première pour la fabrication de produits chimiques et carburant.
L’histoire de l’éthanol remonte à l’Antiquité. La bière fermentée était consommée à Babylone, tandis que la production de vin remonte à environ 3000 av. J.-C. dans l’Égypte ancienne, où il était préparé et consommé par les pharaons.
Le processus de distillation est probablement né entre le 10e et le 14e siècle. À cette époque, les effets « spirituels » de l’éthanol ont été reconnus, ce qui a donné naissance au terme « spiritus » pour les boissons alcoolisées. Les premiers distillats de vin étaient principalement utilisés à des fins médicinales.
Jusqu’au XVIIe siècle, la fermentation alcoolique était considérée comme un processus de détérioration. La nature de la fermentation a été clarifiée pour la première fois au XIXe siècle avec la découverte du microscope, qui a révélé que les cellules de levure étaient des organismes vivants. Cependant, il a fallu environ 150 ans pour reconnaître le rôle de ces organismes dans le processus de fermentation.
Table des matières
1. Propriétés physiques de l’éthanol
L’éthanol pur (alcool absolu) est un liquide volatil, inflammable, clair et incolore avec une odeur agréable. Il est miscible avec l’eau, l’éther, l’acétone, le benzène et certains autres solvants organiques. L’éthanol anhydre est hygroscopique.
L’éthanol forme un mélange azéotropique avec l’eau, qui contient 95,57 % en poids d’éthanol et 4,43 % en poids d’eau. Par conséquent, la concentration la plus élevée d’éthanol qui peut être obtenue par distillation d’un mélange éthanol-eau est de 95,57 % en poids. La distillation azéotropique, à l’aide d’un solvant tertiaire (par exemple, le benzène), doit être introduite pour produire de l’éthanol absolu (anhydre).
Les propriétés physiques importantes de l’éthanol anhydre sont répertoriées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro CAS | [64-17-5] |
| Formule chimique | C2H5OH |
| Poids moléculaire | 46,7 g/mol |
| Point de congélation | -114,1 °C |
| Point d'ébullition | 78,32 °C |
| Température critique | 243,1 °C |
| Pression critique | 6383,48 kPa |
| Volume critique | 0,167 L/mol |
| Densité | 0,7893 g/mL |
| Indice de réfraction | 1,36143 |
| Tension superficielle (à 25 °C) | 23,1 mN/m |
| Viscosité (à 20 °C) | 1,17 mPa·s |
| Solubilité dans l'eau (à 20 °C) | Miscible |
| Chaleur de vaporisation (au point d'ébullition normal) | 839,31 J/g |
| Chaleur de combustion (à 25 °C) | 29676,69 J/g |
| Chaleur de fusion | 104,6 J/g |
| Limites d'inflammabilité dans l'air | Inférieure : 4,3 % en volume Supérieur : 19,0 % en volume |
| Température d'auto-inflammation | 423 °C |
| Point d'éclair | 14 °C (coupe fermée) |
| Chaleur spécifique (à 20 °C) | 2,42 J/(g·°C) |
| Conductivité thermique (à 20 °C) | 0,170 W/(m·K) |
| Moment dipolaire (liquide à 25 °C) | 5,67 × 10-30 |
| Susceptibilité magnétique (à 20 °C) | 0,734 × 10-6 |
| Constante diélectrique (à 20 °C) | 25,7 |
2. Réactions chimiques de l’éthanol
La réactivité chimique de l’éthanol est principalement influencée par son groupe hydroxyle (-OH), qui participe à de nombreuses réactions industrielles importantes telles que la déshydratation, l’halogénation, la formation d’esters et l’oxydation.
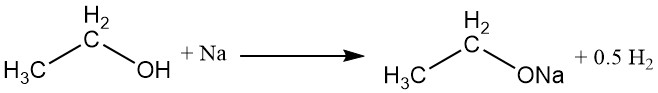
L’atome d’hydrogène du groupe hydroxyle peut être remplacé par un métal actif, tel que le sodium, le potassium ou le calcium, pour former des éthoxydes métalliques (éthylates) avec dégagement d’hydrogène gazeux.
CH3CH2OH + M → CH3CH2OM + 1/2 H2
L’éthoxyde de sodium, un éthoxyde métallique couramment utilisé, peut être préparé par réaction d’alcool éthylique absolu avec du sodium ou par reflux d’alcool éthylique absolu avec de l’hydroxyde de sodium anhydre. Dans le commerce, l’eau est éliminée du mélange réactionnel par distillation azéotropique avec du benzène.
L’éthoxyde de sodium s’hydrolyse facilement pour produire de l’alcool éthylique, des ions sodium et des ions hydroxyde.
L’éthoxyde de sodium est utilisé comme agent de condensation et de réduction dans la synthèse organique. Il réagit avec le monochlorure de soufre pour produire du diéthylthiosulfite. De plus, l’éthoxyde de sodium est un réactif pour la production commerciale de barbituriques, d’orthoformiate d’éthyle et d’autres produits chimiques.
L’aluminium et le magnésium peuvent également réagir avec l’éthanol pour former des éthoxydes, mais cette réaction nécessite une catalyse par amalgamation du métal.
Les copeaux d’aluminium bien nettoyés réagissent avec l’éthanol à température ambiante en présence de chlorure mercurique. Cette réaction peut être réalisée dans un autoclave à des températures élevées sans catalyseur ou avec l’ajout d’éthoxyde de sodium.
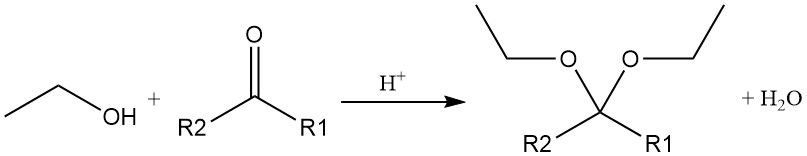
Le groupe hydroxyle de l’éthanol peut également participer à d’autres réactions, telles que l’ouverture de cycle des époxydes pour former des hydroxyéthers et l’ajout à l’acétylène pour former de l’éthylvinyléther. Ces réactions sont catalysées par des conditions acides et basiques.
L’addition acide-catalysée d’éthanol à l’acétylène ou à l’éther vinylique produit des acétals, qui sont également produits par la réaction acide-catalysée de l’alcool éthylique avec un aldéhyde ou une cétone.
Le groupe hydroxyle peut être remplacé par des halogènes provenant d’halogénures d’acides inorganiques ou d’halogénures de phosphore, ce qui conduit à la formation d’esters éthyliques de l’acide et d’un halogénure d’éthyle. Le trichlorure de phosphore et le chlorure de thionyle sont couramment utilisés pour produire du chlorure d’éthyle, avec comme sous-produits le phosphite de triéthyle et le sulfite de diéthyle.
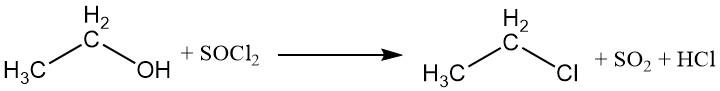
Les acides halogénés peuvent également réagir avec l’éthanol pour produire des halogénures d’alkyle. La réactivité des acides halogénés varie, l’acide iodhydrique étant le plus réactif. Le chlorure d’éthyle peut être préparé par réaction entre l’éthanol et le chlorure d’hydrogène.
CH3CH2OH + HX → CH3CH2X + H2O
La réaction de l’éthanol avec le bromure d’hydrogène produit du bromure d’éthyle, précurseur du réactif de Grignard et de diverses amines éthyliques.
2.1. Estérification
L’éthanol réagit avec les acides inorganiques et organiques, les anhydrides d’acides et les halogénures d’acides pour produire des esters. Si un acide inorganique contenant de l’oxygène, tel que l’acide sulfurique ou l’acide nitrique, réagit avec de l’alcool éthylique, l’ester obtenu contient une liaison carbone-oxygène qui peut être hydrolysée.
Les esters organiques sont formés par une réaction de déshydratation entre l’éthanol et un acide organique. Cette réaction est réversible et atteint lentement l’équilibre. Des catalyseurs acides tels que l’acide sulfurique, l’acide chlorhydrique, le trifluorure de bore et l’acide p-toluènesulfonique sont couramment utilisés pour accélérer le processus d’estérification.
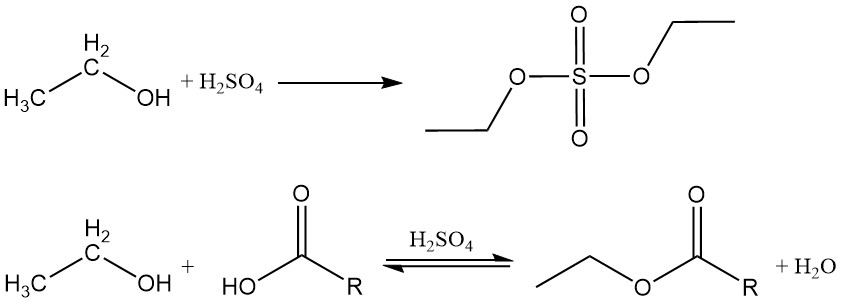
L’éthanol réagit également avec les anhydrides d’acides ou les halogénures d’acides pour former les esters correspondants.
La conversion directe de l’éthanol en acétate d’éthyle se fait par l’intermédiaire de l’acétaldéhyde et de sa condensation ultérieure (réaction de Tishchenko). Un rendement en acétate d’éthyle d’environ 24 % peut être obtenu en utilisant un catalyseur à base d’oxyde de cuivre contenant 0,1 à 0,2 % de thorine à 350 °C.
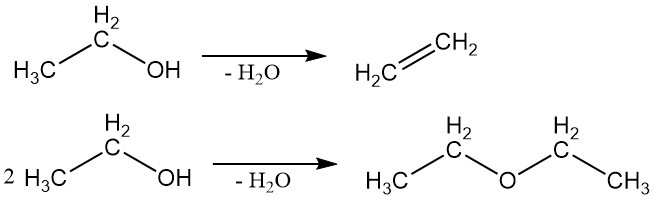
2.2. Déshydratation
L’éthanol peut subir une déshydratation pour produire de l’éthylène ou de l’éther éthylique. Le produit spécifique formé dépend des conditions de réaction.
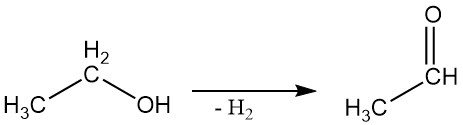
2.3. Déshydrogénation
L’alcool éthylique peut être déshydrogéné en acétaldéhyde dans une réaction en phase vapeur à l’aide de catalyseurs appropriés.
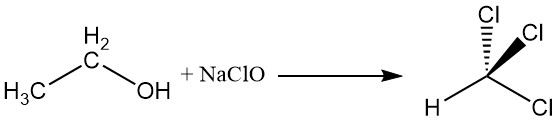
2.4. Réaction des haloformes
L’alcool éthylique réagit avec l’hypochlorite de sodium pour produire du chloroforme, une réaction connue sous le nom de réaction des haloformes.
3. Production industrielle d’éthanol
L’éthanol est produit par des procédés de synthèse et de fermentation. L’une des premières voies de synthèse impliquait la réaction de l’éthylène avec de l’acide sulfurique, un processus découvert il y a plus d’un siècle.
Cependant, la production industrielle d’éthanol synthétique n’est devenue économiquement viable que dans les années 1930, lorsque la Carbide and Chemical Corporation a développé le procédé d’hydratation indirecte.
Ce procédé, qui impliquait l’absorption de l’éthylène dans l’acide sulfurique suivie d’une hydrolyse, a depuis été largement remplacé par l’hydratation catalytique directe de l’éthylène, introduite par Shell Chemical Company en 1948.
Au cours des dernières décennies, des méthodes alternatives de synthèse de l’éthanol ont émergé, utilisant des matières premières à base de charbon telles que le méthanol ou le gaz de synthèse. Ces procédés comprennent l’homologation, la carbonylation et la conversion directe du gaz de synthèse en éthanol.
Cependant, la fermentation du sucre, de l’amidon ou de la cellulose reste la méthode prédominante pour la production d’éthanol, représentant jusqu’à 90 % de la production mondiale.
3.1. Production d’éthanol par hydratation catalytique directe de l’éthylène
L’hydratation de l’éthylène en éthanol est une réaction réversible. La constante d’équilibre de cette réaction est influencée par la température et la pression. Des températures plus élevées favorisent une conversion plus élevée de l’éthylène mais augmentent également le taux de réactions secondaires, telles que la formation d’éther diéthylique.
Des études cinétiques ont été menées sur divers catalyseurs, notamment l’acide phosphorique-gel de silice et l’oxyde de tungstène bleu-gel de silice. Ces études ont fourni des informations sur l’énergie d’activation et la vitesse de réaction dans différentes conditions.
Plusieurs variables de procédé, notamment la pression, la température et le rapport molaire eau/éthylène, ont un impact sur la conversion de l’éthylène. Dans des conditions de réacteur typiques (alimentation éthylène-eau approximativement équimolaire, 250–300 °C, 5–8 MPa), la conversion à l’équilibre de l’éthylène varie de 7 à 22 %.
Outre la réaction d’hydratation souhaitée, des réactions secondaires peuvent se produire, conduisant à la formation de sous-produits. À des températures plus basses, l’éther diéthylique peut être produit, tandis qu’à des pressions plus élevées, la polymérisation de l’éthylène en butènes et en oléfines supérieures peut avoir lieu.
Le mécanisme proposé pour l’hydratation de l’éthylène comprend quatre étapes :
- Un proton est ajouté à la molécule d’éthylène pour former un complexe π.
- Le complexe π est converti en carbocation.
- Une molécule d’eau est ajoutée au carbocation.
- Un proton est retiré de l’éthanol protoné pour produire de l’éthanol.
Catalyseurs
L’hydratation de l’éthylène en éthanol est catalysée généralement par des catalyseurs acides. L’acide phosphorique supporté sur divers matériaux, dont la terre de diatomées (kieselguhr, célite), la montmorillonite, la bentonite, le gel de silice et l’opoka, fait partie des catalyseurs les plus utilisés pour cette réaction.
En plus des catalyseurs à base d’acide phosphorique, d’autres catalyseurs ont été étudiés, tels que les oxydes acides, les hétéropolyacides, les zéolites et les sels. Ces matériaux offrent des avantages potentiels en termes d’activité, de sélectivité et de stabilité.
Dans les conditions de réaction, le support doit être résistant à l’acide phosphorique mais capable de le retenir en grande quantité ; il doit également avoir une résistance mécanique adéquate et une durée de vie suffisamment longue ; et, enfin, il doit fournir un catalyseur actif et sélectif pour l’hydratation.
Pour optimiser les performances du catalyseur, le support est prétraité avec des acides minéraux, tels que l’acide chlorhydrique ou sulfurique, pour éliminer les impuretés comme le fer et l’aluminium, et imprégné d’acide phosphorique à 50 à 77 %.
Le traitement thermique à des températures élevées (700–1100 °C) est souvent utilisé pour améliorer la liaison de l’acide phosphorique au support. Bien que ce traitement puisse légèrement réduire l’activité et la sélectivité initiales du catalyseur, il peut améliorer considérablement sa stabilité et sa durabilité à long terme.
Processus de production
L’hydratation catalytique de l’éthylène en éthanol implique une série d’étapes, comme illustré dans la Figure 1.
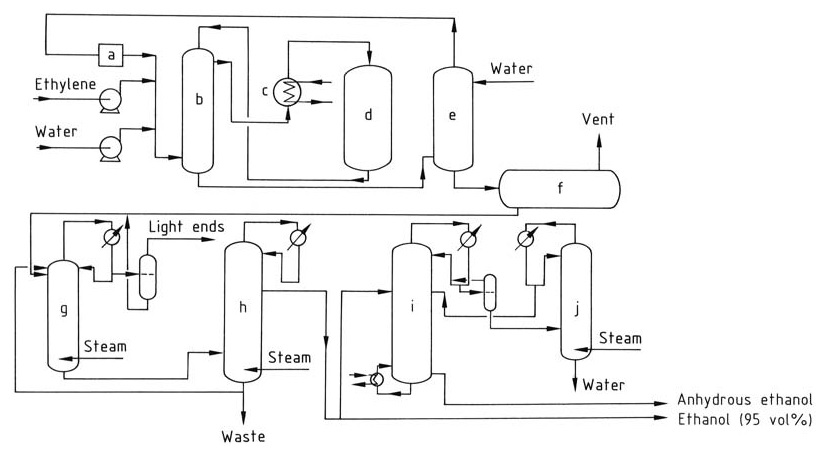
a) Compresseur de circulation ; b) Échangeur de chaleur ; c) Surchauffeur ; d) Réacteur ; e) Laveur ; f) Réservoir d'éthanol brut ; g) Colonne de distillation extractive ; h) Colonne de concentration ; i) Déshydratation ; j) Colonne de concentration
L’éthylène et l’eau déionisée, dans un rapport molaire compris entre 1:0,3 et 1:0,8, sont chauffés à 250–300 °C à 6–8 MPa en passant par un échangeur de chaleur et un surchauffeur. La réaction est exothermique, libérant de la chaleur qui peut être récupérée et utilisée pour préchauffer le flux d’alimentation.
Le flux gazeux est lavé à l’eau pour éliminer tout éthanol résiduel. Le gaz purifié est ensuite recomprimé et recyclé vers le réacteur pour maintenir la concentration d’éthylène souhaitée.
Les produits de réaction sont refroidis et condensés pour séparer les phases liquide et gazeuse. Le produit d’éthanol brut recueilli dans le bac de lavage contient environ 10–25 % d’éthanol en poids et est encore purifié par distillation pour obtenir un azéotrope éthanol-eau à 95 %.
Pour produire de l’éthanol anhydre, l’éthanol à 95 % peut être déshydraté par distillation azéotropique.
Lors de l’hydratation catalytique de l’éthylène, une partie du catalyseur à base d’acide phosphorique peut être entraînée par le flux gazeux. Pour éviter l’accumulation d’acide dans l’équipement en aval, une solution diluée d’hydroxyde de sodium est injectée pour la neutraliser.
L’acide phosphorique perdu en raison de l’entraînement et de l’évaporation est reconstitué en le pulvérisant périodiquement sur le lit de catalyseur pour assurer une concentration constante du catalyseur tout au long du processus de réaction.
L’éther diéthylique, environ 2 %, est un sous-produit courant de la réaction et peut être récupéré et purifié pour une utilisation séparée ou recyclé vers le réacteur. L’acétaldéhyde, une impureté potentielle, est converti en éthanol par hydrogénation pour éviter la formation de composés indésirables comme le crotonaldéhyde.
L’équipement de traitement comprend des réacteurs, des échangeurs de chaleur, des colonnes de distillation et des tuyaux associés. Les réacteurs sont généralement en acier avec un revêtement en cuivre ou en carbone pour les protéger contre la corrosion par l’acide phosphorique. Les échangeurs de chaleur et les tuyaux exposés à l’acide phosphorique sont également construits en cuivre ou en alliages de cuivre.
Le procédé génère un minimum de déchets. L’éthylène évacué, qui représente moins de 15 % de la charge totale, peut être renvoyé à l’usine d’éthylène ou incinéré. Les eaux usées issues de la distillation sont faibles en composés organiques et en phosphate (environ 0,3 kg de Na2HPO4 par mètre cube) et peuvent être facilement éliminées.
3.2. Production d’éthanol par hydratation indirecte de l’éthylène
L’hydratation indirecte de l’éthylène à l’aide d’acide sulfurique implique deux étapes principales : l’absorption de l’éthylène et l’hydrolyse du sulfate produit.
L’éthylène réagit avec l’acide sulfurique concentré pour former de l’hydrogénosulfate d’éthyle et du sulfate de diéthyle, qui sont ensuite hydrolysés avec de l’eau pour produire de l’éthanol et de l’éther diéthylique.
Des études cinétiques ont montré que les étapes d’absorption et d’hydrolyse suivent un mécanisme de réaction similaire à celui du processus d’hydratation directe, mais sont influencées par la solubilité de l’éthylène dans l’acide sulfurique.
Les produits finaux du processus d’hydratation indirecte sont l’éthanol et l’éther diéthylique (5 à 10 %). Le rendement en éther diéthylique peut être contrôlé en ajustant les conditions de réaction, telles que le rapport éthylène/acide sulfurique et les conditions d’hydrolyse.
Les sulfates d’éthyle peuvent être transestérifiés avec de l’acide acétique à 104 °C pour produire de l’acétate d’éthyle. L’acétate d’éthyle est ensuite récupéré par distillation et hydrolysé en éthanol et en acide acétique. Ce procédé offre un avantage par rapport à la méthode d’hydrolyse traditionnelle en évitant la nécessité d’une reconcentration de l’acide sulfurique.
Processus de production
La figure 2 montre le schéma de principe de la production d’éthanol par hydratation indirecte de l’éthylène.
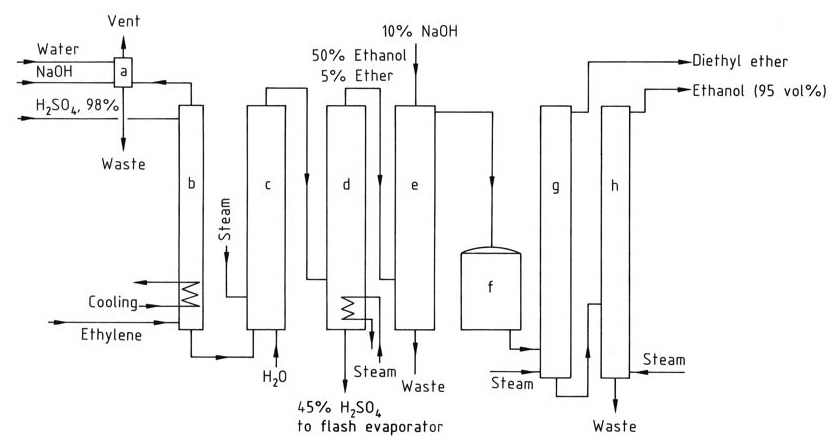
a) Colonne de lavage du gaz résiduel ; b) Absorbeur ; c) Hydrolyseur ; d) Colonne de stripping ; e) Colonne de lavage de l'éthanol brut ; f) Réservoir de produit brut ; g) Colonne de distillation de l'éther diéthylique ; h) Colonne de distillation de l'éthanol
Le gaz d’alimentation pour le procédé d’hydratation indirecte doit contenir au moins 35 % d’éthylène et doit être exempt d’homologues supérieurs susceptibles de provoquer la formation de résine. Des gaz inertes tels que le méthane et l’éthane peuvent être ajoutés.
L’absorption d’éthylène augmente avec la pression, qui se situe généralement entre 1 et 3,5 MPa. Chaque mole d’acide sulfurique peut absorber jusqu’à 1,4 mole d’éthylène. L’absorption est réalisée dans des tours de lavage à 65–85 °C, et les températures supérieures à 90 °C doivent être évitées pour empêcher la formation de résine.
L’éthylène absorbé réagit avec l’acide sulfurique pour former des sulfates d’éthyle après agitation pendant plusieurs heures. L’hydrolyse de ces sulfates s’effectue en deux étapes : une hydrolyse à basse température (70 °C) pour convertir le sulfate de diéthyle et une hydrolyse ultérieure à haute température (100 °C) pendant environ 1 heure pour terminer la réaction.
L’acide sulfurique est dilué à 40–55 % en poids, et l’éthanol et l’éther diéthylique sont récupérés du mélange réactionnel via une colonne de stripping. Le mélange de produits est ensuite neutralisé avec de l’hydroxyde de sodium et l’éther diéthylique est éliminé dans une colonne de distillation séparée.
L’éthanol est ensuite purifié par distillation pour obtenir un azéotrope éthanol-eau à 95 %.
La reconcentration de l’acide sulfurique dilué est une étape coûteuse du processus d’hydratation indirecte, caractérisée par une consommation d’énergie élevée, des problèmes de corrosion et une oxydation des composés organiques (formation de goudron).
Pour surmonter ces défis, le fonctionnement à des pressions inférieures à 0,5 MPa et l’ajout de sulfate d’argent jusqu’à 7 % à l’acide sulfurique peuvent améliorer l’efficacité du processus et réduire les besoins de reconcentration.
Le choix des matériaux de construction dépend des étapes spécifiques du processus. L’acier est couramment utilisé pour les équipements d’absorption et de distillation. Le plomb et les matériaux résistants aux acides conviennent à l’hydrolyse, tandis que la silumine, le tantale, la fonte et le plomb sont utilisés pour la reconcentration de l’acide sulfurique.
3.3. Autres méthodes
D’autres méthodes de synthèse d’éthanol à partir de méthanol et de gaz de synthèse ont été développées. Ces procédés sont susceptibles d’avoir une importance industrielle à l’avenir car ils utilisent des matières premières disponibles à partir du charbon et non dérivées du pétrole.
3.3.1. Homologation du méthanol
L’homologation, un procédé qui étend la chaîne carbonée d’un alcool d’un atome de carbone, a été explorée comme voie alternative pour la synthèse de l’éthanol. Le méthanol peut réagir avec le gaz de synthèse (CO + H2) en présence d’un catalyseur au cobalt carbonyle pour produire de l’éthanol.
Les premières tentatives d’homologation du méthanol ont donné lieu à de faibles rendements en éthanol et à des mélanges de produits complexes. Cependant, les progrès dans la conception des catalyseurs et les conditions de réaction ont amélioré la sélectivité pour l’éthanol.
Des études ont montré que l’utilisation du tétrahydrofurane comme solvant ou l’ajout d’iode ou d’iodure avec des phosphines organiques peut améliorer la sélectivité de l’éthanol.
3.3.2. Carbonylation du méthanol et de l’acétate de méthyle
Une autre approche de production d’éthanol est la carbonylation du méthanol en acide acétique, suivie d’une hydrogénation. Cette méthode est basée sur le procédé Monsanto de synthèse de l’acide acétique, qui utilise un catalyseur rhodium carbonyl-iode.
Bien que l’hydrogénation directe de l’acide acétique en éthanol soit possible, elle nécessite un équipement haute pression et peut être corrosive. Une méthode plus pratique est l’estérification de l’acide acétique avec de l’éthanol pour former de l’acétate d’éthyle, suivie d’une hydrogénolyse de l’acétate d’éthyle en éthanol.
Plusieurs variantes du processus de carbonylation ont été développées, notamment l’utilisation de l’acétate de méthyle comme matière de départ. L’acétate de méthyle peut être carbonylé en anhydride acétique, qui est ensuite mis à réagir avec de l’éthanol et du méthanol pour produire des acétates d’éthyle et de méthyle. L’acétate d’éthyle peut ensuite être hydrogéné en éthanol.
3.3.3. Conversion du gaz de synthèse en éthanol
Synthèse par catalyse hétérogène
Les efforts pour convertir le gaz de synthèse (CO + H2) en éthanol se sont concentrés sur la modification des catalyseurs existants utilisés pour la synthèse du méthanol. Des études ont montré que l’incorporation de métaux alcalins, de cobalt ou d’autres éléments peut améliorer les rendements en éthanol.
Des instituts de recherche comme l’Institut Français du Pétrole ont développé des catalyseurs complexes contenant de multiples éléments, dont le cuivre, le cobalt, le chrome, le potassium, le lanthane et d’autres. Ces catalyseurs peuvent produire des mélanges d’alcools contenant une quantité importante d’éthanol, de méthanol et d’alcools supérieurs.
Les catalyseurs à base de métaux du groupe du platine, tels que le rhodium et le trioxyde de lanthane, se sont également révélés prometteurs dans la conversion du gaz de synthèse en éthanol. Ces catalyseurs peuvent atteindre des sélectivités élevées en éthanol à 200–240 °C et dans des conditions de pression atmosphérique.
Synthèse par catalyse homogène
La catalyse homogène utilisant des complexes de ruthénium a été explorée pour la conversion du gaz de synthèse en éthanol. Les catalyseurs au ruthénium, en combinaison avec des composés organiques du phosphore, peuvent atteindre des sélectivités d’éthanol supérieures à 50 %.
Divers solvants et additifs, tels que l’oxyde de tripropylphosphine, le bromure de tétrabutylphosphonium et les bromures d’alkyltriphénylphosphonium, ont été étudiés pour optimiser la production d’éthanol.
3.4. Production d’éthanol par fermentation
La fermentation, un processus de biosynthèse, est utilisée depuis des siècles pour produire divers produits, dont l’éthanol. Alors que le maïs a été la principale matière première au cours des dernières décennies, d’autres matières agricoles, telles que la mélasse, les céréales, la canne à sucre, les betteraves, les fruits, le lactosérum et les eaux usées au sulfite, peuvent également être utilisées.
Des recherches sont en cours pour explorer la faisabilité de la fermentation de déchets tels que les ordures ménagères.
L’adéquation des différentes matières premières à la production d’éthanol dépend de facteurs tels que la disponibilité, le coût, la teneur en sucre et le rendement en éthanol. Certains produits agricoles, comme les pommes de terre, peuvent être économiquement moins intéressants en raison du faible rendement en éthanol et des coûts de transport élevés.
Les matières fermentescibles peuvent être classées en trois grandes catégories :
- Sucres : la fermentation directe des sucres obtenus à partir de la canne à sucre, de la betterave sucrière, de la mélasse ou des fruits est possible.
- Amidons : les amidons des céréales, des pommes de terre ou des racines doivent être hydrolysés en sucres fermentescibles à l’aide d’enzymes provenant du malt ou des moisissures.
- Cellulose : les matières riches en cellulose, notamment le bois, les résidus agricoles et les eaux usées de sulfite, doivent être converties en sucres à l’aide d’acides minéraux avant la fermentation.
La fermentation est la conversion des sucres en éthanol et en dioxyde de carbone dans des conditions anaérobies. Bien que divers micro-organismes puissent fermenter les sucres, les levures, notamment Saccharomyces cerevisiae, sont couramment utilisées en raison de leur grande tolérance à l’éthanol et de leur efficacité.
La fermentation du glucose se déroule par la voie de la glycolyse, qui est une série de réactions enzymatiques qui décomposent le glucose en pyruvate, produisant de l’ATP (adénosine triphosphate) comme énergie. Dans des conditions anaérobies, le pyruvate est converti en acétaldéhyde, qui est ensuite réduit en éthanol par l’alcool déshydrogénase.
Les conditions de fermentation optimales varient en fonction de la souche de levure, de la matière première et des spécifications du produit souhaité. Les principaux facteurs influençant la fermentation sont :
- Température : la plupart des levures préfèrent une plage de température de 25 à 30 °C pour une croissance et une production d’éthanol optimales.
- pH : le pH doit être maintenu dans une plage spécifique, généralement entre 4,5 et 5,5, pour garantir une activité optimale des levures et éviter la contamination bactérienne.
- Disponibilité des nutriments : les levures ont besoin d’un apport équilibré de nutriments, notamment d’azote, de phosphore et de micronutriments, pour leur croissance et une fermentation efficace.
- Concentration en sucre : la concentration en sucre doit être maintenue dans une plage appropriée pour éviter l’inhibition de la croissance des levures et de la production d’éthanol. Des concentrations excessives en sucre peuvent entraîner un stress osmotique et une efficacité de fermentation réduite.
La fermentation peut être réalisée par lots ou en continu. Dans la fermentation par lots, un volume défini de milieu contenant du sucre et des nutriments est inoculé avec de la levure et laissé fermenter jusqu’à ce que la concentration d’éthanol souhaitée soit atteinte.
Dans la fermentation continue, un flux constant de milieu est introduit dans un fermenteur tandis que le bouillon fermenté est continuellement retiré, ce qui permet une production d’éthanol plus efficace et plus cohérente.
Plusieurs défis peuvent survenir pendant la fermentation, notamment la contamination bactérienne ou fongique et l’inhibition de l’activité des levures par des concentrations élevées d’éthanol, l’accumulation de sous-produits et la limitation des nutriments.
4. Utilisations de l’éthanol
Depuis l’Antiquité, l’éthanol a été utilisé pour une grande variété d’applications. Il est utilisé comme composant des boissons alcoolisées, comme solvant, comme matière première pour la synthèse chimique et comme carburant.
Historiquement, l’éthanol issu de la fermentation a été principalement utilisé pour les boissons et les produits chimiques spéciaux, tandis que l’éthanol synthétisé chimiquement a été utilisé pour l’industrie. Cependant, certains pays, comme le Brésil et l’Inde, utilisent l’éthanol de fermentation pour des applications industrielles.
Pour faciliter l’utilisation de l’éthanol dans les processus industriels à moindre coût, de nombreux pays ont mis en œuvre des politiques de franchise de taxes pour l’éthanol industriel et dénaturé. Ces politiques incluent souvent des contrôles financiers, administratifs et chimiques pour empêcher l’utilisation abusive de l’éthanol détaxé pour les boissons.
Sur la base de ces réglementations, l’éthanol industriel est classé en quatre types : l’alcool complètement dénaturé, les solvants exclusifs et les solvants industriels spéciaux, l’alcool spécialement dénaturé et l’éthanol pur (absolu).
L’éthanol est fréquemment ajouté à l’essence comme additif de carburant, généralement dans des proportions allant de 5 % à 85 % d’éthanol (connu sous le nom de E5 à E85) ou comme diluant pour essence. En raison de sa capacité à être produit à partir de nombreuses ressources, telles que le maïs, la canne à sucre et les matières cellulosiques, l’éthanol devient de plus en plus populaire comme source de carburant.
En plus de son utilisation dans les boissons alcoolisées traditionnelles, l’éthanol est également utilisé dans la production de diverses liqueurs aromatisées et comme base pour de nombreux cocktails.
L’éthanol est un solvant largement utilisé, juste après l’eau, principalement dans la production d’articles de toilette, de cosmétiques, de détergents, de désinfectants, de produits pharmaceutiques, de revêtements de surface et de produits alimentaires et pharmaceutiques.
Si l’éthanol synthétique et de fermentation peuvent tous deux être utilisés comme solvants, l’éthanol de fermentation est généralement préféré, en particulier en Europe, pour les applications impliquant la consommation humaine ou l’utilisation corporelle.
L’éthanol est un désinfectant puissant qui est couramment utilisé dans les hôpitaux, les laboratoires et autres établissements de soins de santé pour tuer les bactéries, les virus et autres micro-organismes nocifs. Il est également utilisé dans la production de désinfectants pour les mains et de sprays désinfectants.
L’éthanol est utilisé comme matière première pour la production de divers produits chimiques, notamment l’acétaldéhyde, le butadiène, l’éther diéthylique, l’acétate d’éthyle, les éthylamines, l’éthylène, les éthers de glycol et d’autres produits formés par des réactions avec l’oxyde d’éthylène ou les époxydes et le vinaigre.
Certains pays, comme le Brésil, ont mis en place des industries chimiques à base d’éthanol pour produire des produits chimiques comme l’acétaldéhyde, traditionnellement dérivés de produits pétrochimiques dans des pays disposant d’abondantes ressources en pétrole brut.
Le Brésil était le plus grand producteur mondial d’éthanol à partir du sucre, avec plus de 95 % de la production totale en 1985-1986. La majeure partie de l’éthanol produit au Brésil est utilisée comme carburant, tandis qu’une plus petite fraction est utilisée comme matière première chimique.
En 1978, l’Inde a utilisé plus de 50 % de sa production totale d’éthanol pour la fabrication chimique de produits tels que l’acétaldéhyde, l’acide acétique, l’anhydride acétique, le DDT, les acétates organiques, l’acétone, le butanol, le polyéthylène, le chlorure de polyvinyle et le styrène.
5. Toxicologie de l’éthanol
L’éthanol présente une toxicité orale aiguë chez le rat, avec des valeurs de DL50 allant de 11,5 à 13,7 g/kg. Des valeurs de DL50 similaires de 9,5, 9,6, 9,9 et 6 g/kg ont été signalées chez la souris, le cobaye, le lapin et le chien, respectivement.
L’éthanol peut provoquer une irritation légère à sévère de l’œil du lapin, selon la concentration et la quantité utilisée. Cependant, il n’est pas significativement irritant pour la peau intacte.
L’inhalation d’éthanol peut provoquer une irritation des muqueuses, une excitation, une ataxie, une somnolence, une narcose et, finalement, la mort par insuffisance respiratoire. Les concentrations létales pour les souris, les cobayes et les rats varient de 20 000 à 40 000 ppm après plusieurs heures d’exposition. Des concentrations inférieures à 6 000 ppm peuvent généralement être tolérées sans symptômes d’intoxication.
L’administration orale répétée d’éthanol à des rats juvéniles à une dose de 10 g/kg/jour pendant 12 semaines a entraîné une faible prise de poids et une dégénérescence graisseuse du foie. Chez les singes nourris avec un régime contenant 40 % des calories totales sous forme d’éthanol, des perturbations du métabolisme des triglycérides, du cholestérol et des phospholipides ont été observées, ainsi qu’une dégénérescence graisseuse du foie et du myocarde.
L’administration d’éthanol à des rates gravides à des niveaux de 5 ml/kg a augmenté la mortalité embryonnaire et retardé le développement du fœtus. Cependant, aucune malformation majeure n’a été induite chez le fœtus.
Des doses d’éthanol de 1 à 1,5 g/kg ont provoqué des mutations létales dominantes chez les souris mâles, mais pas chez les souris femelles. Dans le test d’Ames, l’éthanol n’a pas montré d’activité mutagène. Cependant, une augmentation de la rupture des chromatides a été observée dans les cultures de fibroblastes humains, ce qui est probablement un effet cytotoxique plutôt qu’un signe de mutagénicité.
L’éthanol est principalement métabolisé dans le foie par trois systèmes enzymatiques :
- Déshydrogénase d’alcool
- Catalase agissant comme une peroxydase et couplée à un système fournissant de l’eau oxygénée
- Système microsomal d’oxydation de l’éthanol nécessitant le NADPH comme coenzyme
Environ 80 % de l’éthanol absorbé est initialement métabolisé en acétaldéhyde, suivi d’une oxydation supplémentaire en acide acétique. L’acide acétique est ensuite dégradé en dioxyde de carbone et en eau. L’oxydation de l’acétaldéhyde en acide acétique est généralement plus rapide que l’oxydation de l’éthanol en acétaldéhyde.
L’ingestion d’éthanol chez l’homme peut produire divers symptômes en fonction de la concentration, comme indiqué dans le Tableau 2. Cependant, les réponses individuelles à l’éthanol peuvent varier considérablement.
| Symptôme | Concentration d'éthanol dans le sang, % |
|---|---|
| Début d'incertitude | 0,06 - 0,08 |
| Compréhension lente | 0,10 |
| Stupeur | 0,11 - 0,15 |
| Ébriété | 0,16 |
| Grave Intoxication | 0,2 - 0,4 |
| Décès | 0,4 - 0,5 |
Chez les personnes souffrant d’alcoolisme, la dégénérescence du foie gras est souvent attribuée à une synthèse accrue des acides gras à partir de l’acétate, à un transport accru des lipides des dépôts graisseux périphériques vers le foie et à une diminution de l’oxydation des acides gras.
Une infiltration graisseuse du myocarde et une leptoméningite chronique sont également signalées dans l’alcoolisme chronique et sont associées à des symptômes spécifiques.
Les limites d’exposition à l’éthanol de l’ACGIH, de l’OSHA et du MAK sont toutes fixées à 1 000 ppm (1 900 mg/m³).
Références
- Ethanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a09_587.pub2
- Ethanol; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0520080112150719.a01.pub2




