Qu’est-ce que la coumarine ?
La coumarine, également connue sous le nom de 2H-1-benzopyran-2-one ou 1,2-benzopyrone, est une lactone aromatique naturelle dont la formule chimique est C9H6O2. C’est un solide cristallin incolore à l’odeur douce-amère comme le foin et qui est utilisé comme fixateur dans les parfums.
Vogel a isolé pour la première fois la coumarine à partir de fèves tonka (Dipteryx odorata) en 1820, et en 1868, William Perkin l’a synthétisée via la réaction de Perkin.
La coumarine est largement répandue dans le règne végétal ; on la trouve dans le mélilot, l’aspérule odorante, la casse, le mélilot, la lavande, le baume du Pérou et d’autres plantes à une concentration allant de 87 000 ppm à 5 ppb.
Dans le passé, la coumarine était utilisée comme arôme alimentaire, notamment en association avec la vanilline. Cependant, son utilisation dans l’industrie alimentaire a été interdite aux États-Unis en 1954.
Table des matières
1. Propriétés physiques de la coumarine
La coumarine se présente sous forme de feuillets incolores et brillants ou de cristaux rhombiques à température ambiante avec une odeur agréable et sucrée de vanille et un goût amer et aromatique de brûlure. Elle est très soluble dans le chloroforme et la pyridine, soluble dans l’éthanol et l’éther et légèrement soluble dans l’eau.
Les propriétés physiques de la coumarine sont répertoriées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro CAS | [91-64-5] |
| Formule chimique | C9H6O2 |
| Poids moléculaire | 146,14 g/mol |
| Point de fusion | 68-70 °C |
| Point d'ébullition | 301 °C à 100 kPa 170,4 °C à 2,7 kPa 138,5 °C à 0,7 kPa |
| Densité | 0,94 g/cm3 à 25 °C 1,178 g/cm3 à 100 °C |
| Pression de vapeur | 0,13 kPa à 106 °C |
| Point d'éclair | 150 °C |
| Solubilité dans l'eau | 0,25 g/100 g d'eau à 25 °C 2 g/100 g d'eau à 100 °C |
2. Réactions chimiques de la coumarine
La coumarine subit des réactions typiques de la lactone d’un acide aromatique α,β-insaturé.
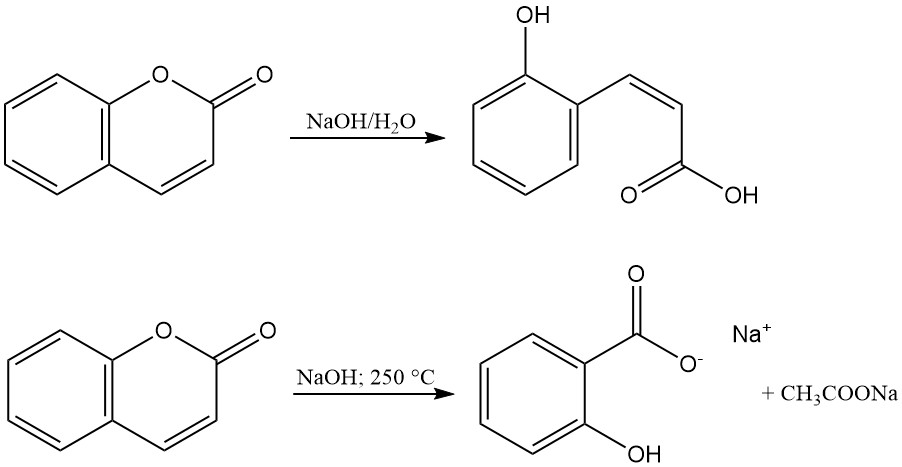
Le cycle lactone de la coumarine est hydrolysé avec des alcalis pour produire des sels d’acide coumarinique ou d’acide o-hydroxy-cis-cinnamique. Ces sels sont inodores et se transforment en coumarine par acidification. La réaction de la coumarine avec l’hydroxyde de sodium fondu forme du salicylate de sodium et de l’acétate de sodium.
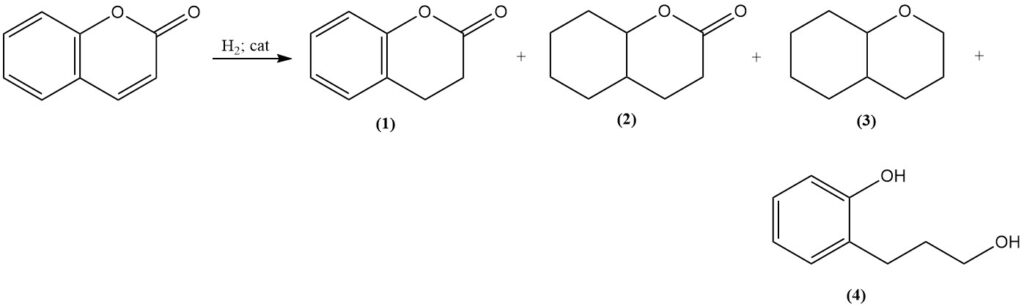
L’hydrogénation catalytique de la coumarine produit divers produits en fonction des conditions de réaction. Des conditions modérées utilisant un catalyseur au nickel de Raney forment la 3,4-dihydrocoumarine (1) ; cependant, une température et une pression accrues conduisent à la formation d’octahydrocoumarine (2), d’hexahydrochromane (3) et de produits de polymérisation.
L’hydrogénation sélective de la 3,4-dihydrocoumarine (1) peut être réalisée avec un catalyseur au sulfure de platine, et l’hydrogénation à des températures élevées en utilisant un catalyseur au chromite de cuivre donne le 3-(o-hydroxyphényl)-1-propanol (4) avec un très bon rendement.
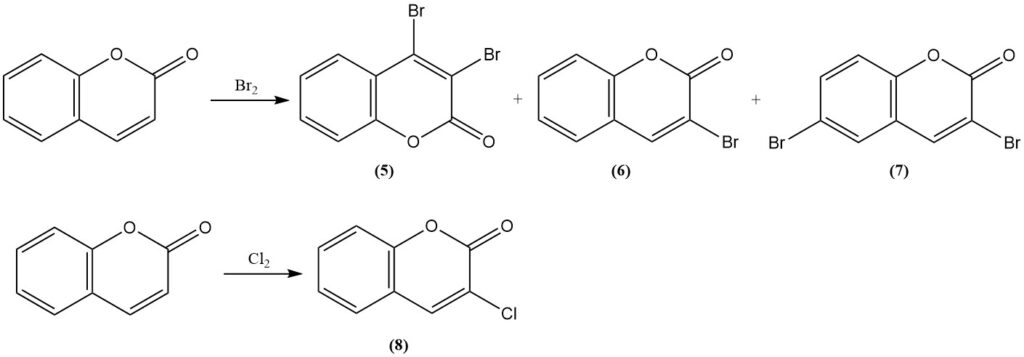
La réaction de la coumarine avec le brome produit la 3,4-dibromocoumarine (5) dans des conditions douces. Des conditions plus rigoureuses produisent la 3-bromocoumarine (6) et la 3,6-dibromocoumarine (7). La réaction avec le chlore produit la 3-chlorocoumarine (8).
La réduction de la coumarine avec l’hydrure de lithium et d’aluminium produit de l’alcool o-hydroxycinnamylique.
L’O-allylphénol est préparé par réaction de la coumarine avec du diborane.
La coumarine forme des hydrosulfonates de sodium solubles avec le bisulfite de sodium, qui peuvent régénérer la coumarine lorsqu’elle est acidifiée. Cette technique est utilisée pour purifier la coumarine brute.
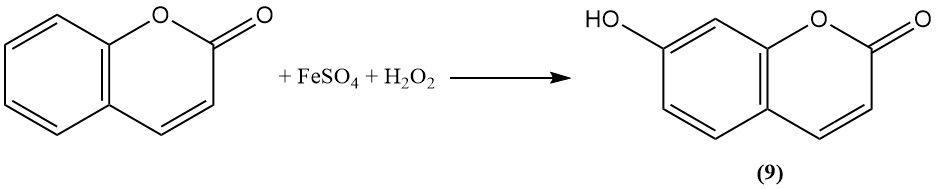
L’oxydation avec le réactif de Fenton convertit la coumarine en ombelliférone (7-hydroxycoumarine) (9).
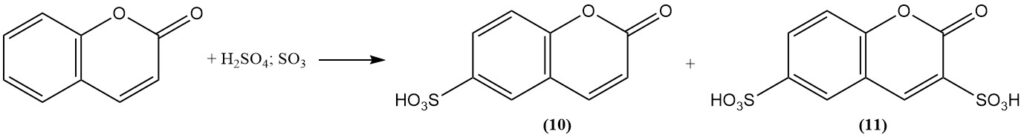
La sulfonation de la coumarine à l’aide d’acide sulfurique fumant forme de l’acide coumarine-6-sulfonique (10) à température modérée et de l’acide coumarine-3,6-disulfonique (11) à température plus élevée.
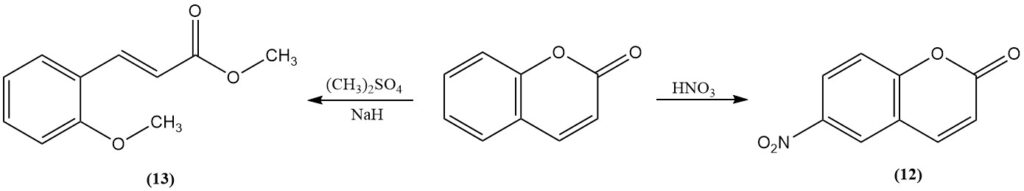
La nitration avec de l’acide nitrique fumant donne la 6-nitrocoumarine (12). La méthylation de la coumarine avec du sulfate de méthyle ou de l’iodure de méthyle en présence d’hydrure de sodium produit le 2-méthoxycinnamate de méthyle (13). Le trifluorure de bore catalyse la photodimérisation de la coumarine.
La coumarine peut subir d’autres substitutions électrophiles aromatiques telles que l’halogénation, l’alkylation et l’acylation.
3. Production de coumarine
Jusqu’à la fin des années 1980, la coumarine était exclusivement dérivée de sources naturelles par extraction à partir de fèves tonka et de langue de cerf. Aujourd’hui, elle est produite chimiquement en utilisant l’o-crésol, le phénol et le salicylaldéhyde comme matières premières. Il existe une diversité de voies de synthèse pour la synthèse de la coumarine à partir de chacune de ces matières premières.
3.1. Production de coumarine à partir d’o-crésol
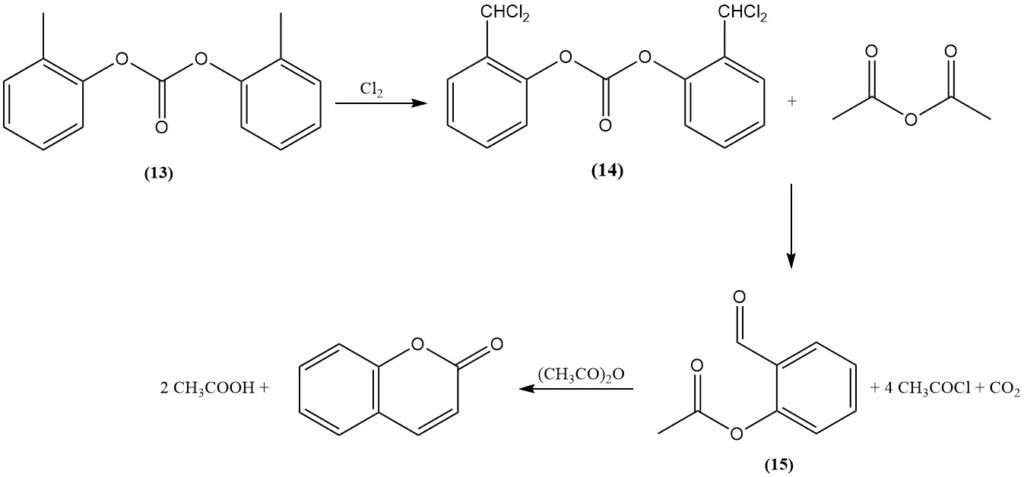
Le procédé Raschig, découvert en 1909, est une voie de synthèse principale pour la coumarine à partir d’o-crésol. Dans un premier etape, le groupe hydroxyle phénolique de l’o-crésol est protégé par estérification avec du phosphate ou, de préférence, du carbonate (13). Ensuite, le groupe méthyle est transformé en un intermédiaire chlorure de benzal (14) par dichloration.
L’ester α,α-dichlorocrésyle obtenu est ensuite mis à réagir soit avec un acétate alcalin dans un hydroxyde fondu, soit avec de l’anhydride acétique catalysé par un oxyde métallique, tel que l’oxyde de cobalt, pour former de l’o-acétylsalicylaldéhyde (15), du chlorure d’acétyle et du dioxyde de carbone.
Enfin, la cyclisation de l’o-acétylsalicylaldéhyde à l’aide d’anhydride acétique génère de la coumarine et de l’acide acétique.
3.2. Production de coumarine à partir de phénol
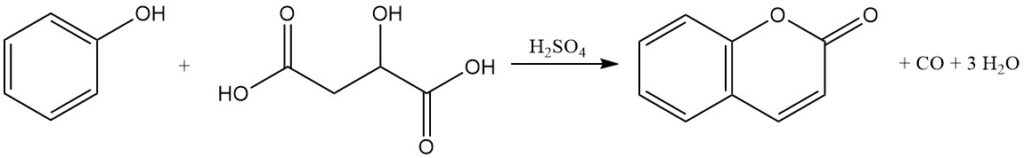
La condensation de Pechmann, découverte en 1883, représente une méthode primaire de production de coumarine à partir de phénol. Dans ce procédé, la coumarine est produite par la réaction du phénol avec les acides malique, maléique ou fumarique en présence d’acide sulfurique concentré.
La réaction de Pechmann est largement utilisée dans la synthèse de nombreux dérivés de la coumarine. Par exemple, la condensation du phénol avec l’acétoacétate d’éthyle produit de la 4-méthylcoumarine. De plus, le phénol peut réagir avec le dicétène pour former de la coumarine.
Le phénol réagit avec des dérivés spécifiques de l’acide acrylique pour produire de la coumarine.
La coumarine est également produite par la réaction du phénol avec le chlorure d’acide 3-éthoxyacrylique pour produire de l’éthoxyacrylate de phényle, suivie d’une réaction de cyclisation utilisant de l’acide sulfurique. De plus, la coumarine est synthétisée par la réaction du phénol avec l’acrylate de méthyle dans un milieu acide en présence d’air.
3.3. Production de coumarine à partir de salicylaldéhyde
Réaction de Perkin
La réaction de Perkin, découverte initialement par Perkin en 1868, représente une méthode classique de synthèse de la coumarine à partir de salicylaldéhyde. Ce processus implique la réaction du salicylaldéhyde avec l’anhydride acétique en présence d’acétate de sodium comme catalyseur. La réaction se déroule par la formation d’acide cis-o-acétoxycinnamique (16) comme intermédiaire.
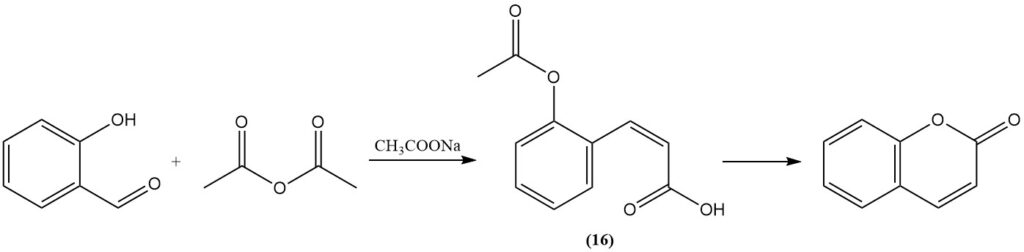
La réaction de Perkin est importante sur le plan industriel, c’est pourquoi elle a été largement étudiée et modifiée pour améliorer son efficacité. Ces modifications comprennent l’ajout d’iode, d’oxydes métalliques ou de sels, l’ajout de pyridine ou de pipéridine comme catalyseurs, le remplacement de l’acétate de sodium par du carbonate de potassium ou par de l’acétate de césium et l’utilisation de biacétate de métal alcalin.
Réaction de Knoevenagel
La condensation de Knoevenagel est une réaction de synthèse de coumarines 3-substituées à partir de salicylaldéhyde. Elle implique la condensation de salicylaldéhyde avec des composés méthylène actifs, tels que l’acide acétoacétique, l’acide malonique ou l’acide cyanoacétique, en présence d’un catalyseur de base organique tel que l’ammoniac, la pyridine et les amines primaires et secondaires.
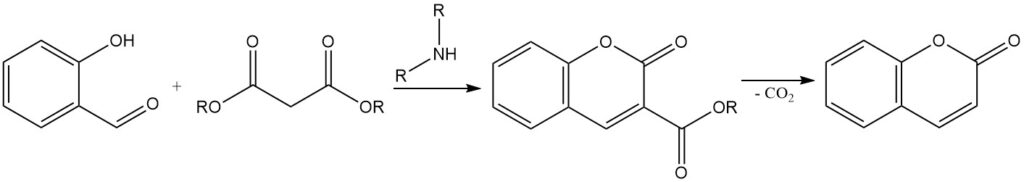
La coumarine substituée en 3 résultante peut être convertie en coumarine par l’élimination du groupe substituant. Par exemple, l’acide 3-carboxylique de la coumarine, obtenu à partir de la condensation du salicylaldéhyde avec l’acide malonique, peut être décarboxylé en chauffant jusqu’à 290 °C pour former de la coumarine.
Une réaction de décarboxylation douce avec un meilleur rendement peut être obtenue en utilisant des sels mercuriques.
3.4. Autres méthodes
Les voies de synthèse alternatives à la coumarine comprennent la cyclodéshydrogénation du propionate d’oxocyclohexane et la déshydrogénation à l’aide de soufre élémentaire ou de catalyse en phase vapeur avec des oxydes métalliques de 3,4-dihydrocoumarine, qui est obtenue à partir de l’oxydation de Baeyer-Villiger de la 1-indanone.
3.5. Purification de la coumarine
La coumarine synthétique doit avoir une grande pureté pour être utilisée pour le parfum. Les méthodes de purification conventionnelles comprennent la distillation fractionnée sous pression réduite et la cristallisation à partir de solvants comme le méthanol ou l’éthanol.
Des traitements supplémentaires avant le processus de distillation comprennent les étapes suivantes : chauffage de la coumarine brute avec de l’acide sulfurique concentré, neutralisation et lavage à l’eau ; dissolution du produit lavé dans de l’acide sulfurique concentré suivie d’une oxydation ; et reflux avec de l’hydroxyde de sodium aqueux suivi d’une séparation de phase organique et d’un lavage.
La distillation azéotropique sous vide avec des alcools polyhydroxy, tels que le triéthylène glycol, est une méthode de purification alternative. Des techniques de fusion de zone ont également été rapportées pour la purification de la coumarine.
4. Utilisations de la coumarine
En raison de son arôme sucré distinctif et de sa stabilité, la coumarine est utilisée comme ingrédient de parfum dans les parfums, les savons, les détergents et les lotions à des concentrations allant de 0,01 à 2,4 %.
Fréquentement associée à des parfums herbacés, la coumarine fait partie intégrante de la composition des parfums de type fougère et chypré. Elle est utilisée comme fixateur pour améliorer la longévité des huiles essentielles naturelles, telles que la lavande, les agrumes, le romarin et la mousse de chêne.
Au-delà de la parfumerie, la coumarine confère des arômes agréables aux produits ménagers et industriels tout en masquant les odeurs désagréables.
Elle est également utilisée comme support dans les colorants laser et comme sensibilisateur dans les anciennes technologies photovoltaïques.
La coumarine et ses dérivés ont été étudiés pour des utilisations thérapeutiques potentielles, notamment le traitement de la schizophrénie, des troubles de la microcirculation, des ulcères angiopathiques, des œdèmes à haute teneur en protéines et du cancer.
Elle est utilisée comme médicament pour le traitement du lymphœdème à haute teneur en protéines et pour améliorer la circulation veineuse, et a été testée dans des essais cliniques en tant qu’antinéoplasique.
Il a été démontré que la coumarine est active dans la propigmentation et le ralentissement de la chute des cheveux. Un dérivé de la coumarine a été utilisé dans la polarisation de cristaux électroluminescents.
Aujourd’hui, la coumarine est interdite comme additif alimentaire direct ; cependant, elle est utilisée comme arôme de tabac, et elle est également utilisée dans l’industrie de la galvanoplastie.
Il est important de mentionner que si les composés dérivés de la coumarine comme la warfarine sont de puissants anticoagulants, la coumarine elle-même n’est pas un anticoagulant.
5. Toxicologie de la coumarine
La coumarine présente des risques importants pour la santé. L’ingestion, l’inhalation et le contact avec les yeux sont dangereux, tandis que le contact avec la peau est moins grave. Une surexposition aiguë peut être mortelle. La coumarine présente une toxicité modérée pour le foie et les reins, avec une dose létale médiane de 275 mg/kg. L’hépatotoxicité est plus prononcée chez les rats que chez les souris.
Les données toxicologiques (DL50) pour la coumarine sont les suivantes :
- 293 mg/kg (rat)
- 196 mg/kg (souris)
- 202 mg/kg (cobaye)
L’écorce de cassia, une variété de cannelle, contient des niveaux élevés de coumarine. La consommation de quantités excessives d’écorce de cassia peut être nocive en raison de sa teneur élevée en coumarine.
La Food and Drug Administration américaine a interdit l’ajout direct de coumarine aux produits alimentaires. Néanmoins, les additifs naturels contenant de la coumarine, comme l’aspérule odorante, sont autorisés dans les boissons alcoolisées en vertu de réglementations spécifiques.
5.1. Voies d’exposition
L’exposition humaine à la coumarine se produit principalement par contact cutané avec des parfums et des produits contenant du parfum de coumarine. La peau absorbe facilement la coumarine, ce qui en fait une voie d’administration importante pour des applications thérapeutiques telles que le traitement du lymphœdème.
De plus, l’exposition humaine peut se produire par ingestion orale via des aliments naturels, des produits pharmaceutiques et des produits du tabac. L’absorption gastro-intestinale de la coumarine est rapide.
5.2. Toxicocinétique
De nombreuses recherches ont décrit l’absorption, le métabolisme et l’excrétion de la coumarine. La voie d’exposition influence considérablement les taux sanguins et la toxicité.
Des doses orales en bolus entraînent des concentrations plasmatiques nettement supérieures à celles observées à partir de l’apport alimentaire, malgré des niveaux équivalents en milligrammes par kilogramme de poids corporel.
L’exposition cutanée contourne le métabolisme hépatique initial (effet de premier passage). La coumarine dans le sang passe d’abord par les poumons, où une partie importante peut être expirée avant le métabolisme hépatique.
Les humains métabolisent principalement la coumarine en 7-hydroxycoumarine non toxique. La formation hépatique d’acide o-hydroxyacétique est minimale et rapidement détoxifiée. L’absence de cellules de Clara abondantes dans les poumons humains empêche la production d’époxyde pulmonaire et d’acide o-hydroxyacétique, même à des doses élevées de coumarine.
Des études utilisant des microsomes hépatiques humains établissent une corrélation entre une faible capacité de 7-hydroxylation et une formation réduite d’époxyde.
5.3. Toxicité aiguë et à court terme
- Études animales
Les valeurs DL50 rapportées pour la coumarine varient de 160 à 780 mg/kg de poids corporel, avec des variations attribuées à l’espèce animale, à la souche et à l’état de jeûne. Une légère irritation des yeux et de la peau a été observée après exposition.
L’exposition alimentaire à la coumarine à des niveaux ≥ 2500 ppm pendant au moins quatre semaines peut entraîner une diminution de la consommation alimentaire, une réduction du poids corporel et des modifications microscopiques du foie. Des concentrations alimentaires plus élevées (1 à 2 %) entraînent un refus alimentaire et la mortalité.
La reproduction peut être affectée négativement à des doses élevées qui ont un impact significatif sur la consommation alimentaire, mais aucun effet sur la reproduction ou le développement n’a été signalé à des doses plus faibles.
- Études sur l’homme
L’exposition humaine à la coumarine se produit par la consommation de cannelle, de thé vert, de miel de mélilot et d’autres aliments. Des cas de saignements associés à des tisanes contenant des fèves tonka, du mélilot et de l’aspérule odorante ont été signalés.
Les dosages pharmaceutiques de coumarine varient de 70 à 7000 mg/jour, 200 mg une ou deux fois par jour étant le schéma le plus courant.
Une hépatotoxicité a été rarement signalée après l’utilisation de coumarine pharmaceutique. Les modifications des enzymes hépatiques associées sont souvent réversibles à l’arrêt du traitement et parfois même pendant la poursuite du traitement.
Les taux d’incidence signalés varient de <0,1 à 6 %, influencés par la population étudiée et la posologie. Bien que certains décès aient été liés à l’utilisation de coumarine, des facteurs de confusion tels que des conditions médicales préexistantes compliquent l’interprétation causale.
Les études examinant le polymorphisme du CYP2A6 chez l’homme n’ont pas établi de lien avec un dysfonctionnement hépatique associé à la coumarine.
La coumarine a été soumise à des tests de sensibilisation dans divers modèles, notamment l’application cutanée sur le cobaye, le test de gonflement des oreilles de souris et le test des ganglions lymphatiques locaux (LLNA). La coumarine pure a systématiquement donné des résultats négatifs, même à des concentrations allant jusqu’à 50 % dans les études LLNA récentes.
Cependant, une impureté chlorée (6-chlorocoumarine) et une coumarine moins pure dérivée de l’o-crésol ont démontré des propriétés sensibilisantes, ce qui correspond aux cas de sensibilisation signalés impliquant des dérivés de la coumarine.
Les populations humaines, contrairement aux animaux de laboratoire, peuvent avoir une exposition préexistante à la coumarine ou à des substances à réactivité croisée, ce qui complique l’évaluation de la sensibilisation humaine.
L’activité anticoagulante de la coumarine est significativement inférieure à celle de la warfarine. Les rapports de cas suggèrent que la coumarine peut potentialiser les effets des antagonistes de la vitamine K, bien que le mécanisme sous-jacent reste flou. La coumarine n’a pas été associée à une tératogénicité ou à des effets indésirables sur la reproduction chez l’homme.
5.4. Toxicité chronique
- Études sur les animaux
Des études approfondies sur la toxicité à long terme et la cancérogénicité de la coumarine ont été menées. Les principaux effets indésirables observés chez les animaux sont une diminution de la consommation alimentaire entraînant une réduction du poids corporel et une toxicité hépatique, en particulier chez les rats.
Des tumeurs hépatiques, bien que non métastatiques et non mortelles, ont été signalées chez des rats exposés à des doses élevées (≥ 150 mg/kg de poids corporel) qui ont considérablement réduit la prise de poids corporel. Des tumeurs pulmonaires ont été identifiées chez des souris exposées à des doses élevées en bolus (≥ 150 mg/kg de poids corporel), mais pas chez celles exposées par l’alimentation.
- Études sur les humains
L’exposition professionnelle à la poussière de coumarine peut provoquer une irritation respiratoire. De plus, la coumarine peut agir comme un faible sensibilisant cutané chez les individus sensibles, le degré de sensibilisation étant influencé par la pureté de la substance. Aucun autre effet indésirable à long terme n’a été documenté chez l’homme.
Le Centre international de recherche sur le cancer (CIRC) a classé la coumarine dans le groupe 3, ce qui indique qu’elle ne peut pas être classée comme cancérogène pour l’homme.
Toxicité in vitro
La coumarine n’est pas mutagène et ne se lie pas à l’ADN. Elle ne présente aucune propriété clastogène, ce qui indique un impact négligeable sur les chromosomes.
Toxicité pour la reproduction
Contrairement à la warfarine, la coumarine n’est pas tératogène.
Génotoxicité
De nombreuses études ont montré de manière constante que la coumarine n’est pas génotoxique. Elle a montré des propriétés protectrices contre les mutations induites par la doxorubicine.
Cancérogénicité
Il n’existe aucune preuve concluante permettant de classer la coumarine comme cancérogène. En fait, certaines recherches suggèrent des effets antioxydants et antinéoplasiques potentiels.
Gestion clinique du surdosage
En raison de la toxicité relativement faible de la coumarine, les protocoles spécifiques de gestion du surdosage sont limités. Des mesures générales, telles que la décontamination gastrique en cas d’ingestion orale importante, peuvent être envisagées. Une surveillance du rapport normalisé international et des tests de la fonction hépatique est recommandée.
Écotoxicité
La coumarine présente une faible toxicité environnementale. Des études de toxicité aquatique ont montré des valeurs de CL50 de 56 mg/L pour les poissons et des valeurs de CE50 de 55 mg/L pour Daphnia magna. La respiration des algues est inhibée à des concentrations en laboratoire de 50 mmol/L.
Étant donné sa persistance relativement faible, la coumarine devrait se dégrader facilement dans l’environnement.
Références
- Coumarin; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0315211302150919.a01.pub2
- Coumarins. – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543007983
- https://www.sciencedirect.com/science/article/abs/pii/B0123694000002696
- https://onlinelibrary.wiley.com/doi/10.1002/mnfr.200900281
- https://www.sciencedirect.com/science/article/abs/pii/B9780124095472126204
- https://pubchem.ncbi.nlm.nih.gov/compound/Coumarin