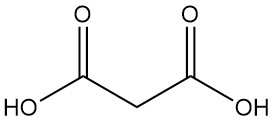
Qu’est-ce que l’acide malonique ?
L’acide malonique, également connu comme acide propanedioïque ou acide méthanedicarboxylique, est un acide dicarboxylique de formule chimique C3H4O4. C’est un solide incolore et hygroscopique qui se sublime sous vide. La forme ionisée de l’acide malonique, ainsi que ses esters et ses sels, sont connus sous le nom de malonates.
Table des matières
1. Propriétés physiques de l’acide malonique
L’acide malonique est un solide blanc hygroscopique très soluble dans l’eau (139 g dans 100 g d’eau à 22 °C) et soluble dans la pyridine (15 g dans 100 g de pyridine à 15 °C). Il est légèrement soluble dans l’éthanol et l’éther diéthylique et insoluble dans le benzène.
Les propriétés physiques de l’acide malonique sont répertoriées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro d'enregistrement CAS | [141-82-2] |
| Formule moléculaire | C3H4O4 |
| Poids moléculaire | 104,06 g/mol |
| Point de fusion | 134 – 138 °C |
| Point d'ébullition | Se décompose à 140 °C |
| Densité | 1,62 g/cm³ |
| pKa1 | 2,83 |
| pKa2 | 5,70 |
| Point d'éclair | 157 °C |
2. Réactions de l’acide malonique
L’acide malonique est présent en petites quantités dans la betterave sucrière et le blé vert et est formé par la dégradation oxydative de l’acide malique.
L’acide malonique présente des réactions typiques des acides carboxyliques et une réactivité élevée du groupe méthylène central en raison de l’acidité des atomes d’hydrogène en position 2.
L’acide malonique réagit comme la plupart des acides carboxyliques pour produire des amides, des esters, des anhydrides et des chlorures d’acide.
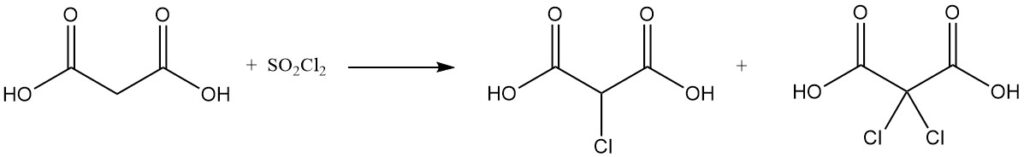
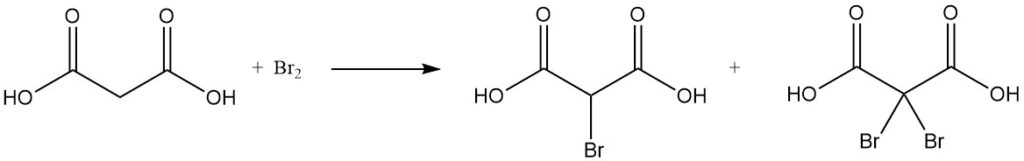
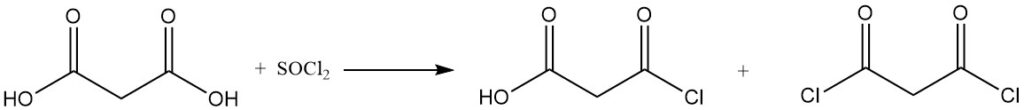
La réaction de l’acide malonique avec le chlorure de sulfuryle ou le brome donne des dérivés mono- ou dihalogénés, tandis que le chlorure de thionyle ou le pentachlorure de phosphore forme des chlorures mono- ou diacyle.
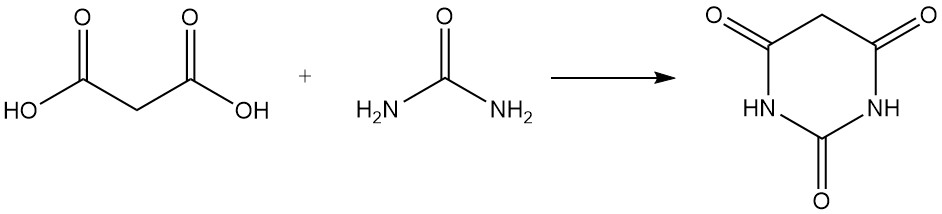
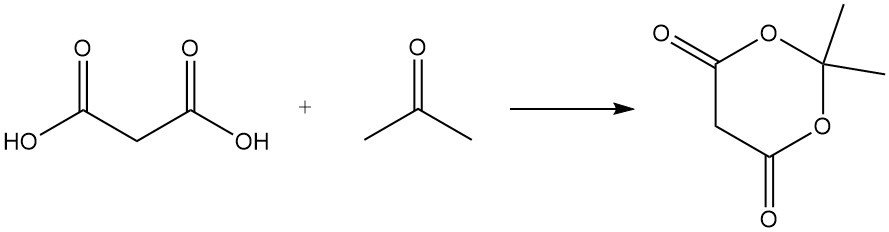
L’acide malonique réagit avec l’urée pour produire de l’acide barbiturique, un précurseur de divers médicaments, et avec l’acétone pour former l’acide de Meldrum, un intermédiaire important dans la synthèse organique.
Contrairement aux acides carboxyliques typiques, chauffer l’acide malonique avec du pentoxyde de phosphore ne produit pas d’anhydride mais plutôt du sous-oxyde de carbone, un gaz toxique qui reforme facilement l’acide malonique au contact de l’eau.
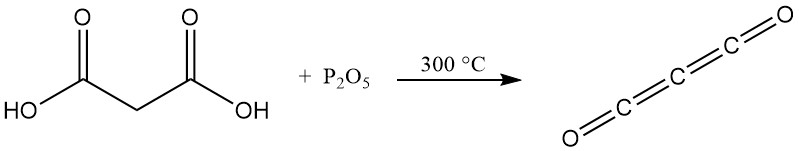
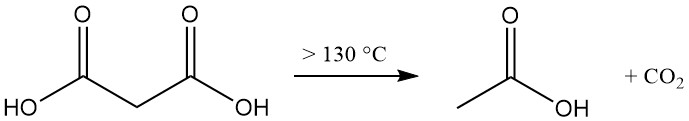
La décomposition thermique de l’acide malonique au-dessus de 130 °C (acide libre) ou 70 °C (solution aqueuse) produit de l’acide acétique et du dioxyde de carbone.
Les mono- et dianions de l’acide malonique sont plus stables que l’acide libre. Dans les solutions aqueuses, le malonate monosodique se décompose au-dessus de 90 °C, tandis que le malonate disodique se décompose au-dessus de 130 °C.
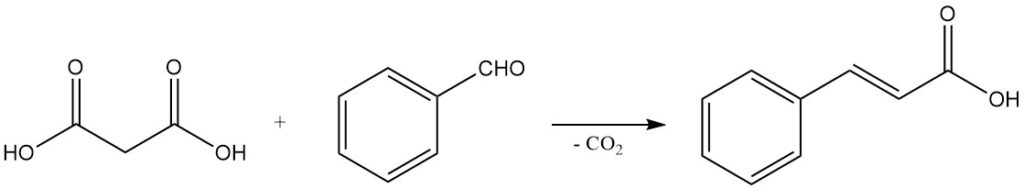
Le comportement de décarboxylation doux, associé à la capacité de subir des condensations de Knoevenagel, fait de l’acide malonique un réactif important pour la synthèse des acides carboxyliques α,β-insaturés. Par exemple, la réaction avec le benzaldéhyde produit de l’acide cinnamique et les réactions avec les aldéhydes aliphatiques produisent des acides acryliques.
Les recherches ont également exploré les complexes de platine de l’acide malonique et de ses dérivés comme agents antitumoraux potentiels.
3. Production industrielle d’acide malonique
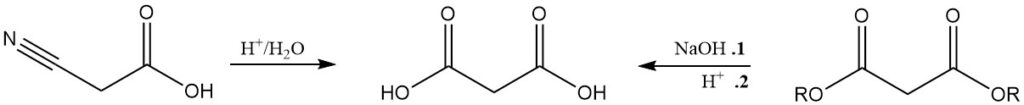
Bien que moins important que la production de malonate, l’acide malonique est généralement produit par l’hydrolyse de l’acide cyanoacétique ou par la saponification acide des malonates.
Des méthodes émergentes ont également été rapportées pour la production d’acide malonique, notamment l’ozonolyse du cyclopentadiène, l’oxydation à l’air catalysée par le palladium du 1,3-propanediol, l’oxydation catalysée par le métal du 3-hydroxypropionaldéhyde ou de l’acide 3-hydroxypropionique et la conversion biocatalytique du malononitrile à l’aide d’une enzyme nitrilase.
La première synthèse en laboratoire de l’acide malonique, réalisée en 1858, impliquait la décomposition oxydative de l’acide malique à l’aide de dichromate de potassium. Cette méthode n’est plus couramment utilisée aujourd’hui.
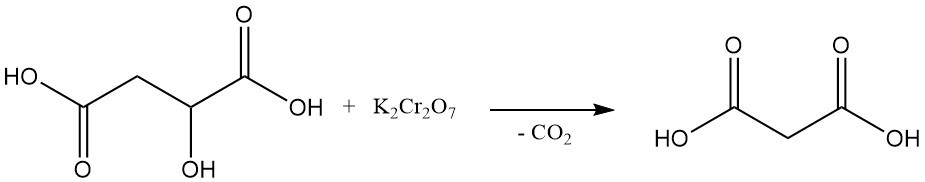
4. Utilisations de l’acide malonique
L’acide malonique est utilisé comme élément constitutif de divers composés organiques en raison de sa capacité à introduire une fraction d’acide acétique dans des conditions douces via la condensation de Knoevenagel suivie d’une décarboxylation. Voici quelques exemples de composés synthétisés à partir de l’acide malonique :
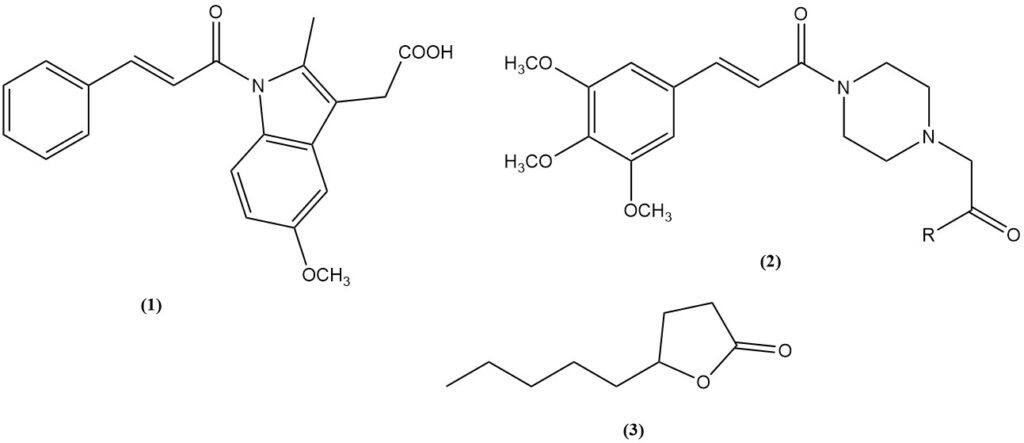
- L’acide cinnamique est un précurseur du médicament anti-inflammatoire cinmétacine (1).
- Acide 3,4,5-triméthoxycinnamique : intermédiaire pour les vasodilatateurs cinepazet (2, R = OEt) et cinepazide (2, R = 1-pyrrolidinyl).
- Lactone γ-nonanoïque (3) : composé parfumé obtenu par condensation de Knoevenagel de l’acide malonique avec l’heptaldéhyde suivie d’une cyclisation.
L’acide malonique est également utilisé dans la production de plastiques techniques aux propriétés souhaitées, de contenants biodégradables, de barbituriques et de revêtements.
5. Toxicologie de l’acide malonique
L’acide malonique est considéré comme ayant une toxicité modérée, affectant principalement les yeux et la peau. Voici les données toxicologiques disponibles :
Toxicité orale aiguë : DL50 (orale, rat) : 2 750 mg/kg
L’acide malonique peut irriter la peau (légère irritation cutanée chez le lapin) et provoquer de graves lésions oculaires en cas de contact. Les fiches de données de sécurité (FDS) recommandent de porter un équipement de protection individuelle (EPI) approprié pour éviter tout contact.
Il n’existe pas de données facilement disponibles sur les effets chroniques sur la santé chez l’homme.
L’inhalation de poussière d’acide malonique peut également être nocive, bien que les données spécifiques puissent être limitées.
Les effets spécifiques de l’exposition à l’acide malonique peuvent varier en fonction de facteurs tels que la quantité, la durée de l’exposition et la voie d’entrée (inhalation, ingestion, contact cutané).
Comme pour tout produit chimique, il est essentiel de manipuler l’acide malonique conformément aux protocoles de sécurité recommandés décrits dans les fiches de données de sécurité (FDS).
Références
- Malonic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a16_063.pub2
- Malonic acid. – https://www.acs.org/molecule-of-the-week/archive/m/malonic-acid.html
- The Knoevenagel Reaction. – https://www.sciencedirect.com/science/article/abs/pii/B9780080523491000330
- https://beta-static.fishersci.com/content/dam/fishersci/en_US/documents/programs/education/regulatory-documents/sds/chemicals/chemicals-m/S25416.pdf

