Qu’est-ce que l’acide cyanurique ?
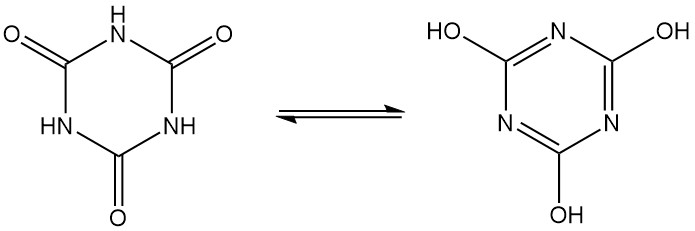
L’acide cyanurique, également connu sous le nom de 1,3,5-triazine-2,4,6(1H,3H,5H)-trione, est un solide cristallin blanc inodore dont la formule moléculaire est C3H3N3O3. Il s’agit d’un trimère cyclique qui s’interconvertit entre plusieurs structures via la tautomérie lactame-lactime.
Bien que l’acide cyanurique soit connu depuis 1776, il n’a acquis une importance industrielle que dans les années 1950.
Table des matières
1. Propriétés physiques de l’acide cyanurique
L’acide cyanurique est un solide cristallin blanc qui forme un dihydrate cristallin incolore à partir de l’eau et perd de l’eau lorsqu’il est exposé à l’air sec. C’est un acide tribasique faible qui est légèrement soluble dans l’eau et les solvants organiques comme l’acétone, le benzène, l’éther, l’éthanol, l’hexane et l’alcool isopropylique.
Le tableau suivant montre la solubilité de l’acide cyanurique dans divers solvants à 25 °C (% en poids).
| Solvant | Solubilité (% en poids) |
|---|---|
| Diméthylsulfoxyde | 17,4 |
| Acide sulfurique (98 % en poids) | 14,1 |
| Diméthylformamide | 7,2 |
| N-méthyl-2-pyrrolidone | 6,3 |
| Diméthylacétamide | 3,0 |
| Pyridine | 2,2 |
Les propriétés physiques importantes de l’acide cyanurique sont répertoriées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro CAS | 108-80-5 |
| Formule | C3H3N3O3 |
| Poids moléculaire | 129,07 g/mol |
| Point de fusion | 320 – 330 °C (décomposition) |
| Densité | 1,80 g/cm³ |
| pKa1 | 6,88 |
| pKa2 | 11,40 |
| pKa3 | 13,5 |
2. Réactions de l’acide cyanurique
L’acide cyanurique réagit avec les bases inorganiques et organiques pour former des sels, qui favorisent l’hydroxytautomère dans les solutions alcalines.
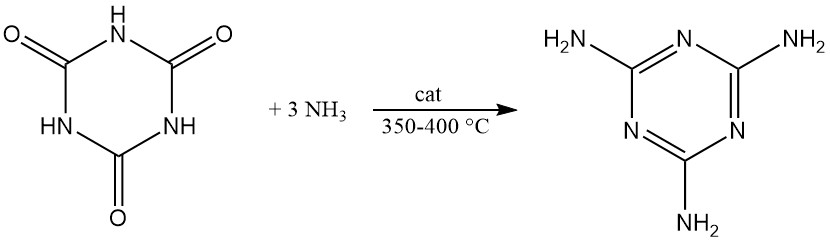
Sous pression et avec un catalyseur à 350–400 °C, l’acide cyanurique réagit avec l’ammoniac pour produire de la mélamine.
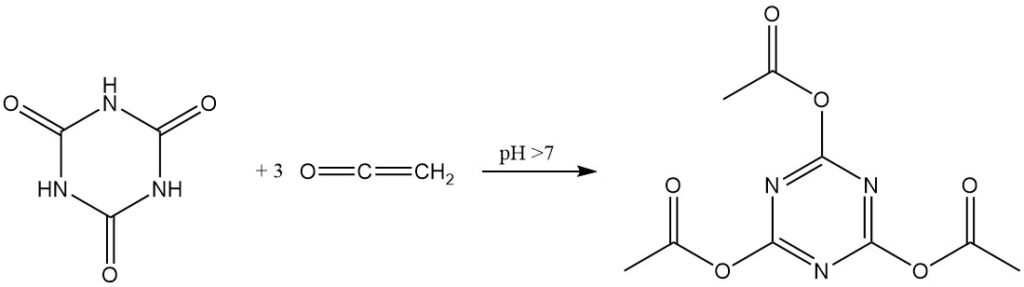
En présence de catalyseurs alcalins, le cétène réagit avec l’acide cyanurique pour former du cyanurate de triacétyle avec un rendement élevé.
L’acide cyanurique réagit principalement comme un imide cyclique. L’atome d’azote isocyanurate nucléophile, souvent sous forme anionique, attaque un atome de carbone polarisé positivement. Cela conduit généralement à des produits trisubstitués.
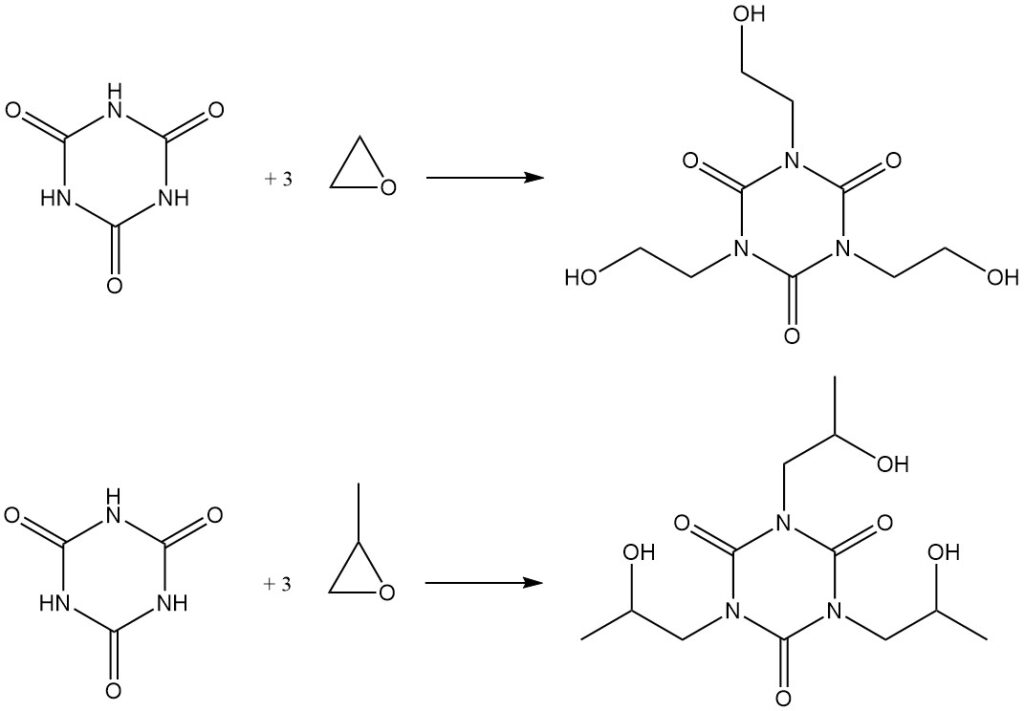
Le chauffage de l’acide cyanurique avec des époxydes dans le DMF entraîne la formation d’isocyanurates hydroxyalkylés. Les exemples incluent la synthèse de l’isocyanurate de tris (2-hydroxyéthyle) à partir d’oxyde d’éthylène et du dérivé hydroxypropyle correspondant à partir d’oxyde de propylène.
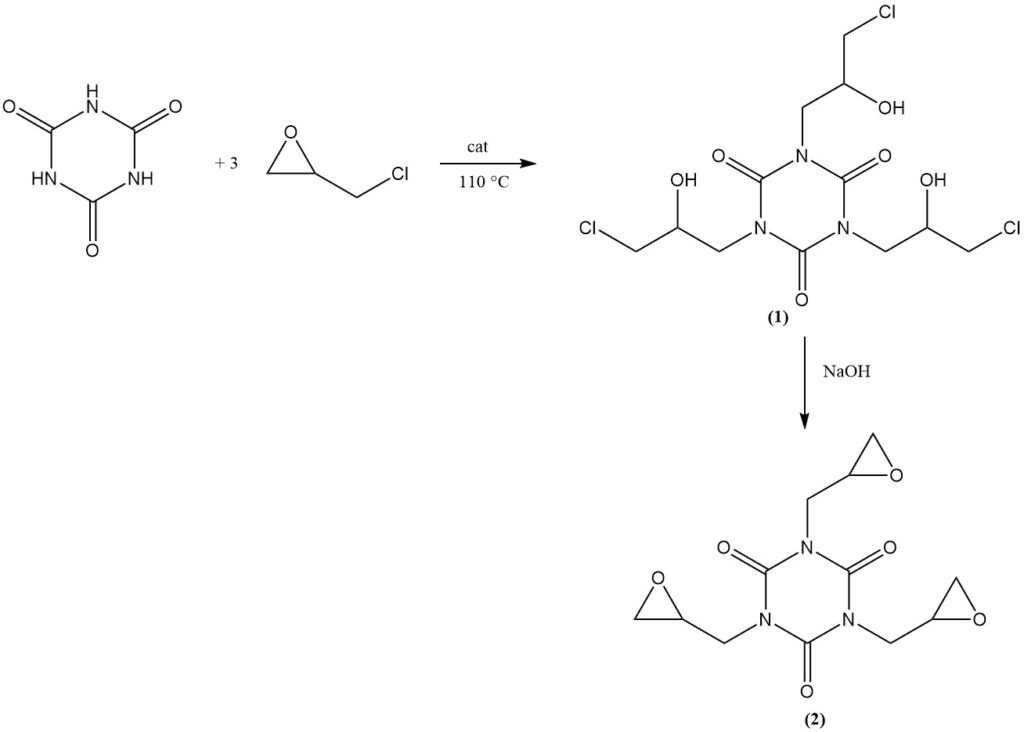
La réaction de l’acide cyanurique avec l’épichlorhydrine en présence d’un catalyseur basique à 110 °C donne l’isocyanurate de tris(3-chloro-2-hydroxypropyle) (1). Une déshydrochloration ultérieure dans une solution alcaline aqueuse donne le produit commercial isocyanurate de tris(2,3-époxypropyle) (2).
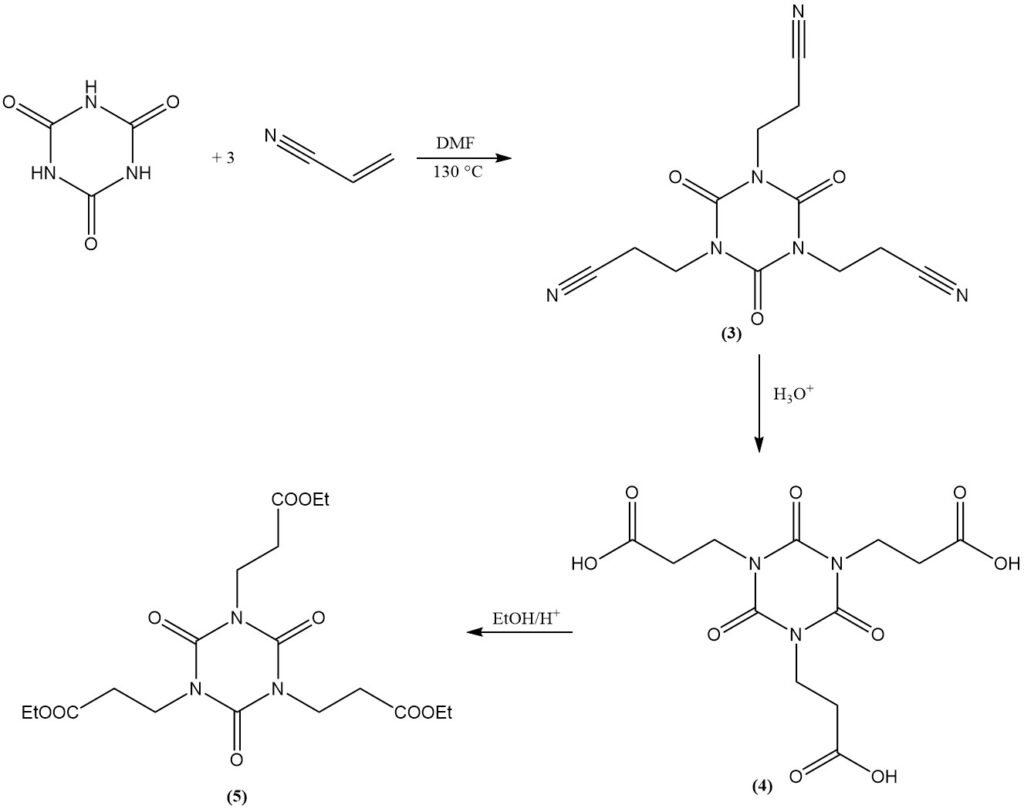
L’acide cyanurique subit des réactions d’addition avec des doubles liaisons. Un exemple est la formation d’isocyanurates de bis(2-cyanoéthyle) et de tris(2-cyanoéthyle) à partir d’acrylonitrile dans du DMF à 130 °C. L’isocyanurate de tris(2-cyanoéthyle) (3) peut être saponifié pour donner l’isocyanurate de tris(2-carboxyéthyle) (4).
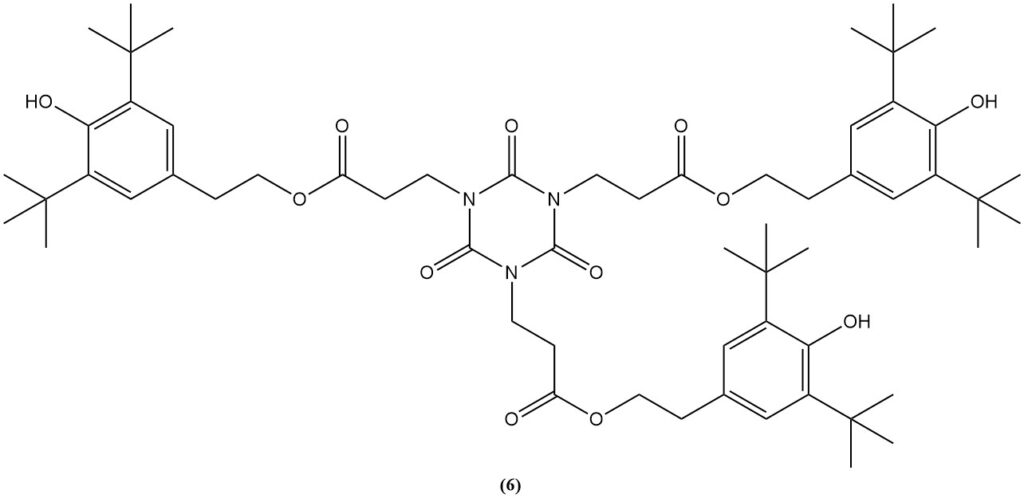
L’estérification du dérivé carboxyéthyle avec de l’éthanol produit de l’isocyanurate de tris(2-carbéthoxyéthyle) (5), un précurseur du stabilisant à la lumière et antioxydant commercial (6).
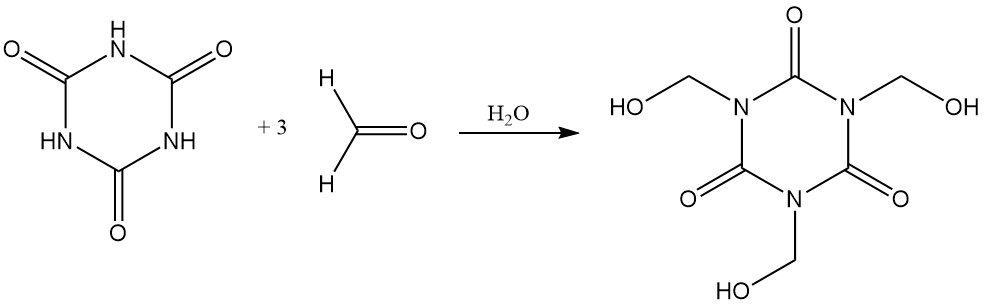
L’acide cyanurique se dissout facilement dans le formaldéhyde aqueux pour former de l’isocyanurate de tris (hydroxyméthyle).
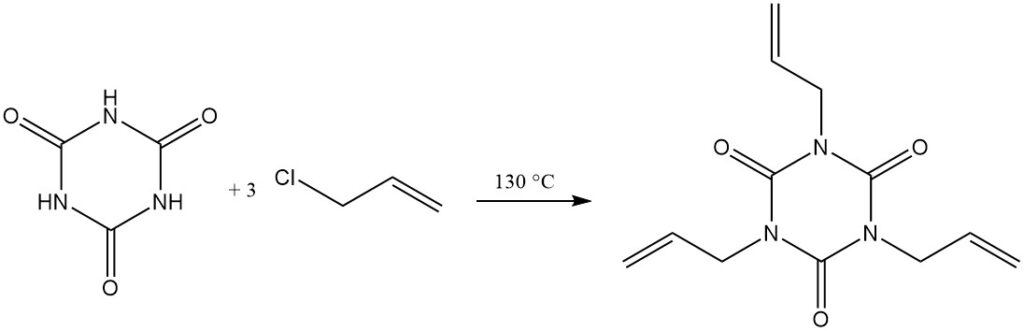
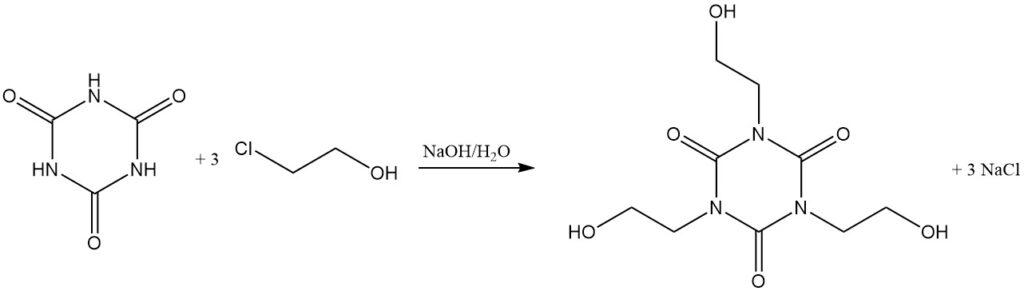
À des températures élevées et avec un accepteur de protons, les halogénures d’alkyle réagissent avec l’acide cyanurique. On peut citer comme exemples la réaction avec le chlorure d’allyle dans le dichlorobenzène/triéthylamine à 130 °C pour former l’isocyanurate de triallyle et avec le 2-chloroéthanol dans l’hydroxyde de sodium aqueux pour former l’isocyanurate de tris(2-hydroxyéthyle).
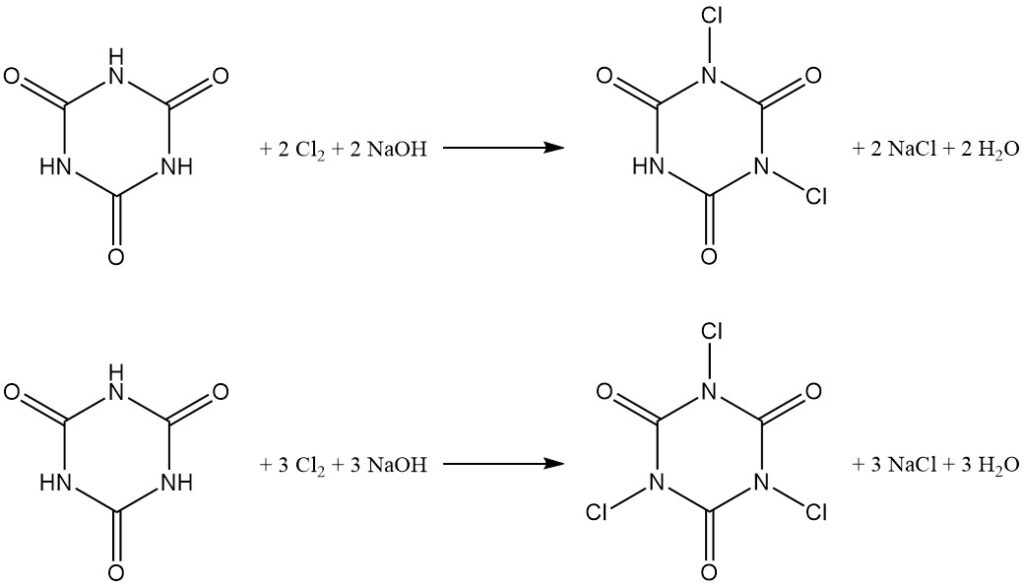
La chloration à pH contrôlé de l’acide cyanurique dans l’eau donne des dérivés N,N’-dichloro et N,N’,N”-trichloro (voir l’article sur les chloroamines).
La distribution du produit dépend du rapport molaire hydroxyde de sodium/acide cyanurique, avec un rapport de 2:1 en faveur de l’acide N,N’-dichloroisocyanurique (DCCA) et un rapport de 3:1 en faveur de l’acide N,N’,N”-trichloroisocyanurique (TCCA) avec un rendement de 90 %.
Au-dessus de 200 °C, l’acide cyanurique se décompose lentement, puis s’accélère à son point de fusion (320–330 °C). Le produit principal est l’acide isocyanique. À des températures plus élevées, les réactions de décomposition impliquent probablement un clivage du cycle via un intermédiaire acide cyanique.
3. Production d’acide cyanurique
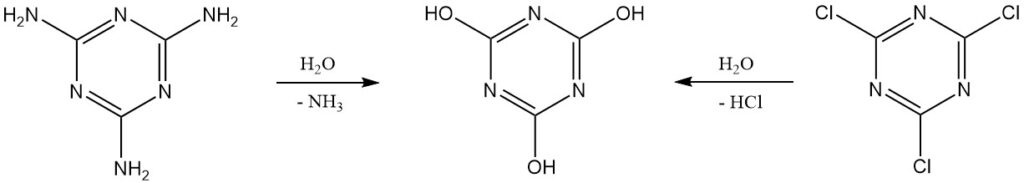
L’acide cyanurique pur peut être produit en laboratoire par hydrolyse du chlorure cyanurique ou de la mélamine. Une purification supplémentaire implique une recristallisation à partir de diméthylformamide ou l’utilisation de sels de sodium ou d’ammonium.
L’acide cyanurique est fabriqué commercialement par la décomposition thermique (pyrolyse) de l’urée à 200–300 °C, ce qui génère de l’ammoniac comme sous-produit.
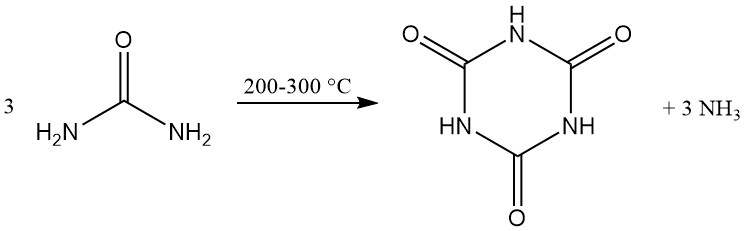
De nombreuses méthodes brevetées visent à améliorer le transfert de chaleur et de masse en concevant des réacteurs spéciaux ou en modifiant les mélanges réactionnels. Les réacteurs utilisés comprennent des vis chauffées, des tambours rotatifs, des bandes transporteuses, des fours à tubes rotatifs et des broyeurs à boulets.
Des lits fluidisés avec des particules d’AlF3 ou des cristaux d’acide cyanurique et le chauffage par induction à haute fréquence de l’urée fondue ont également été explorés.
Le problème de l’agglomération pendant le processus est résolu en utilisant des poudres prémélangées avec des rapports urée/acide cyanurique spécifiques, du cyanurate d’urée préformé ou en recyclant le produit brut.
Des métaux ou des sels fondus peuvent être utilisés comme moyens de transfert de chaleur au lieu du chauffage direct. Des solvants à point d’ébullition élevé comme les éthers de polyglycol et les sulfolanes qui dissolvent l’urée mais pas l’acide cyanurique peuvent être utilisés pour éviter une surchauffe localisée et minimiser la formation d’acide isocyanique.
L’acide cyanurique brut contient généralement jusqu’à 30 % d’impuretés telles que la mélamine et ses précurseurs. Les méthodes de purification comprennent le traitement acide et la séparation basée sur la solubilité.
Les acides minéraux dilués convertissent les impuretés en ammoniac, en dioxyde de carbone ou en acide cyanurique lui-même. Une autre méthode consiste à dissoudre l’acide brut dans une solution alcaline (NaOH ou ammoniac dilué), puis à filtrer les impuretés organiques. L’acide cyanurique est ensuite précipité par ajout d’acides minéraux.
4. Utilisations de l’acide cyanurique
L’acide cyanurique est principalement utilisé dans la production d’isocyanurates N-chlorés. Ces dérivés contenant du chlore sont largement utilisés comme désinfectants et agents assainissants dans :
- Désinfectants pour piscines
- Eau de Javel domestique
- Nettoyants industriels et institutionnels
- Détergents pour lave-vaisselle
L’acide cyanurique est également utilisé pour aider à stabiliser le chlore dans l’eau des piscines en réduisant son taux de désactivation d’un facteur 5 à 10 lorsqu’il est utilisé à des concentrations de 25 à 50 ppm.
Son utilisation est approuvée comme source d’azote dans l’alimentation des ruminants. L’acide cyanurique est un précurseur de l’acide isocyanique.
De petites quantités d’acide cyanurique sont utilisées pour réduire les émissions de NOx dans les gaz d’échappement des moteurs diesel stationnaires et des chaudières alimentées au charbon, au pétrole ou au gaz.
Plusieurs dérivés isocyanurates de l’acide cyanurique sont utilisés dans l’industrie des plastiques. Exemples :
- Isocyanurate de triallyle : homopolymérisé ou copolymérisé, il fonctionne comme agent de réticulation dans les formulations de polyéthylène, de polychlorure de vinyle (PVC) et de stratifiés.
- Isocyanurate de tris(2-hydroxyéthyle) : ce composé agit comme agent de réticulation pour les polyuréthanes, les polyesters et les résines alkydes utilisés dans les émaux pour fils et les vernis électriques.
- Isocyanurate de triglycidyle : c’est un agent de réticulation dans les résines époxy et un agent de durcissement pour les revêtements en poudre résistants aux intempéries.
Le cyanurate de mélamine a acquis une importance commerciale en tant que retardateur de flamme sans halogène pour les résines polyamides. Il est également utilisé comme lubrifiant solide potentiel.
L’isocyanurate de tris(2-carboxyéthyle) est utilisé dans la production de résines alkydes hydrosolubles. Ses dérivés esters servent de plastifiants pour le PVC et les lubrifiants.
5. Toxicologie de l’acide cyanurique
L’acide cyanurique est généralement considéré comme un produit à faible risque. Il est classé comme essentiellement non toxique (exposition orale et cutanée aiguë) et non irritant pour la peau et les yeux.
Données sur la toxicité aiguë :
- DL50 (rat, orale) > 5 000 mg/kg (pratiquement non toxique)
- DL50 (lapin, cutanée) > 5 000 mg/kg (pratiquement non toxique)
- CL50 (poisson) > 2 000 mg/L (24 h) (faible toxicité)
- CE50 (daphnie) > 2000 mg/L (faible toxicité)
Données sur la toxicité subaiguë :
- NOEL (poisson) : 1 000 mg/L
- NOEL (algues) : 2 500 mg/L
- Inhibition de la reproduction (daphnies) : 1 000 mg/L
Même si l’acide cyanurique présente une faible toxicité inhérente, l’inhalation de poussière, le contact avec les yeux et l’ingestion doivent néanmoins être évités. Sachez qu’il se décompose en acide isocyanique toxique au-dessus de 200 °C.
Référence
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191

