¿Qué es el ácido cianúrico?
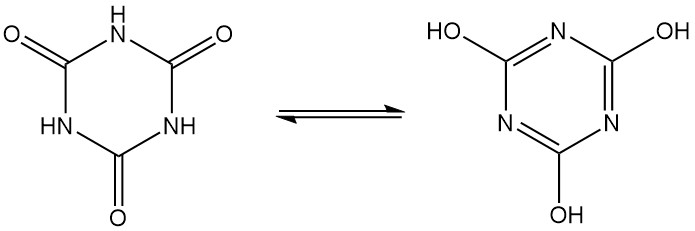
El ácido cianúrico, también conocido como 1,3,5-triazina-2,4,6(1H,3H,5H)-triona, es un sólido cristalino blanco inodoro con una fórmula molecular de C3H3N3O3. Es un trímero cíclico que se interconvierte entre varias estructuras a través de la tautomería lactama-lactima.
Aunque el ácido cianúrico se conoce desde 1776, recién ganó importancia industrial en la década de 1950.
Tabla de contenido
1. Propiedades físicas del ácido cianúrico
El ácido cianúrico es un sólido cristalino blanco que forma un dihidrato cristalino incoloro a partir del agua y pierde agua al exponerse al aire seco. Es un ácido tribásico débil que es ligeramente soluble en agua y disolventes orgánicos como acetona, benceno, éter, etanol, hexano y alcohol isopropílico.
La siguiente tabla muestra la solubilidad del ácido cianúrico en varios disolventes a 25 °C (% en peso).
| Disolvente | Solubilidad (% en peso) |
|---|---|
| Dimetilsulfóxido | 17,4 |
| Ácido sulfúrico (98% en peso) | 14,1 |
| Dimetilformamida | 7,2 |
| N-metil-2-pirrolidona | 6,3 |
| Dimetilacetamida | 3,0 |
| Piridina | 2,2 |
Las propiedades físicas importantes del ácido cianúrico se enumeran en la Tabla 1.
| Propiedad | Valor |
|---|---|
| Número CAS | 108-80-5 |
| Fórmula | C3H3N3O3 |
| Peso molecular | 129,07 g/mol |
| Punto de fusión | 320 – 330 °C (descomposición) |
| Densidad | 1,80 g/cm³ |
| pKa1 | 6,88 |
| pKa2 | 11,40 |
| pKa3 | 13,5 |
2. Reacciones del ácido cianúrico
El ácido cianúrico reacciona con bases orgánicas e inorgánicas para formar sales, que favorecen al hidroxitautómero en soluciones alcalinas.
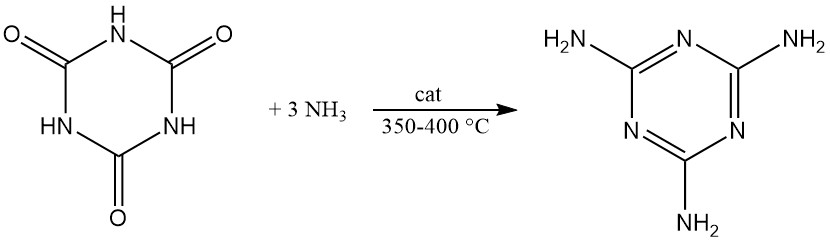
Bajo presión y con un catalizador a 350–400 °C, el ácido cianúrico reacciona con amoníaco para producir melamina.
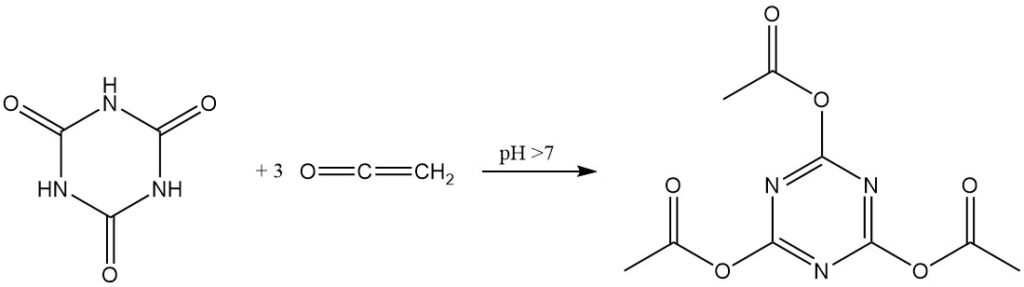
En presencia de catalizadores alcalinos, la cetena reacciona con el ácido cianúrico para formar cianurato de triacetilo con alto rendimiento.
El ácido cianúrico reacciona principalmente como una imida cíclica. El átomo de nitrógeno del isocianurato nucleófilo, a menudo en forma aniónica, ataca a un átomo de carbono polarizado positivamente. Esto generalmente conduce a productos trisustituidos.
El calentamiento del ácido cianúrico con epóxidos en DMF da como resultado la formación de isocianuratos de hidroxialquilo. Algunos ejemplos incluyen la síntesis de isocianurato de tris(2-hidroxietilo) a partir de óxido de etileno y el derivado de hidroxipropilo correspondiente a partir de óxido de propileno.
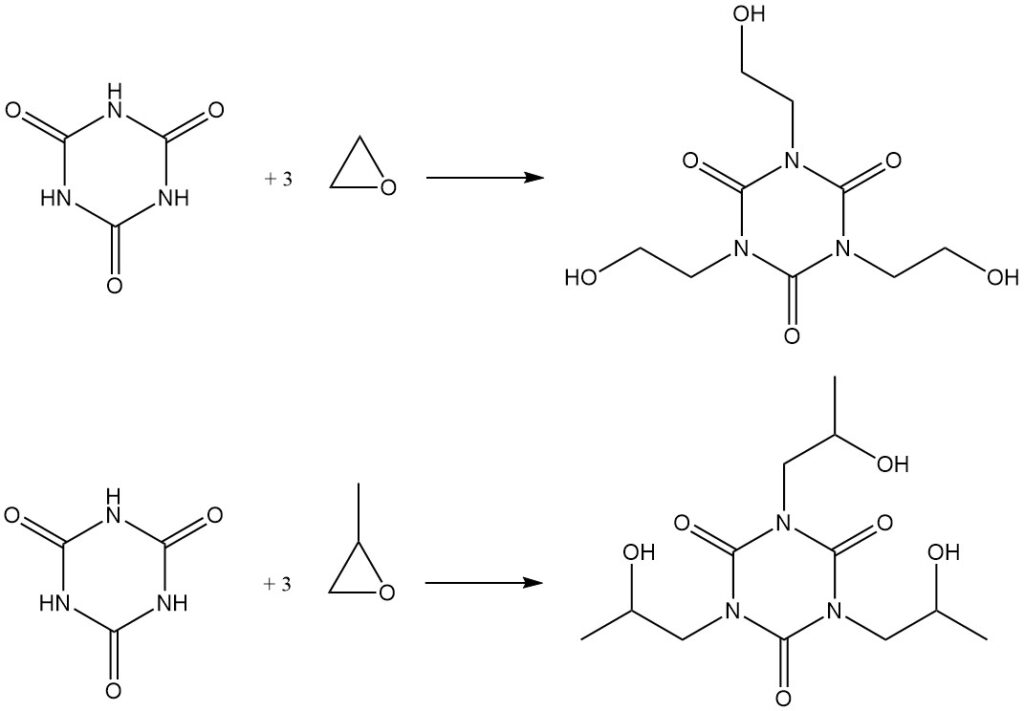
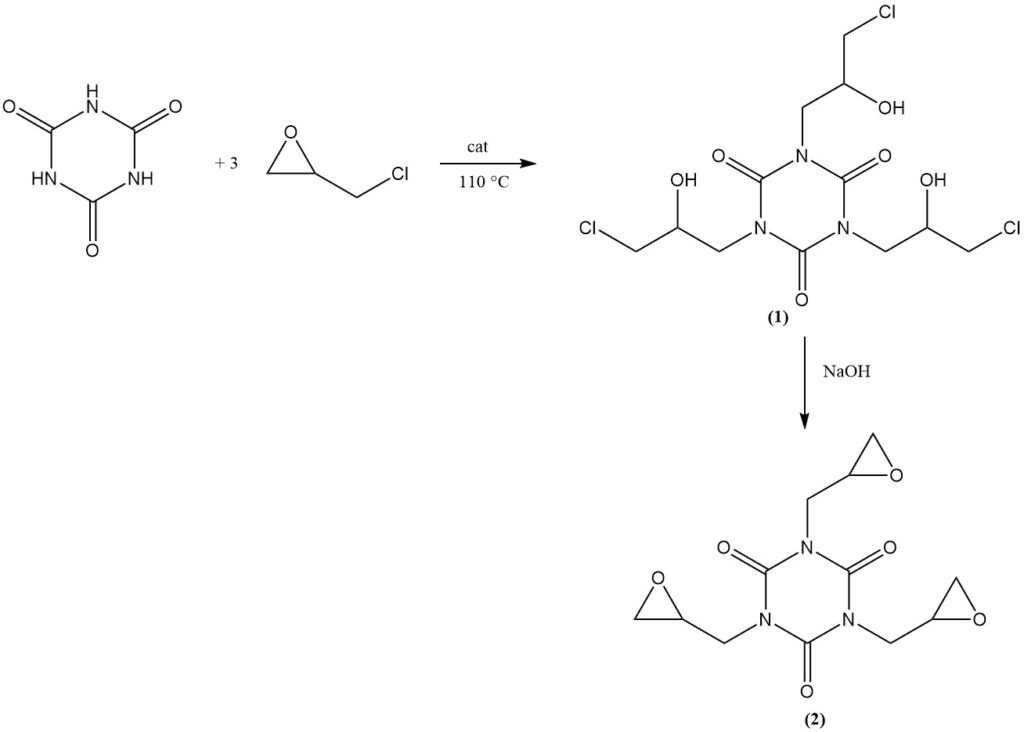
La reacción del ácido cianúrico con epiclorhidrina en presencia de un catalizador básico a 110 °C produce isocianurato de tris(3-cloro-2-hidroxipropilo) (1). La posterior deshidrocloración en una solución alcalina acuosa produce el producto comercial isocianurato de tris(2,3-epoxipropilo) (2).
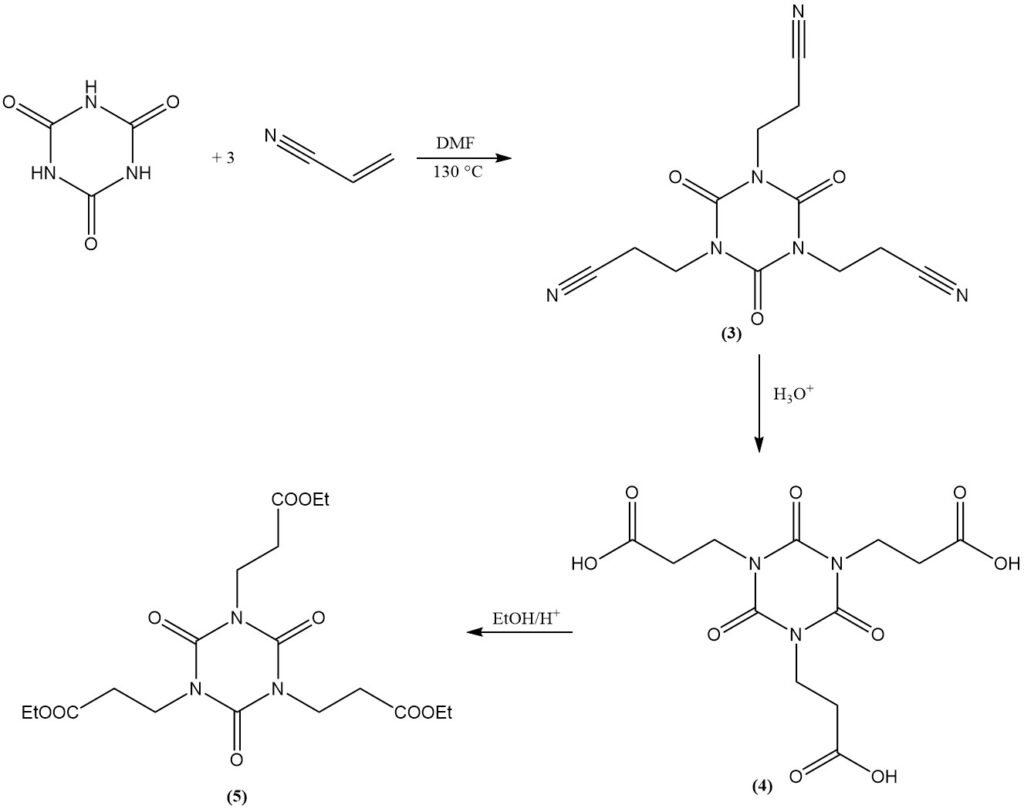
El ácido cianúrico sufre reacciones de adición con enlaces dobles. Un ejemplo es la formación de isocianuratos de bis(2-cianoetilo) y tris(2-cianoetilo) a partir de acrilonitrilo en DMF a 130 °C. El isocianurato de tris(2-cianoetilo) (3) se puede saponificar para producir isocianurato de tris(2-carboxietilo) (4).
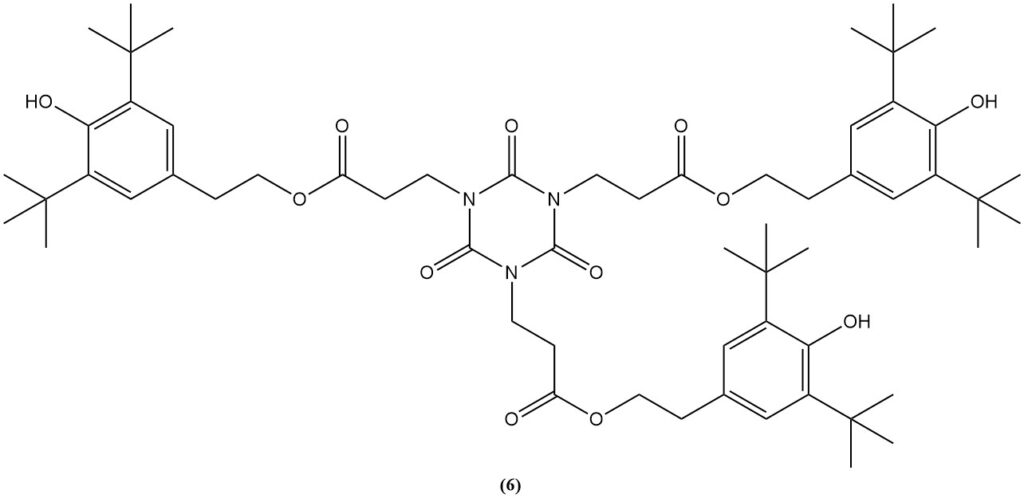
La esterificación del derivado carboxietilo con etanol produce isocianurato de tris(2-carbetoxietilo) (5), un precursor del estabilizador de luz y antioxidante comercial (6).
El ácido cianúrico se disuelve fácilmente en formaldehído acuoso para formar tris (hidroximetil) isocianurato.
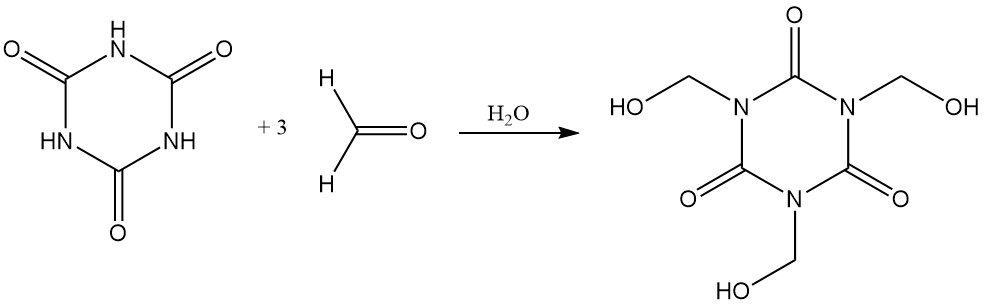
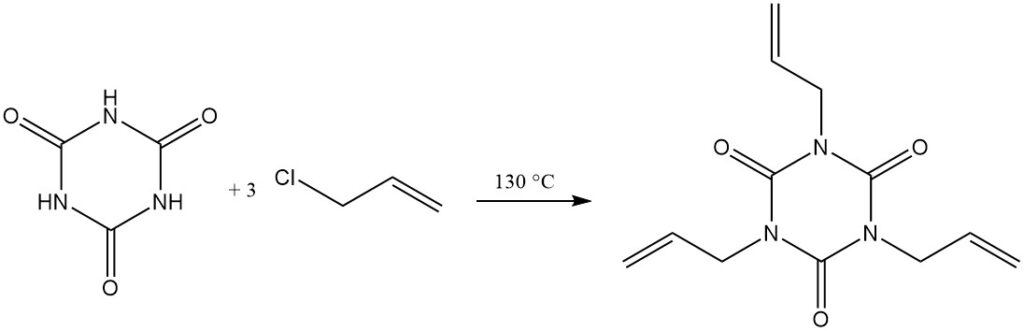
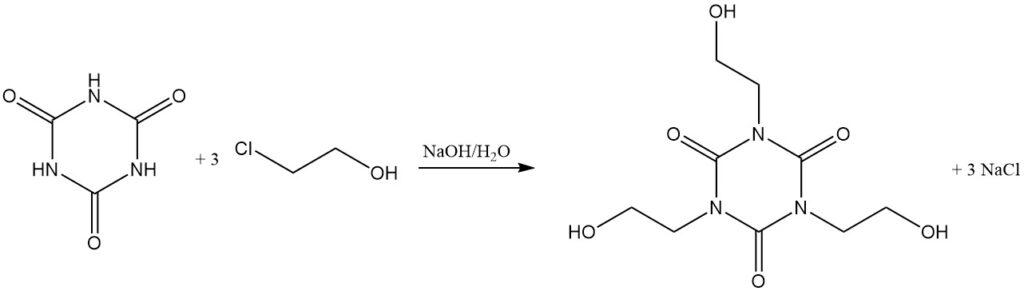
A temperaturas elevadas y con un aceptor de protones, los haluros de alquilo reaccionan con el ácido cianúrico. Entre los ejemplos se incluyen la reacción con cloruro de alilo en diclorobenceno/trietilamina a 130 °C para formar isocianurato de trialilo y con 2-cloroetanol en hidróxido de sodio acuoso para formar isocianurato de tris(2-hidroxietilo).
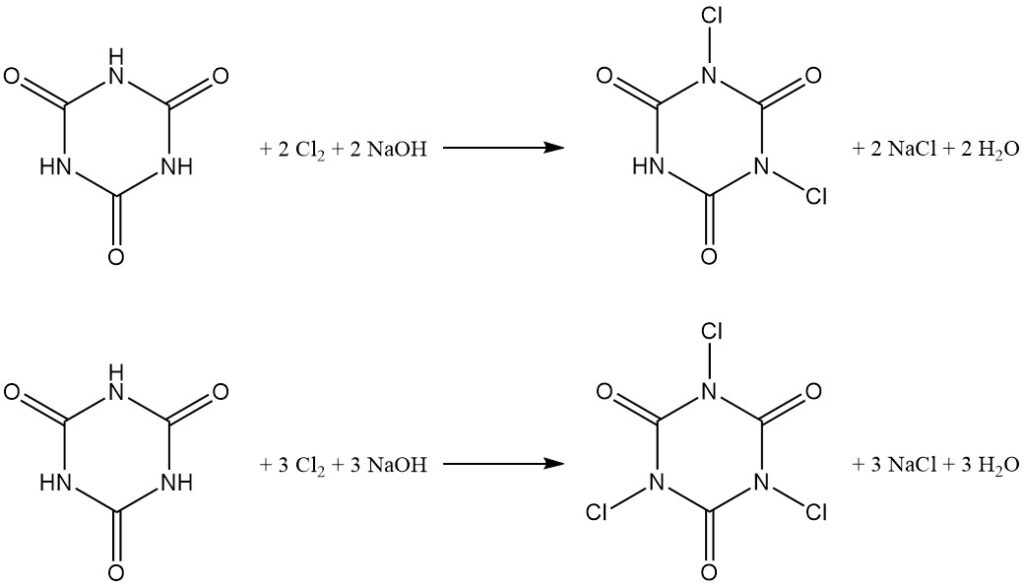
La cloración a pH controlado del ácido cianúrico en agua produce derivados de N,N’-dicloro y N,N’,N»-tricloro (consulte el artículo sobre cloroaminas).
La distribución del producto depende de la relación molar entre hidróxido de sodio y ácido cianúrico, con una relación 2:1 que favorece al ácido N,N’-dicloroisocianúrico (DCCA) y una relación 3:1 que favorece al ácido N,N’,N»-tricloroisocianúrico (TCCA) con un rendimiento del 90%.
Por encima de los 200 °C, el ácido cianúrico se descompone lentamente, acelerándose en su punto de fusión (320–330 °C). El producto principal es el ácido isociánico. A temperaturas más altas, las reacciones de descomposición probablemente impliquen la escisión del anillo a través de un intermedio de ácido cianúrico.
3. Producción de ácido cianúrico
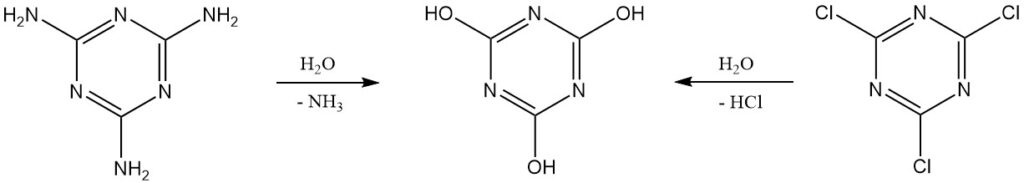
El ácido cianúrico puro se puede producir en el laboratorio mediante la hidrólisis del cloruro cianúrico o la melamina. Una purificación posterior implica la recristalización a partir de dimetilformamida o el uso de sales de sodio o amonio.
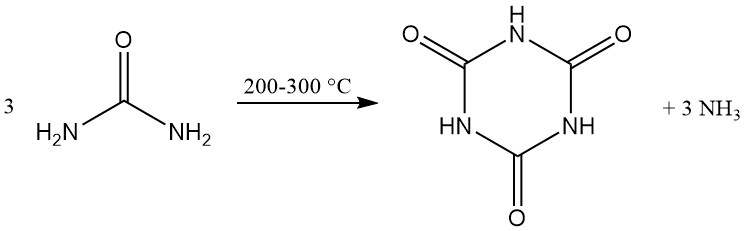
El ácido cianúrico se fabrica comercialmente mediante la descomposición térmica (pirólisis) de la urea a 200–300 °C, lo que genera amoníaco como subproducto.
Numerosos métodos patentados se centran en mejorar la transferencia de calor y masa mediante el diseño de reactores especiales o la modificación de mezclas de reacción. Los reactores utilizados incluyen tornillos calentados, tambores rotatorios, cintas transportadoras, hornos de tubo rotatorio y molinos de bolas.
También se han explorado lechos fluidizados con partículas de AlF3 o cristales de ácido cianúrico y calentamiento por inducción de alta frecuencia de urea fundida.
El problema de apelmazamiento durante el proceso se resuelve utilizando polvos premezclados con proporciones específicas de urea y ácido cianúrico, cianurato de urea preformado o reciclando el producto crudo.
Se pueden utilizar metales o sales fundidos como medios de transferencia de calor en lugar de calentamiento directo. Se pueden utilizar disolventes de alto punto de ebullición como éteres de poliglicol y sulfolanos que disuelven la urea pero no el ácido cianúrico para evitar el sobrecalentamiento localizado y minimizar la formación de ácido isociánico.
El ácido cianúrico crudo normalmente contiene hasta un 30% de impurezas como melamina y sus precursores. Los métodos de purificación incluyen el tratamiento con ácido y la separación basada en la solubilidad.
Los ácidos minerales diluidos convierten las impurezas en amoníaco, dióxido de carbono o ácido cianúrico. Otro método consiste en disolver el ácido crudo en una solución alcalina (NaOH o amoníaco diluido) y luego filtrar las impurezas orgánicas. Luego, el ácido cianúrico se precipita añadiendo ácidos minerales.
4. Usos del ácido cianúrico
El uso más importante del ácido cianúrico es en la producción de isocianuratos N-clorados. Estos derivados que contienen cloro se utilizan ampliamente como desinfectantes y agentes higienizantes en:
- Desinfectantes para piscinas
- Blanqueadores domésticos
- Limpiadores industriales e institucionales
- Detergentes para lavavajillas
El ácido cianúrico también se utiliza para ayudar a estabilizar el cloro en el agua de las piscinas al reducir su tasa de desactivación en un factor de 5 a 10 cuando se utiliza en concentraciones de 25 a 50 ppm.
Está aprobado para su uso como fuente de nitrógeno en la alimentación de los rumiantes. El ácido cianúrico es un precursor del ácido isociánico.
Se utilizan pequeñas cantidades de ácido cianúrico para reducir las emisiones de NOx en los gases de escape de los motores diésel estacionarios y las calderas alimentadas con carbón, petróleo o gas.
Se utilizan varios derivados isocianuratos del ácido cianúrico en la industria del plástico. Algunos ejemplos son:
- Isocianurato de trialilo: homopolimerizado o copolimerizado, funciona como agente de reticulación en formulaciones de polietileno, cloruro de polivinilo (PVC) y laminados.
- Isocianurato de tris(2-hidroxietilo): este compuesto actúa como agente de reticulación para poliuretanos, poliésteres y resinas alquídicas utilizadas en esmaltes para cables y barnices eléctricos.
- Isocianurato de triglicidilo: es un agente de reticulación en resinas epoxi y un agente de curado para recubrimientos en polvo resistentes a la intemperie.
El cianurato de melamina ha ganado importancia comercial como retardante de llama libre de halógenos para resinas de poliamida. También se utiliza como posible lubricante sólido.
El isocianurato de tris(2-carboxietilo) se utiliza en la producción de resinas alquídicas solubles en agua. Sus derivados de ésteres sirven como plastificantes para PVC y lubricantes.
5. Toxicología del ácido cianúrico
El ácido cianúrico se considera generalmente un producto de bajo riesgo. Se clasifica como esencialmente no tóxico (agudo oral y dérmico) y no irritante para la piel y los ojos.
Datos de toxicidad aguda:
- LD50 (rata, oral) > 5000 mg/kg (prácticamente no tóxico)
- LD50 (conejo, dérmico) > 5000 mg/kg (prácticamente no tóxico)
- LC50 (pez) > 2000 mg/L (24 h) (baja toxicidad)
- EC50 (Daphnia) > 2000 mg/L (baja toxicidad)
Datos de toxicidad subaguda:
- NOEL (peces): 1000 mg/L
- NOEL (algas): 2500 mg/L
- Inhibición de la reproducción (Daphnia): 1000 mg/L
Aunque el ácido cianúrico tiene una baja toxicidad inherente, se debe evitar la inhalación de polvo, el contacto con los ojos y la ingestión. Tenga en cuenta que se descompone en ácido isociánico tóxico por encima de los 200 °C.
Referencia
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191