Was ist Cyanursäure?
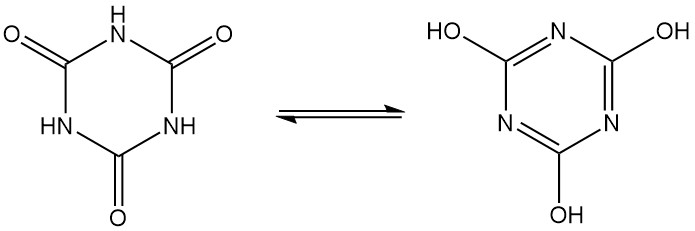
Cyanursäure, auch bekannt als 1,3,5-Triazin-2,4,6(1H,3H,5H)-trion, ist ein geruchloser weißer kristalliner Feststoff mit der Molekülformel C3H3N3O3. Es handelt sich um ein zyklisches Trimer, das sich durch Lactam-Lactim-Tautomerie zwischen mehreren Strukturen umwandelt.
Obwohl Cyanursäure seit 1776 bekannt ist, erlangte sie erst in den 1950er Jahren industrielle Bedeutung.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Cyanursäure
Cyanursäure ist ein weißer kristalliner Feststoff, der aus Wasser ein farbloses kristallines Dihydrat bildet und bei Kontakt mit trockener Luft Wasser verliert. Es handelt sich um eine schwache dreibasige Säure, die in Wasser und organischen Lösungsmitteln wie Aceton, Benzol, Ether, Ethanol, Hexan und Isopropylalkohol leicht löslich ist.
Die folgende Tabelle zeigt die Löslichkeit von Cyanursäure in verschiedenen Lösungsmitteln bei 25 °C (Gew.-%).
| Lösungsmittel | Löslichkeit (Gew.-%) |
|---|---|
| Dimethylsulfoxid | 17,4 |
| Schwefelsäure (98 Gew.-%) | 14,1 |
| Dimethylformamid | 7,2 |
| N-Methyl-2-pyrrolidon | 6,3 |
| Dimethylacetamid | 3,0 |
| Pyridin | 2,2 |
Die wichtigen physikalischen Eigenschaften der Cyanursäure sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | 108-80-5 |
| Formel | C3H3N3O3 |
| Molekulargewicht | 129,07 g/mol |
| Schmelzpunkt | 320 – 330 °C (Zersetzung) |
| Dichte | 1,80 g/cm³ |
| pKa1 | 6,88 |
| pKa2 | 11,40 |
| pKa3 | 13,5 |
2. Reaktionen der Cyanursäure
Cyanursäure reagiert mit anorganischen und organischen Basen zu Salzen, die in alkalischen Lösungen das Hydroxytautomer begünstigen.
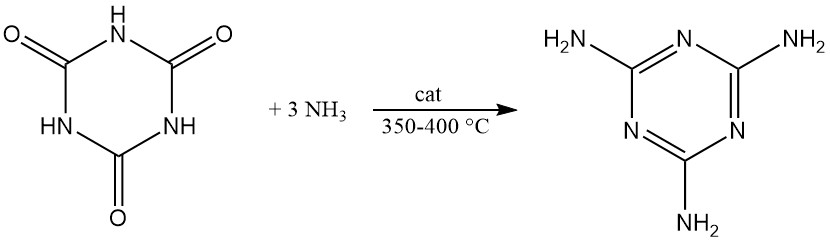
Unter Druck und mit einem Katalysator bei 350–400 °C reagiert Cyanursäure mit Ammoniak zu Melamin.
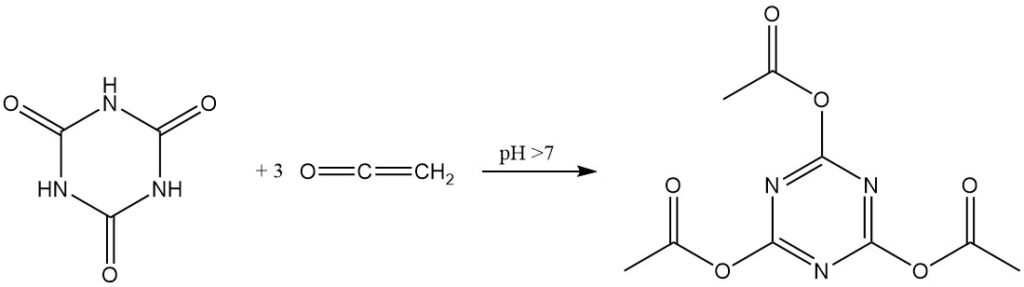
In Gegenwart alkalischer Katalysatoren reagiert Keten mit Cyanursäure zu Triacetylcyanurat in hoher Ausbeute.
Cyanursäure reagiert hauptsächlich als zyklisches Imid. Das nukleophile Stickstoffatom des Isocyanurats, oft in anionischer Form, greift ein positiv polarisiertes Kohlenstoffatom an. Dies führt typischerweise zu trisubstituierten Produkten.
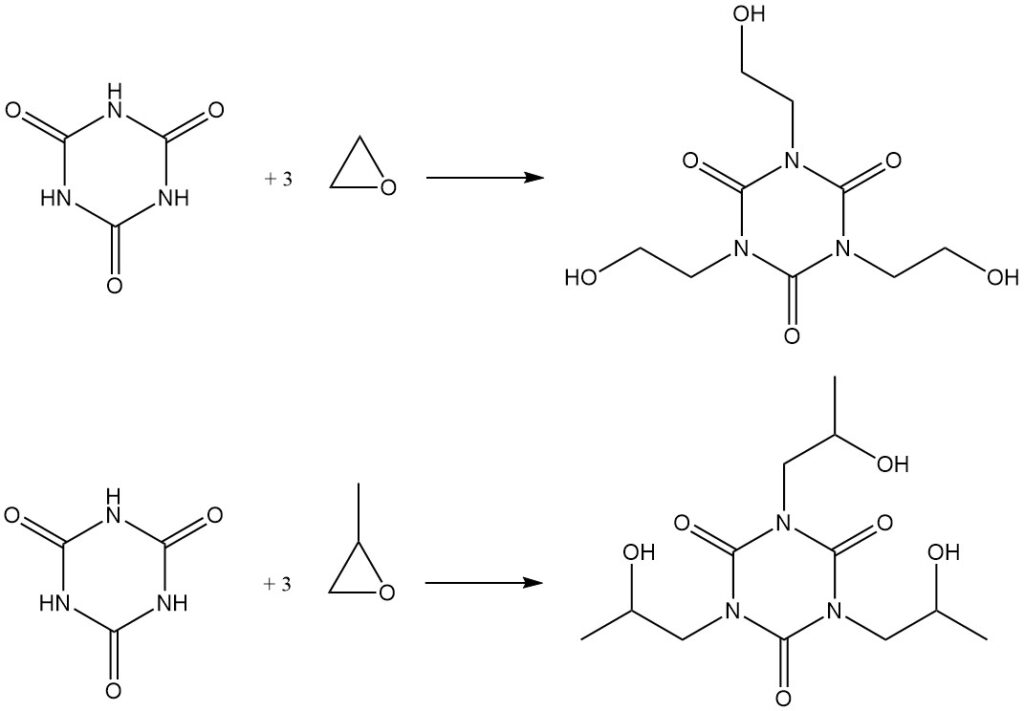
Das Erhitzen von Cyanursäure mit Epoxiden in DMF führt zur Bildung von Hydroxyalkylisocyanuraten. Beispiele hierfür sind die Synthese von Tris(2-hydroxyethyl)isocyanurat aus Ethylenoxid und dem entsprechenden Hydroxypropylderivat aus Propylenoxid.
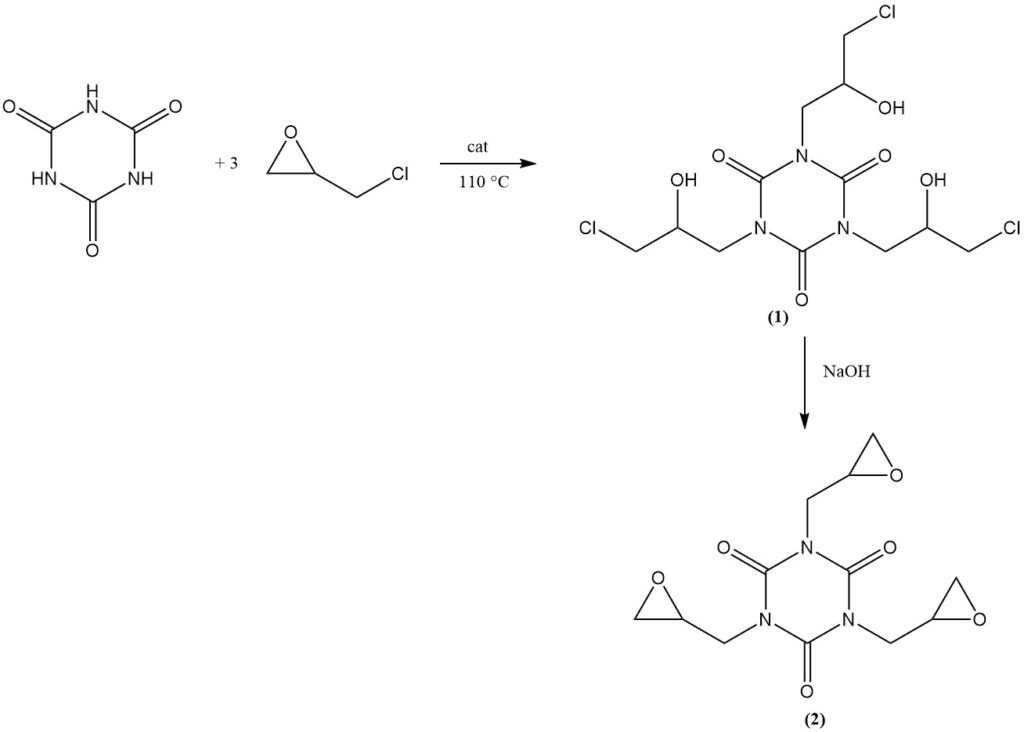
Die Reaktion von Cyanursäure mit Epichlorhydrin in Gegenwart eines basischen Katalysators bei 110 °C liefert Tris(3-chlor-2-hydroxypropyl)isocyanurat (1). Durch anschließende Dehydrochlorierung in einer wässrigen alkalischen Lösung entsteht das Handelsprodukt Tris(2,3-epoxypropyl)isocyanurat (2).
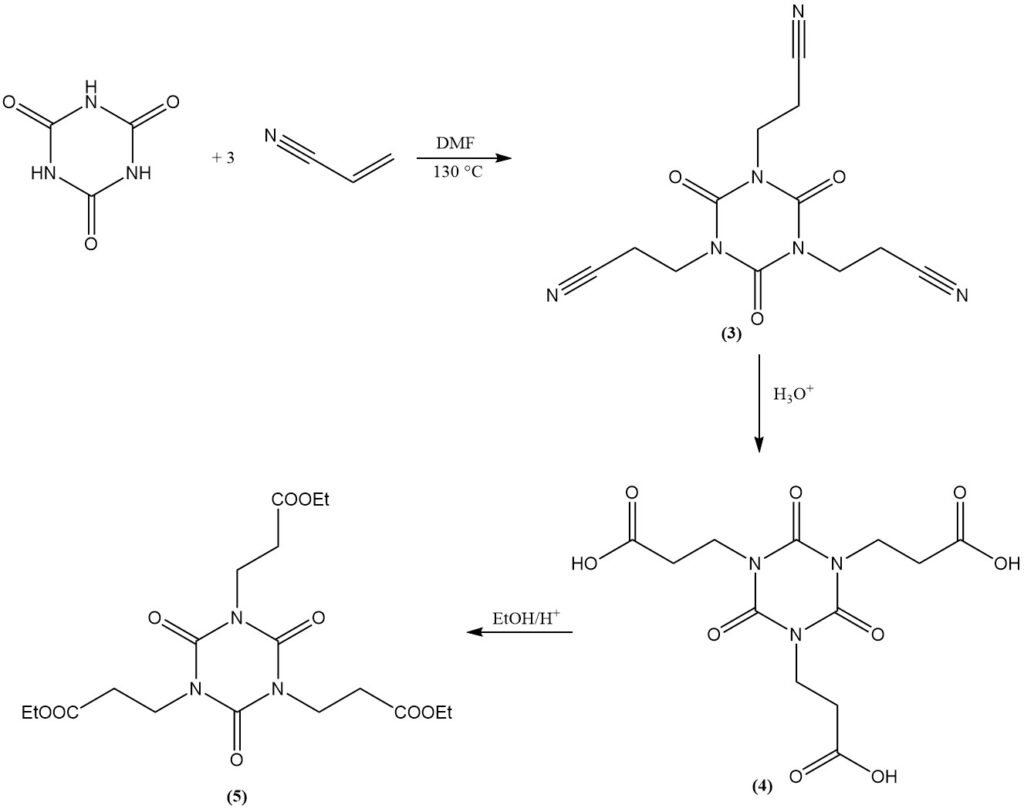
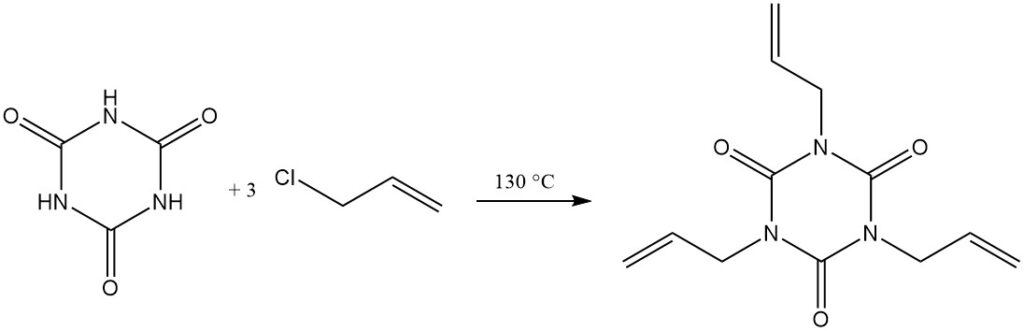
Cyanursäure geht Additionsreaktionen mit Doppelbindungen ein. Ein Beispiel ist die Bildung von Bis(2-cyanoethyl)- und Tris(2-cyanoethyl)-isocyanuraten aus Acrylnitril in DMF bei 130 °C. Tris(2-cyanoethyl)-isocyanurat (3) kann zu Tris(2-carboxyethyl)-isocyanurat (4) verseift werden.
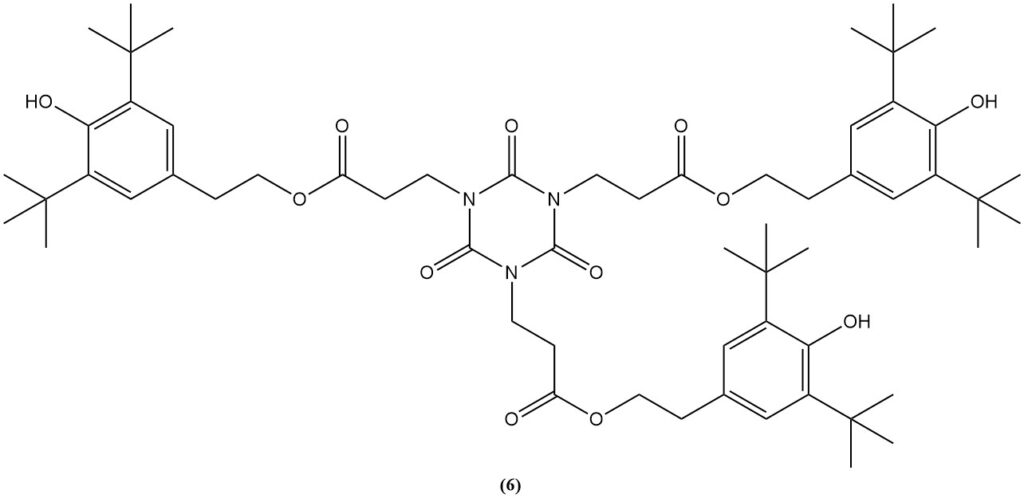
Die Veresterung des Carboxyethylderivats mit Ethanol ergibt Tris(2-carbethoxyethyl)-isocyanurat (5), eine Vorstufe für den kommerziellen Lichtstabilisator und Antioxidans (6).
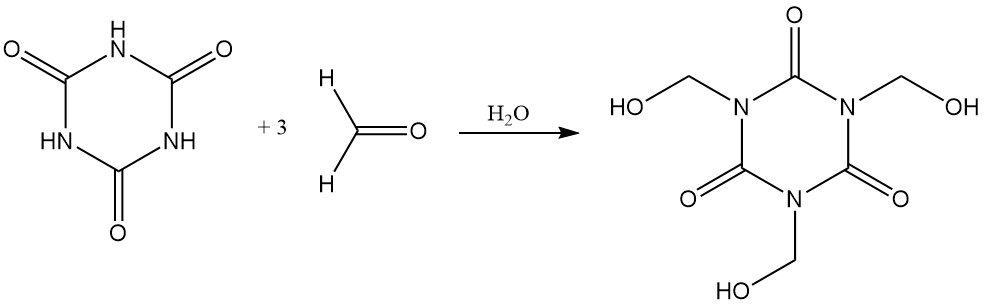
Cyanursäure löst sich leicht in wässrigem Formaldehyd und bildet Tris(hydroxymethyl)isocyanurat.
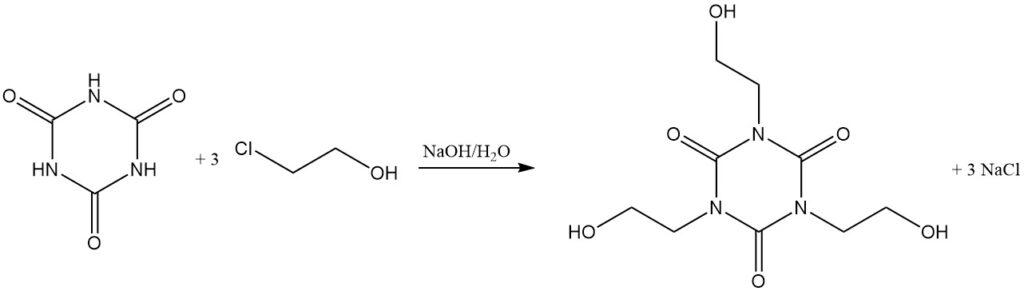
Bei erhöhten Temperaturen und mit einem Protonenakzeptor reagieren Alkylhalogenide mit Cyanursäure. Beispiele hierfür sind die Reaktion mit Allylchlorid in Dichlorbenzol/Triethylamin bei 130 °C zu Triallylisocyanurat und mit 2-Chlorethanol in wässriger Natriumhydroxidlösung zu Tris(2-hydroxyethyl)isocyanurat.
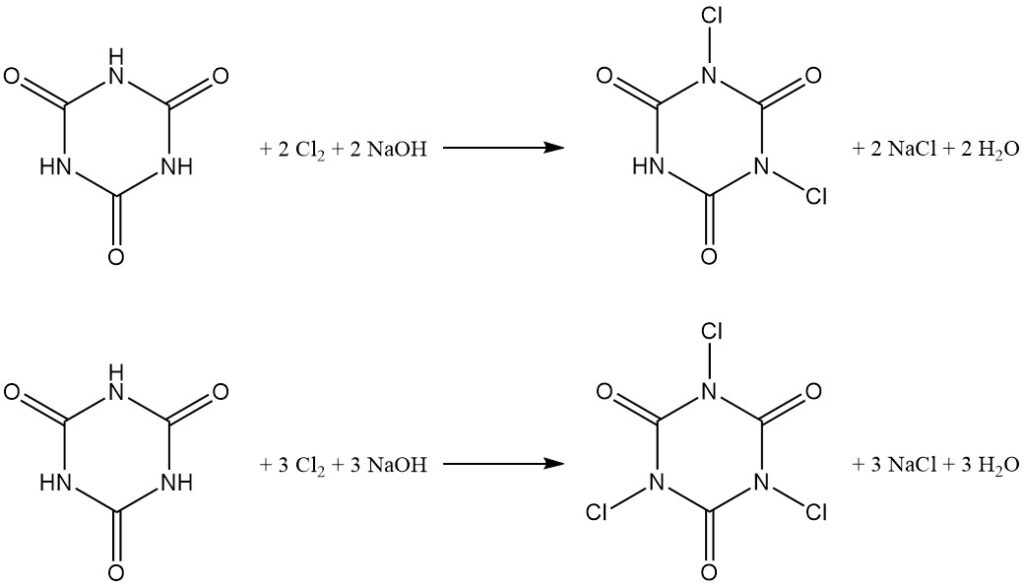
Die Chlorierung von Cyanursäure in Wasser bei kontrolliertem pH-Wert ergibt N,N’-Dichlor- und N,N’,N”-Trichlorderivate (siehe den Artikel über Chloramine).
Die Produktverteilung hängt vom Molverhältnis von Natriumhydroxid zu Cyanursäure ab, wobei ein Verhältnis von 2:1 N,N’-Dichlorisocyanursäure (DCCA) und ein Verhältnis von 3:1 N,N’,N”-Trichlorisocyanursäure (TCCA) mit einer Ausbeute von 90 % begünstigt.
Oberhalb von 200 °C zersetzt sich Cyanursäure langsam, beschleunigt sich jedoch an ihrem Schmelzpunkt (320–330 °C). Das Hauptprodukt ist Isocyansäure. Bei höheren Temperaturen sind Zersetzungsreaktionen wahrscheinlich mit einer Ringspaltung über ein Cyansäure-Zwischenprodukt verbunden.
3. Herstellung von Cyanursäure
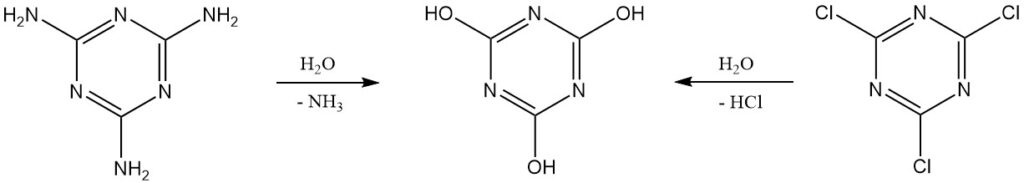
Reine Cyanursäure kann im Labor durch Hydrolyse von Cyanurchlorid oder Melamin hergestellt werden. Zur weiteren Reinigung wird eine Umkristallisation aus Dimethylformamid oder die Verwendung von Natrium- oder Ammoniumsalzen durchgeführt.
Cyanursäure wird kommerziell durch die thermische Zersetzung (Pyrolyse) von Harnstoff bei 200–300 °C hergestellt, wobei Ammoniak als Nebenprodukt entsteht.
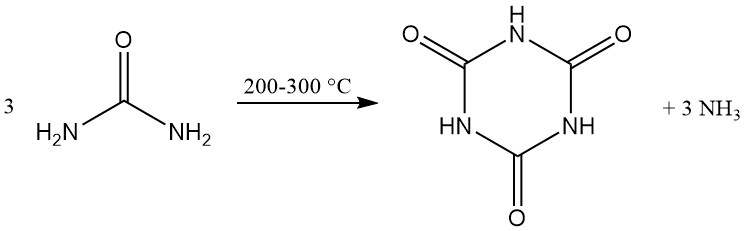
Zahlreiche patentierte Methoden konzentrieren sich auf die Verbesserung des Wärme- und Massentransfers durch die Entwicklung spezieller Reaktoren oder die Modifizierung von Reaktionsgemischen. Zu den verwendeten Reaktoren gehören beheizte Schnecken, rotierende Trommeln, Förderbänder, Drehrohröfen und Kugelmühlen.
Fließbetten mit AlF3-Partikeln oder Cyanursäurekristallen und Hochfrequenz-Induktionserhitzung von geschmolzenem Harnstoff wurden ebenfalls untersucht.
Das Verklumpungsproblem während des Prozesses wird durch die Verwendung vorgemischter Pulver mit spezifischen Verhältnissen von Harnstoff zu Cyanursäure, vorgefertigtem Harnstoffcyanurat oder durch Recycling des Rohprodukts gelöst.
Anstelle einer direkten Erhitzung können geschmolzene Metalle oder Salze als Wärmeübertragungsmedien verwendet werden. Hochsiedende Lösungsmittel wie Polyglykolether und Sulfolane, die Harnstoff, aber nicht Cyanursäure lösen, können verwendet werden, um eine lokale Überhitzung zu vermeiden und die Bildung von Isocyanursäure zu minimieren.
Rohe Cyanursäure enthält typischerweise bis zu 30 % Verunreinigungen wie Melamin und seine Vorläufer. Zu den Reinigungsverfahren gehören Säurebehandlung und Trennung auf Löslichkeitsbasis.
Verdünnte Mineralsäuren wandeln Verunreinigungen in Ammoniak, Kohlendioxid oder Cyanursäure selbst um. Bei einer anderen Methode wird die Rohsäure in einer alkalischen Lösung (NaOH oder verdünntes Ammoniak) gelöst und anschließend die organischen Verunreinigungen herausgefiltert. Die Cyanursäure wird dann durch Zugabe von Mineralsäuren ausgefällt.
4. Verwendung von Cyanursäure
Die wichtigste Verwendung von Cyanursäure ist die Herstellung von N-chlorierten Isocyanuraten. Diese chlorhaltigen Derivate werden häufig als Desinfektions- und Reinigungsmittel verwendet in:
- Desinfektionsmitteln für Schwimmbäder
- Bleichmitteln für den Haushalt
- Reinigungsmitteln für Industrie und Gewerbe
- Geschirrspülmitteln
Cyanursäure wird auch verwendet, um Chlor in Schwimmbadwasser zu stabilisieren, indem sie dessen Deaktivierungsrate bei Konzentrationen von 25–50 ppm um den Faktor 5–10 reduziert.
Sie ist als Stickstoffquelle in Wiederkäuerfutter zugelassen. Cyanursäure ist ein Vorläufer von Isocyansäure.
Kleine Mengen Cyanursäure werden verwendet, um die NOx-Emissionen in Abgasen von stationären Dieselmotoren und Kesseln zu reduzieren, die mit Kohle, Öl oder Gas betrieben werden.
Mehrere Isocyanurat-Derivate von Cyanursäure werden in der Kunststoffindustrie verwendet. Beispiele hierfür sind:
- Triallylisocyanurat: Homopolymerisiert oder copolymerisiert fungiert es als Vernetzungsmittel in Polyethylen-, Polyvinylchlorid- (PVC-) und Laminatformulierungen.
- Tris(2-hydroxyethyl)isocyanurat: Diese Verbindung fungiert als Vernetzungsmittel für Polyurethane, Polyester und Alkydharze, die in Drahtlacken und Elektrolacken verwendet werden.
- Triglycidylisocyanurat: Es ist ein Vernetzungsmittel in Epoxidharzen und ein Härtemittel für wetterbeständige Pulverbeschichtungen.
Melamincyanurat hat als halogenfreies Flammschutzmittel für Polyamidharze kommerzielle Bedeutung erlangt. Es wird auch als potenzielles festes Schmiermittel verwendet.
Tris(2-carboxyethyl)isocyanurat wird bei der Herstellung wasserlöslicher Alkydharze verwendet. Seine Esterderivate dienen als Weichmacher für PVC und Schmiermittel.
5. Toxikologie von Cyanursäure
Cyanursäure gilt allgemein als Produkt mit geringem Gefahrenpotenzial. Sie wird als im Wesentlichen ungiftig (akut oral und dermal) und nicht reizend für Haut und Augen eingestuft.
Daten zur akuten Toxizität:
- LD50 (Ratte, oral) > 5000 mg/kg (praktisch ungiftig)
- LD50 (Kaninchen, dermal) > 5000 mg/kg (praktisch ungiftig)
- LC50 (Fisch) > 2000 mg/L (24 h) (geringe Toxizität)
- EC50 (Daphnien) > 2000 mg/L (geringe Toxizität)
Daten zur subakuten Toxizität:
- NOEL (Fische): 1000 mg/L
- NOEL (Algen): 2500 mg/L
- Hemmung der Fortpflanzung (Daphnien): 1000 mg/L
Obwohl Cyanursäure eine geringe inhärente Toxizität aufweist, sollten das Einatmen von Staub, Augenkontakt und Verschlucken dennoch vermieden werden. Beachten Sie, dass sie sich über 200 °C zu giftiger Isocyansäure zersetzt.
Referenz
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191

