
Aceton, auch 2-Propanon genannt, ist eine farblose, brennbare Flüssigkeit mit stechendem Geruch und niedriger Viskosität. Es ist das einfachste Keton mit der Formel C3H6O. Aceton ist mit Wasser mischbar, d. h. es lässt sich in jedem Verhältnis leicht mit Wasser mischen.
Es wird hauptsächlich als Lösungsmittel und Zwischenprodukt bei der Synthese verschiedener Chemikalien wie Bisphenol A, Methylmethacrylat, Aldolchemikalien (Diacetonalkohol, Mesityloxid und Methylisobutylketon) und anderen Produkten verwendet.
Historisch gesehen wurde Aceton bis Anfang des 20. Jahrhunderts kommerziell durch Trockendestillation von Calciumacetat hergestellt.
Aceton kommt auch in der Natur vor, beispielsweise in Bäumen und Pflanzen, und wird auch im menschlichen Körper metabolisch hergestellt, hauptsächlich durch den Abbau von Fett. Darüber hinaus ist Aceton leicht biologisch abbaubar.
Inhaltsverzeichnis
1. Herstellung von Aceton
Derzeit ist das Cumol-Verfahren das bedeutendste Verfahren zur Herstellung von Aceton und macht jedes Jahr weltweit eine Produktion von über 6 Millionen Tonnen aus.
Andere Produktionsmethoden tragen weniger als 5 % zur weltweiten Kapazität bei.
1.1. Herstellung von Aceton durch Cumol-Verfahren
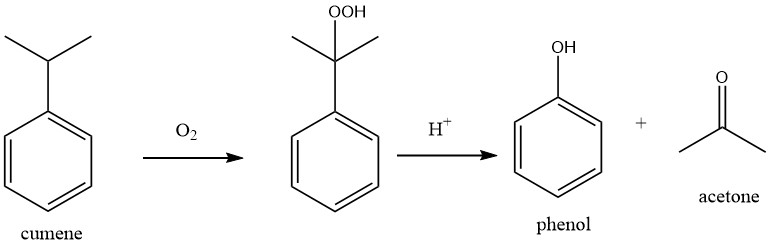
Die Herstellung von Aceton aus Benzol und Propen erfolgt in einem zweistufigen Prozess.
Im ersten Schritt wird die Friedel-Crafts-Alkylierung genutzt, um im Cumol-Verfahren aus Benzol und Propen Cumol herzustellen.
Während dieses Prozesses werden niedrigsiedende Kohlenwasserstoffe wie Propan in der Cumol-Destillationsanlage vom Propen-Einsatzmaterial abgetrennt. Die hochsiedenden Bestandteile, hauptsächlich Polyisopropylbenzole, werden abgetrennt und als Rückstand gesammelt.
Die Benzol- und Propen-Ausgangsmaterialien erzeugen eine kleine Menge Wasser als Verunreinigung.
Im zweiten Schritt des Prozesses, dem sogenannten Hock-Prozess, wird Cumol mit Luftsauerstoff oxidiert, um Cumolhydroperoxid (CHP) zu erzeugen. Unter Verwendung einer starken Mineralsäure als Katalysator wird CHP dann gespalten, um Phenol und Aceton zu ergeben.
Während des Destillationsprozesses werden leichtsiedende Komponenten, vor allem Ketone aus Aceton, abgetrennt, während die in der Oxidations- und Spaltungseinheit gebildeten hochsiedenden Komponenten als Rückstand gesammelt werden.
Beim Phenol-Aceton-Verfahren fällt eine gewisse Menge Prozesswasser an, das in einer biologischen Kläranlage behandelt werden muss.
Die Gesamtreaktion des Prozesses kann als duale Oxidation beschrieben werden, bei der Benzol zu Phenol und Propen zu Aceton oxidiert werden.
1.2. Herstellung von Aceton durch Dehydrierung von 2-Propanol

Die Dehydrierung von 2-Propanol (IPA), das durch Hydratation von Propen entsteht, stellt einen alternativen Weg zur Herstellung von Aceton dar. Es ist bekannt, dass die Dehydrierungsreaktion endotherm ist.
Dieses Verfahren war in den 1970er Jahren für etwa 50–60 % der gesamten Acetonproduktion in den USA verantwortlich.
Derzeit ist jedoch der Cumol-Oxidationsprozess mit Aceton als Nebenprodukt weltweit zur Hauptquelle der Acetonproduktion geworden.
In der Literatur wurden mehrere Katalysatoren für die Dehydrierung von 2-Propanol beschrieben.
Propen ist das primäre Nebenprodukt, das durch die Dehydratisierung des entsprechenden Alkohols entsteht. Neben Propen entstehen auch Aldehyde und Mesityloxid.
Das Dehydrierungsprodukt, das Aldehyde, Mesityloxid, Wasser, 2-Propanol und Aceton enthält, wird einem Waschschritt mit 35 %iger wässriger Natronlauge unterzogen, um die Aldehyde zu entfernen. Anschließend erfolgt eine mehrstufige Destillation zur Entfernung von Leichtsiedern und Aceton aus Alkohol und Wasser.
1.3. Herstellung von Aceton durch Propenoxidation

Das Wacker-Hoechst-Verfahren bietet eine elegante Methode zur Herstellung von Aceton. Bei diesem Verfahren wird Propen mit Luft oder Sauerstoff als Oxidationsmittel bei einer Temperatur von 110–120 °C und einem Druck von 10–14 bar oxidiert.
Dabei kommt ein Katalysatorsystem bestehend aus PdCl2 und CuCl2 zum Einsatz.
Das PdCl2 fungiert als Katalysator, während das CuCl2 Pd° in den zweiwertigen Zustand reoxidiert. Das Kupfer(I)-chlorid kann mit Sauerstoff leicht zu Kupfer(II)-chlorid oxidiert werden.
Die Selektivität dieses Verfahrens für Aceton beträgt etwa 92 %, wobei als Nebenprodukt Propionaldehyd sowie chlorierte Verbindungen wie Monochloraceton und 1,1-Dichloraceton entstehen.
Für die Direktoxidation sind zwei unterschiedliche Verfahren möglich, ähnlich dem Acetaldehyd-Verfahren.
Im ersten Verfahren wird der Katalysator in einer einzigen Stufe mit Propen und Sauerstoff behandelt.
Beim zweiten Verfahren wird der Katalysator in der ersten Stufe mit Propen behandelt und anschließend in der zweiten Stufe mit Sauerstoff regeneriert.
Das zweistufige Verfahren ist bevorzugt, da als Einsatzstoff ein Propen-Propan-Gemisch verwendet werden kann. Propan ist gegenüber Oxidation inert und nimmt nicht an der Reaktion teil.
2. Chemische Reaktionen von Aceton
Reines Aceton reagiert sehr empfindlich auf starke Oxidationsmittel wie Wasserstoffperoxid und organische Peroxide.
Bei Einwirkung von verdünnter Säure und Wasserstoffperoxid entsteht Acetonperoxid-Trimer.
Wenn Aceton mit starken Reduktionsmitteln reagiert, entsteht Hitze und es kann zu Explosionen kommen.
Starkes Alkali löst bei der Reaktion mit Aceton auch eine Wärmeentwicklung aus.
Darüber hinaus kann Aceton gemischt mit Chloroform in Gegenwart von Alkali eine heftige Reaktion hervorrufen.
Die Reaktivität von Aceton wird durch die CO-Bindung bestimmt. Das Sauerstoffatom neigt dazu, Elektronen der Doppelbindung anzuziehen, wie in der mesomeren Struktur der Carbonylgruppe gezeigt. Daher ist der häufigste Carbonylreaktionsmechanismus ein nukleophiler Angriff auf das C-Atom der Carbonylgruppe.
Die Protonierung des Sauerstoffatoms geht häufig mit einem nukleophilen Angriff einher.
Die Reaktion von Aceton mit HCN in Gegenwart einer Base wie KOH führt zur Bildung von Acetoncyanhydrin, wobei das von HCN und KOH abgeleitete Cyanidion für den nukleophilen Angriff verantwortlich ist.
Säuren katalysieren die Addition schwacher Nukleophiler.
Durch die Protonierung des Sauerstoffatoms der Carbonylgruppe entsteht ein Carbokation, das vom Nukleophil leichter angegriffen werden kann. Ein Beispiel für eine solche Reaktion ist die Bildung eines Halbketals oder Ketals aus der Reaktion eines Alkohols mit Aceton.
In der Literatur wurde über verschiedene nukleophile Reaktionen mit Aceton berichtet, beispielsweise über die Bildung tertiärer Alkohole durch Reaktion mit Grignard-Reagenzien (RmgX), 2-Propanol mit LiAlH4 oder NaBH4 sowie Iminen mit primären Aminen, Oximen mit Hydroxylamin und Phenylhydrazonen mit Hydrazin .
Das α-Wasserstoffatom zur Carbonylgruppe in Aceton ist sauer. Das Vorhandensein der Carbonylgruppe verstärkt die Elektronenpolarisierung, was zu einem elektropositiveren Wasserstoffatom führt. Das resultierende Anion wird durch mesomere Verschiebung der negativen Ladung zwischen dem Kohlenstoffatom und dem Carbonylsauerstoffatom stabilisiert.
Durch die basenkatalysierte Aldolreaktion zweier Acetonmoleküle in Gegenwart von Alkali entsteht Diacetonalkohol.
3. Verwendung von Aceton
Aceton dient als wichtiges chemisches Zwischenprodukt bei der Herstellung mehrerer Chemikalien, darunter Methylmethacrylat (MMA), Bisphenol A und Aldolverbindungen wie Diacetonalkohol (DAA), Mesityloxid (MOX) und Methylisobutylketon (MIBK).
Sein Haupteinsatzgebiet in der chemischen Industrie ist die Herstellung von Acetoncyanhydrin.
Abgesehen von seiner Verwendung als chemisches Zwischenprodukt ist Aceton ein vielseitiges Lösungsmittel mit zahlreichen Anwendungen. Die weltweite jährliche Produktion von Aceton wird auf über 6 Millionen Tonnen geschätzt.
Im Jahr 2010 machten direkte Lösungsmittelanwendungen 29 % des Acetonverbrauchs aus, gefolgt von Acetoncyanhydrin/MMA mit 24 % und Bisphenol A mit 22 %.
Referenz
- Acetone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_079.pub4


