
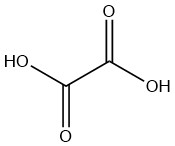
Oxalsäure, eine gesättigte Dicarbonsäure, gilt als die einfachste ihrer Art. Es kommt natürlicherweise in Form eines Dihydrats vor. Auch bei industrieller Herstellung muss aus dem Dihydrat eine wasserfreie Verbindung synthetisiert werden.
Diese Säure ist im Pflanzen- und Tierreich weit verbreitet, fast immer in Form ihrer Salze, und findet aufgrund ihrer chemischen Eigenschaften vielfältige industrielle Anwendungen.
Bemerkenswert ist, dass Oxalsäure seit langem bekannt ist und erstmals 1769 von WIEGLEB im Kaliumsalz von Sauerampfer identifiziert wurde.
Inhaltsverzeichnis
1. Herstellung von Oxalsäure
Zur Herstellung von Oxalsäure gibt es zahlreiche industrielle Verfahren, die von verschiedenen Unternehmen umgesetzt wurden und auch heute noch angewendet werden.
Im Allgemeinen werden bei der Herstellung von Oxalsäure nur drei Arten von Verbindungen als Rohstoffe verwendet. Dazu gehören Kohlenhydrate (wie Melasse und Ethylenglykol), Olefine und Kohlenmonoxid.
Bei allen industriellen Prozessen fällt Oxalsäure als kristallines Dihydrat an. In den folgenden Abschnitten werden vier Methoden beschrieben, die derzeit industriell eingesetzt werden. Drei dieser Methoden basieren auf der Oxidation von Salpetersäure, und eine ist eine Synthese unter Verwendung von Kohlenmonoxid.
1.1. Kohlenhydratoxidation
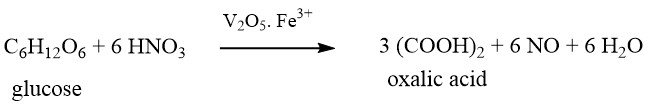
Diese Methode, die älteste der chemischen Herstellungen, wurde erstmals vor mehr als 200 Jahren im Jahr 1776 von SCHEELE entdeckt. Er oxidierte Zucker mit konzentrierter Salpetersäure zu Oxalsäure.
Industrielle Bedeutung erlangte dieses Verfahren jedoch erst um 1940, als die bei der Reaktion entstehenden Stickoxide zurückgewonnen und recycelt werden konnten.
In Deutschland ist die I.G. Farben produzierte mit dieser Methode bis 1944 jährlich 2000 Tonnen Oxalsäure. Dieses Verfahren wird derzeit in Brasilien, China und mehreren osteuropäischen Ländern angewendet.
Zu den in diesem Verfahren verwendeten Rohstoffen gehören Zucker, Glukose, Fruktose, Maisstärke, Weizenstärke, wiedergewonnene Stärke, Kartoffelstärke, Maiskolben, Tapioka und Melasse.
Die Auswahl der Ausgangsmaterialien für die Herstellung von Oxalsäure hängt von der Verfügbarkeit, den Kosten und der Optimierung des Reaktionsprozesses ab.
Unterschiedliche Rohstoffe können zu unterschiedlichen Erträgen und zur Bildung von Schaum, Fetten und Schleim führen, die entsprechend gehandhabt werden müssen.
Melasse und andere landwirtschaftliche Abfälle erfreuen sich aufgrund ihrer geringen Kosten und der Umweltvorteile ihrer Verwendung zunehmender Beliebtheit als Rohstoffe.
Melasse, ein Nebenprodukt der Zuckerraffinierung, enthält stickstoffhaltige Verbindungen, die bei der Salpetersäureoxidation größtenteils eliminiert werden, obwohl sie während der Reaktion zu übermäßiger Schaumbildung führen.
Bei der Verwendung stärkebasierter Materialien als Rohstoffe müssen diese vor der Oxidation zunächst in einem separaten Batch-Schritt zu Glucose hydrolysiert werden.
Die hydrolysierte Glucoselösung wird in einem Reaktor mit Schwefelsäure, Vanadiumpentoxid (0,001–0,05 Gew.-%) und Eisen(III)sulfat (0,39–0,8 Gew.-%) vermischt.
Anschließend wird unter kräftigem Rühren langsam Salpetersäure (65 %) in einem streng kontrollierten Temperaturbereich um 70 °C zugegeben, der je nach Rohmaterial variiert.
Die Reaktion ist stark exotherm und muss gut gekühlt werden.
Gleichzeitig wird dem Reaktor Luft zugeführt, um die Reaktion zu unterstützen und NO und andere Stickoxide niedriger Oxidationszahl zu entfernen. Die ausgestoßenen Stickoxide werden in einer Adsorptionsanlage gesammelt und nach der Oxidation recycelt.
Die rohe Oxalsäure wird durch Abkühlen und Zentrifugieren der Reaktionsmischung, gefolgt von Auflösung in heißem Wasser, Fettabtrennung, Umkristallisation, einer zweiten Zentrifugation und Trocknung gewonnen, um Oxalsäuredihydrat mit einer Reinheit von mehr als 99 % zu erhalten.
1.2. Oxidation von Ethylenglykol
Die Oxidation von Ethylenglykol mit Salpetersäure ist ein einstufiger Prozess. Es wird eine oxidierende Mischung aus 30–40 % Schwefelsäure und 20–25 % Salpetersäure verwendet und die Reaktion bei 50–70 °C und Atmosphärendruck in Gegenwart von Vanadiumpentoxid und Eisen(III)-Salzen durchgeführt. Das bei dieser Reaktion entstehende Nebenprodukt ist lediglich CO2.
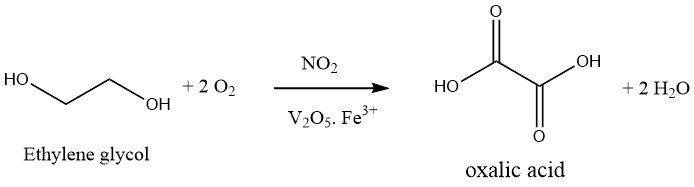
Der Prozess der Oxalsäureproduktion wurde von der Mitsubishi Gas Company erheblich verbessert, was dazu führte, dass Japan in erster Linie auf diese Methode vertraut.
Die verbesserte Technik erfordert den Einsatz eines Druckreaktors, der bei etwa 10 bar arbeitet. Salpetersäure (ca. 60 %) sowie Schwefelsäure (falls zutreffend) werden unter Druck stehendem Sauerstoff ausgesetzt, während eine Temperatur von 80 °C aufrechterhalten wird.
Anschließend wird kontinuierlich Ethylenglykol eingeleitet und durch Sauerstoffzugabe Temperatur und Druck der Reaktion aufrechterhalten. Eine wirksame Kühlung ist erforderlich, um zu verhindern, dass die exotherme Reaktion über 50–70 °C ansteigt.
Die Ausbeute an Oxalsäure, bezogen auf Ethylenglykol, liegt zwischen 90 und 94 % des theoretischen Maximums. Bemerkenswert ist, dass der Großteil der eingesetzten Salpetersäure zurückgewonnen werden kann. Dies deutet darauf hin, dass Stickoxide und Salpetersäure lediglich als Katalysatoren im Oxidationsprozess wirken und Sauerstoff als primäres Oxidationsmittel dient.
Auch alternative Ausgangsmaterialien wie Propylenglykol, Acetaldehyd oder Glykolsäure können verwendet werden. Zur Verbesserung der Effizienz werden Vanadiumverbindungen (0,001 – 0,1 Gew.-%) als Promotoren empfohlen. Es können auch Initiatoren wie Natriumnitrit, Ameisensäure oder Formaldehyd eingesetzt werden.
1.3. Oxidation von Propen
Die Herstellung von Oxalsäure durch die Reaktion von Propen und Salpetersäure ist nach der Kohlenhydratoxidation der zweitwichtigste industrielle Prozess.
Im Jahr 1978 entfielen auf diese Methode 65.000 t/a der weltweiten Oxalsäureproduktion. Nebenprodukte der petrochemischen Raffinerie, nämlich reines Propen oder propenreiche Fraktionen, dienen als mögliche Ausgangsstoffe für diese Reaktion.
Rhone-Poulenc, ein in Frankreich ansässiges Unternehmen, verbesserte den Prozess erheblich, indem es Fortschritte in der Technik und Konstruktion einführte und gleichzeitig die Reaktionsbedingungen strikt einhielt.
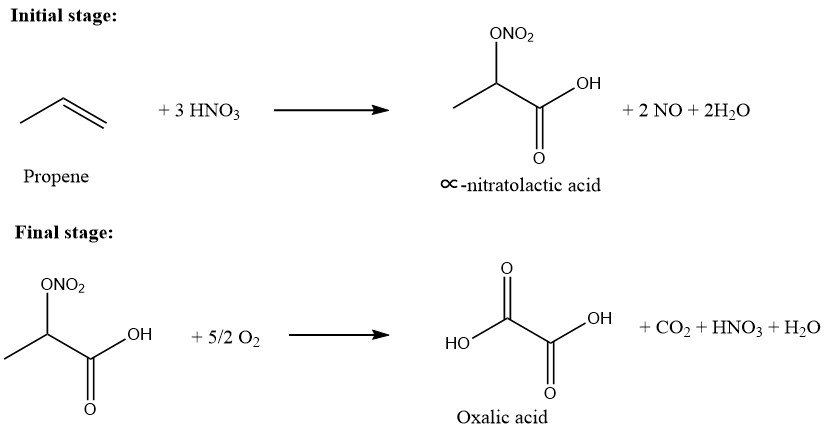
Der Prozess der Propenoxidation zu Oxalsäure umfasst zwei Hauptstufen.
Im ersten Schritt wird Propen in eine Salpetersäurelösung (50–75 Gew.-%) bei einer Temperatur im Bereich von 10–40 °C eingeleitet. Das Molverhältnis von Propen zu Salpetersäure wird zwischen 0,01/1,0 und 0,5/1,0 gehalten. Dieser Schritt ergibt wasserlösliche ∝-Nitratomilchsäure und Milchsäure-Zwischenprodukte.
In der zweiten Stufe wird Sauerstoff in die Lösung, die die teilweise oxidierten Produkte enthält, in Gegenwart eines Katalysators bei einer Temperatur im Bereich von 45–100 °C eingeleitet.
Die resultierende Oxalsäure wird anschließend kristallisiert, filtriert und gewonnen. Die Gesamtausbeute, bezogen auf Propen, beträgt ca. 90 %, der Propenumsatz liegt bei nahezu 100 %.
Im zweiten Reaktor erzeugte Stickoxide werden eliminiert und zurückgewonnen. Der Verbrauch an Salpetersäure beträgt bei diesem Verfahren 1,2 kg pro kg erzeugtem Oxalsäure-Dihydrat.
Zur Verbesserung der Ausbeute werden Katalysatoren zugesetzt, die Salze oder Verbindungen von Fe, Al, Cr, Sn, Bi oder I enthalten. Bei diesem Verfahren werden Chrom(III)-nitrat, Eisen(III)-nitrat oder Zinn(II)-chlorid in Mengen von 0,4–0,5 Gew.-% (bezogen auf das Metall) eingesetzt und in 65 %iger Salpetersäure gelöst, um die Effizienz zu steigern.
1.4. Herstellung aus Kohlenmonoxid
Ube Industries hat das neueste Verfahren zur industriellen Herstellung von Oxalsäure entwickelt, das zwei Schritte umfasst. In der ersten Stufe werden CO und ein niederer Alkohol unter Druck und in Gegenwart eines Katalysators zum entsprechenden Diester der Oxalsäure umgesetzt.
Im zweiten Schritt führt die Hydrolyse dieses Diesters zur Bildung von Oxalsäure und dem ursprünglichen Alkohol, der recycelt wird. Die Reaktion wird durch Palladium auf Aktivkohle und Alkylnitriten katalysiert und bei einem Druck von 10–11 MPa durchgeführt. Der bevorzugte Alkohol und das Lösungsmittel ist n-Butanol.
Während dieses Verfahren von der Verwendung kostengünstiger Ausgangsmaterialien profitiert, weist es aufgrund der viel höheren Kapitalinvestitionen (aufgrund der Hochdruckanforderungen) und der Betriebskosten erhebliche Nachteile auf.
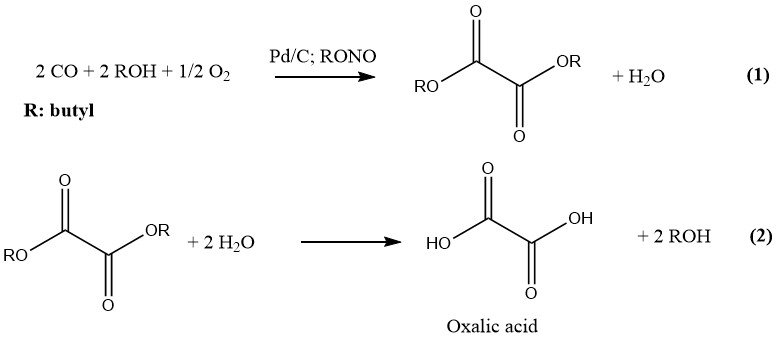
Butylnitrit und Methylnitrit sind aufgrund ihrer Eignung zur Herstellung von Oxalsäure die bevorzugten Alkylnitrite für industrielle Zwecke. In einer 1978 errichteten Anlage wurden 6000 t/a Butylnitrit zur Herstellung von Oxalsäure eingesetzt.
Butylnitrit bietet in diesem Verfahren mehrere Vorteile, darunter seine Funktion als Reaktionskomponente und Dehydratisierungsmittel. Der höhere Siedepunkt von Butylnitrit im Vergleich zu Wasser und Butylnitrit ermöglicht die Entfernung des als azeotrope Mischung gebildeten Wassers, sodass der größte Teil des Butylnitrits im System verbleibt.
Das zurückgewonnene Butylnitrit kann nach der Trennung wiederverwendet werden. Butylnitrit wird schließlich zu Butanol hydrolysiert, das durch Phasentrennung leicht von der Oxalsäurelösung abgetrennt werden kann.
Die Reaktion zur Herstellung von Oxalsäure unter Verwendung von Butylnitrit und einem Palladiumkatalysator findet in einem Reaktionsturm statt. Eine Kreislaufflüssigkeit, die Butylnitrit, Butanol und den Palladiumkatalysator enthält, sowie ein Kreislaufgas, das Kohlenmonoxid und Sauerstoff enthält, werden unter Druck gesetzt und dem Turm zugeführt.
Die exotherme Reaktion zwischen Butylnitrit und Kohlenmonoxid führt zur Bildung von Dibutyloxalat und gleichzeitiger Regenerierung von Butylnitrit. Die Reaktion wird bei einer Temperatur von 90 – 100 °C und einem Druck von 10 –11 MPa durchgeführt, um die Selektivität für Dibutyloxalat zu optimieren.
Die Sauerstoffkonzentration im Reaktionsturm wird durch die Gaszirkulation unter der Explosionsgrenze gehalten, was auch die Kohlenmonoxidausnutzung und die Gas-Flüssigkeits-Kontaktrate verbessert.
Die aus dem Turm freigesetzte Lösung wird schnell verdampft, um das als Nebenprodukt gebildete Kohlendioxidgas zu verdampfen. Das bei der Reaktion gebildete Wasser wird durch azeotrope Destillation mit Butylnitrit entfernt und der größte Teil der Lösung in den Reaktionsturm zurückgeführt.
Ein Teil der Lösung wird zu reinem Dibutyloxalat weiterverarbeitet, das nach der Abtrennung von Katalysatoren, Butylnitrit und Butanol erhalten wird.
Der Palladiumkatalysator, Butylnitrit und Butanol werden zurückgewonnen und in die Umlaufflüssigkeit zurückgeführt, die auch mit Butanol und Salpetersäure ergänzt wird. Die Umlaufflüssigkeit wird dann unter Druck gesetzt und dem Reaktionsturm zurückgeführt.
Das raffinierte Dibutyloxalat wird mit der Mutterlauge aus der Oxalsäurekristallisation vermischt und bei etwa 80 °C zu Oxalsäure und Butanol hydrolysiert.
Die Oxalsäurelösung und Butanol werden durch Phasentrennung getrennt. Aus der Oxalsäurelösung wird dann Oxalsäure-Dihydrat kristallisiert und nach der Raffination Butanol in den Prozess zurückgeführt.
2. Chemische Reaktionen von Oxalsäure
Das Verhalten von Oxalsäure ist aufgrund der Wechselwirkung zwischen benachbarten Carboxylatgruppen einzigartig, was zu einer erhöhten Dissoziationskonstante und einer einfacheren Decarboxylierung führt.
Beim schnellen Erhitzen auf 100 °C zerfällt Oxalsäure in Kohlenmonoxid, Kohlendioxid und Wasser, wobei Ameisensäure als isolierbares Zwischenprodukt dient.
Die Zersetzung von Oxalsäure in wässrigen Lösungen kann durch Licht und in größerem Maße durch γ- oder Röntgenstrahlen induziert werden, was zu Kohlenmonoxid, Kohlendioxid, Ameisensäure und gelegentlich Wasserstoff führt. Schwermetallsalze wie Uranylsalze katalysieren diese Zersetzung.
Oxalsäure kann kein intramolekulares Anhydrid bilden, kann jedoch beim Erhitzen auf über 190 °C oder beim Erwärmen in konzentrierter Schwefel- oder Phosphorsäure in Kohlenmonoxid, Kohlendioxid und Wasser zersetzt werden. Diese Zersetzung ist nicht exotherm.
Die reduzierenden Eigenschaften der Oxalsäure bilden die Grundlage für ihre praktischen Anwendungen, da sie durch eine Vielzahl von Oxidationsmitteln, darunter Luft und Salze von Schwermetallen, leicht zu den harmlosen Endprodukten Kohlendioxid und Wasser oxidiert werden kann.
Oxalsäure lässt sich leicht verestern, wobei saure Monoester oder neutrale Diester als Zwischenprodukte in chemischen Synthesen entstehen. Diese Ester reagieren leicht mit Wasser, Ammoniak oder Aminen unter Bildung der entsprechenden Acylderivate.
Auch die Metallsalze der Oxalsäure weisen wichtige chemische Eigenschaften auf und liegen entweder als saure oder neutrale Salze vor. Alkalimetall- und Eisen(III)-Salze sind in Wasser gut löslich, während alle anderen Salze schwer löslich sind.
Die nahezu vollständige Unlöslichkeit von Erdalkalisalzen, insbesondere Calciumoxalat, findet Anwendung in der quantitativen Analyse. Beim Erhitzen verlieren diese Metallsalze Kohlenmonoxid und einige leichter abbaubare Salze verlieren auch Kohlendioxid. Alkali- und Erdalkalisalze bilden unter diesen Bedingungen Carbonate.
Metallsalze von Mangan, Zink und Zinn bilden Oxide, während Eisen-, Cadmium-, Quecksilber- und Kupfersalze Mischungen aus Oxiden und Metallen bilden. Nickel-, Kobalt- und Silbersalze liefern reine Metalle. Die wasserfreie Fusion von Oxalaten mit Alkali ergibt Carbonate und Wasserstoff.
3. Verwendung von Oxalsäure
Im Hinblick auf ihre Anwendungen als synthetisches Zwischenprodukt wurden Oxalsäure oder ihre Salze auch hauptsächlich als Reduktionsmittel, die harmlose Endprodukte aus Kohlendioxid und Wasser erzeugen, sowie als Fällungsmittel für Calciumionen oder als Komplexbildner für die Salze eingesetzt von Schwermetallen.
3.1 Metallbehandlung
Schwermetalle, insbesondere Eisen, bilden mit Natrium-, Kalium- oder Ammoniumoxalaten lösliche Doppelsalze.
Eisen(III)oxalat ist das einzige gut lösliche Schwermetallsalz. Oxalsäuresalze werden daher zur Rostentfernung aus Kühlsystemen (z. B. Autokühlern), Kesseln oder Stahlplatten vor der Phosphatierung eingesetzt.
Sie können auch zum Entfernen von Eisenadern aus Marmor, als Bestandteil von Metallreinigern mit Rostschutz, insbesondere für Kupfer, Silber oder Aluminium, beim Eloxieren von Aluminium und zur Herstellung von sehr harten, abrieb- und korrosionsschützenden Mitteln verwendet werden Beschichtungen, bei denen durch den Einsatz von Additiven dem Aluminium unterschiedliche Oberflächenfarben verliehen werden.
Oxalsäure wird auch in Reinigungsmaterialien für elektronische Geräte und als Beschichtungen zum Schutz von Edelstahl, Nickellegierungen, Chrom, legierten Stählen und Titan eingesetzt.
3.2 Textilbehandlung
Oxalsäure wird als Beizmittel beim Bedrucken und Färben von Wolle und Baumwolle verwendet. Es wird als Abziehmittel für Wollfarben zur Erzielung besonderer Mustereffekte, als Hilfsmittel im Indigo-Ätzätzdruck und in der Küpenfärbung als Reduktionsmittel für Kaliumdichromat eingesetzt.
In Wäschereien wird Oxalsäure zur Entfernung von Rostflecken und zur Neutralisierung von Alkalität eingesetzt, außerdem hat sie antibakterielle Eigenschaften.
Oxalsäure kann als Katalysator zur Vernetzung von Textilausrüstungsmitteln beim Dauerpressen von Zellulosegeweben und zur Flammschutzausrüstung eingesetzt werden.
3.3 Bleichmittel
Oxalsäure wird beim Gerben und Bleichen von Leder sowie beim Bleichen von Kork, Holz (insbesondere furniertem Holz), Stroh, Rohr, Federn sowie natürlichen und synthetischen Wachsen verwendet.
Der Großteil der Oxalsäure wird zum Bleichen von Faserholz verwendet.
Bei der Lederverarbeitung wird anstelle von Natriumdithionit Oxalsäure zum Aufhellen verwendet.
Referenz
- Oxalic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a18_247.pub2

