Butanol, auch bekannt als n-Butanol oder Butan-1-ol, ist ein primärer Alkohol mit der chemischen Formel C4H9OH. Es ist eine farblose Flüssigkeit mit einem starken, unangenehmen Geruch, ähnlich dem von verbranntem Whisky.
Butanol liegt natürlicherweise in gebundener Form vor und ist in durch Fermentation gewonnenen Fuselölen konzentriert. Die industrielle Produktion begann 1912 mit der Entdeckung von Clostridium acetobutylicum Weizmann, einem Bakterium, das Kohlenhydrate hauptsächlich in Aceton und 1-Butanol umwandelt.
Die steigende Nachfrage nach 1-Butanol trieb die Entwicklung neuartiger Produktionsmethoden voran, darunter:
- Hydrierung von Crotonaldehyd: Gebildet durch Acetaldehyd-Aldolisierung.
- Reppe-Synthese (Propencarbonylierung).
- Hydrierung von n-Butyraldehyd: Leicht erhältlich durch Propen-Hydroformylierung, die derzeit vorherrschende Methode.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von 1-Butanol
n-Butanol ist eine farblose Flüssigkeit mit charakteristischem Geruch. Seine Dämpfe reizen die Schleimhäute und wirken in hohen Konzentrationen narkotisch. Es ist mit üblichen organischen Lösungsmitteln vollständig mischbar.
Tabelle 1 fasst die wichtigsten charakteristischen physikalischen Eigenschaften von n-Butanol zusammen.
| Eigenschaft | Wert |
|---|---|
| Molmasse | 74,12 g/mol |
| Schmelzpunkt | -89,3 °C |
| Siedepunkt | 117,7 °C |
| Dichte (20°C) | 0,8098 g/cm³ |
| Brechungsindex (20°C) | 1,3991 |
| Viskosität (20°C) | 3,0 mPa·s |
| Spezifische Wärme (30–80°C) | 2,437 J g⁻¹ K⁻¹ |
| Verdampfungswärme | 591,64 J/g |
| Schmelzwärme | 125,2 J/g |
| Verbrennungswärme | 36,111 kJ/g |
| Kritischer Druck | 44,2 hPa |
| Kritische Temperatur | 289 °C |
| Oberflächenspannung (Raumtemperatur) | 22,3 mN/m |
| Dielektrizitätskonstante (Raumtemperatur) | 17,8 |
| Verdampfungszahl (Ether = 1) | 33 |
| Löslichkeit in Wasser (20 °C, Gew.-%) | 7,7 Gew.-% |
| Löslichkeit in Wasser (30 °C, Gew.-%) | 7,08 Gew.-% |
| Löslichkeit von Wasser in 1-Butanol (20 °C, Gew.-%) | 20 Gew.-% |
| Löslichkeit von Wasser in 1-Butanol (30 °C, Gew.-%) | 20,62 Gew.-% |
| Flammpunkt | 34 °C |
| Zündgrenzen in Luft, Vol% | 1,4–11,3 |
| Zündtemperatur | 380 °C |
2. Chemische Eigenschaften von 1-Butanol
Als primärer Alkohol ist 1-Butanol eine reaktive Chemikalie, die als Ausgangsstoff für eine Vielzahl von Reaktionen dient.
2.1. Dehydratisierung von 1-Butanol
1-Butanol kann unter Verwendung von Katalysatoren wie γ-Al2O3 bei hohen Temperaturen (300–350 °C) zu einer Mischung aus Butenen (1-Buten, cis-2-Buten und trans-2-Buten) dehydriert werden. Bei niedrigerer Temperatur und in Gegenwart von Dehydratisierungskatalysatoren entsteht Dibutylether.

2.2. Oxidation von 1-Butanol
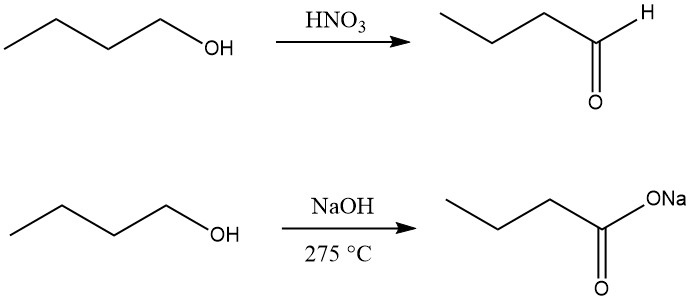
1-Butanol kann mit Oxidationsmitteln wie Mangan(IV)-oxid in Schwefelsäure und Salpetersäure zu 1-Butanal (Butanal) dehydriert werden , Chromsäure oder Selendioxid bei niedriger Temperatur oder nur mit geeigneten Katalysatoren bei hohen Temperaturen.
Die Oxidation von n-Butanol zu Carbonsäure kann durch Reaktion mit Natriumhydroxid bei 275 °C unter Bildung des Natriumsalzes erfolgen Buttersäure zusammen mit Wasserstoff und 2-Ethylhexanol.
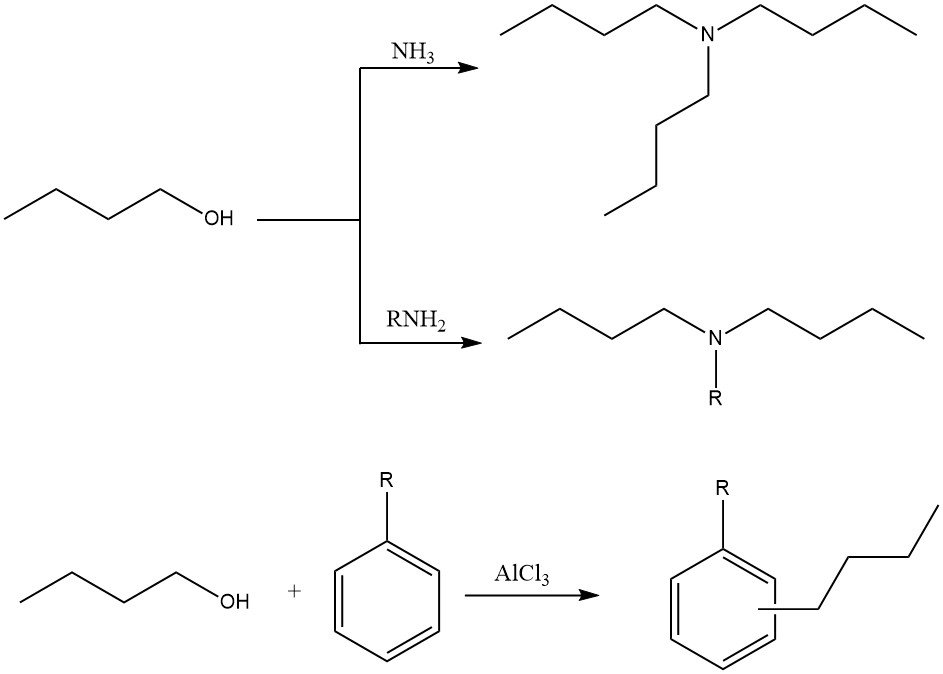
2.3. Alkylierung
1-Butanol kann in verschiedenen Alkylierungsreaktionen zur Herstellung von N-Alkyl-, N,N-Dialkyl- oder N,N,N-Trialkylaminen mit Ammoniak und Aminen verwendet werden. Es kann auch bei der Ring-Alkylierung aromatischer Kohlenwasserstoffe mit Friedel-Crafts-Katalysatoren verwendet werden.
2.4. Veresterung von 1-Butanol
1-Butanol reagiert mit anorganischen und organischen Säuren unter Bildung von Butylestern, typischerweise katalysiert durch Säuren. Es können auch Ester mit Säurechloriden und Säureanhydriden hergestellt werden.
3. Herstellung von 1-Butanol
Unter den verschiedenen Wegen zur Herstellung von 1-Butanol dominieren die folgenden drei die Industrie:
- Propenhydroformylierung (Oxo-Synthese)
- Reppe-Synthese
- Hydrierung von Crotonaldehyd
3.1. Herstellung von 1-Butanol durch Oxo-Synthese
Die primäre Methode zur Herstellung von 1-Butanol ist die Hydroformylierung von Propen, gefolgt von der Hydrierung der resultierenden Aldehyde. Bei der Hydroformylierung werden Kohlenmonoxid und Wasserstoff in der flüssigen Phase unter Verwendung von Katalysatoren wie Hydrocarbonylen oder substituierten Hydrocarbonylen von Co, Rh oder Ru an die Doppelbindung von Propen addiert.
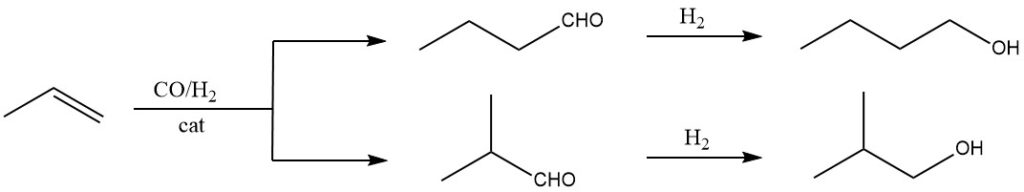
Dieser erste Schritt ergibt Aldehyde mit einem zusätzlichen C-Atom im Vergleich zu den ursprünglichen Olefinen. Typischerweise werden Isomerengemische von Aldehyden erhalten, beispielsweise 1-Butanal und 2-Methylpropanal im Fall von Propen.
Es gibt verschiedene Hydroformylierungsverfahren mit unterschiedlichen Reaktionsbedingungen (Druck, Temperatur) und Katalysatorsystemen.
Die traditionelle Hochdruckmethode, die bis in die frühen 1970er Jahre existierte, arbeitet bei Drücken von 20–30 × 106 Pa CO/H2 und Temperaturen von 100–180 °C und verwendet Co als Katalysator. Dieser Prozess ergibt etwa 75 % 1-Butanol und 25 % 2-Methyl-1-propanol.
Jüngste Fortschritte haben zu neuartigen Prozessvarianten geführt. Methoden mit niedrigerem Druck (1–5 × 106 Pa) unter Verwendung modifizierter Rh-Katalysatoren führen zu Isomerenverhältnissen von etwa 92:8 oder 95:5 für 1-Butanol zu 2-Methyl-1-propanol. Allerdings kann durch den Einsatz von unmodifiziertem Rh der Anteil an 2-Methyl-1-propanol auf etwa 50 % erhöht werden.
Anschließend erfolgt die katalytische Hydrierung von Aldehyden, die zur Bildung der entsprechenden Alkohole führt. Zu den größten Butanolproduzenten gehörten im Jahr 2010 BASF, Oxea Group und die Dow Chemical Company.
3.2. Herstellung von 1-Butanol nach dem Reppe-Verfahren
Eine alternative Methode zur Herstellung von 1-Butanol ist die Carbonylierung von Propen, eine Technik, die 1942 von REPPE erfunden wurde. Bei diesem Verfahren reagieren Olefine, Kohlenmonoxid und Wasser unter Druck in Gegenwart eines Katalysators wie dem tertiären Ammoniumsalz aus mehrkernigen Eisencarbonylhydriden.

Bei diesem Verfahren kommen andere Reaktionsbedingungen zum Einsatz als bei der herkömmlichen Co-katalysierten Hydroformylierung. Bei niedrigerer Temperatur (ca. 100 °C) und reduziertem Druck (0,5–2 × 106 Pa) wird Butanol direkt aus dem Propen gebildet.
Ähnlich wie bei der Oxosynthese kann Kohlenmonoxid an beide C-Atome der Doppelbindung angelagert werden. Folglich erhält man bei Verwendung von Propen als Ausgangsmaterial 1-Butanol und 2-Methyl-1-propanol im Verhältnis 86:14.
Der verwendete Katalysator, Carbonyltriferrat, ist sowohl gegenüber Luft als auch gegenüber erhöhten Temperaturen empfindlich. In Gegenwart von Wasser und CO2 zerfällt es zu Eisencarbonat.
Um ausreichende Reaktionsgeschwindigkeiten aufrechtzuerhalten, muss der Katalysator in Konzentrationen von etwa 10 % in der Reaktionslösung vorhanden sein, eine Bedingung, die durch die Verwendung von Lösungsmitteln wie N-Alkylpyrrolidin erreicht wird.
Trotz günstiger n-iso-Verhältnisse in den resultierenden Produkten und milderen Reaktionsbedingungen hat das Reppe-Verfahren aufgrund der erhöhten Kosten der beteiligten Prozesstechnologie nicht den gleichen Erfolg erzielt wie die Hydroformylierung von Propen mit Co-Katalysatoren.
3.3. Herstellung von 1-Butanol durch Hydrierung von Crotonaldehyd
Bis zur Mitte des 20. Jahrhunderts war die Herstellung von 1-Butanol aus Crotonaldehyd die bevorzugte Methode, die jedoch aufgrund der Entwicklung wettbewerbsfähigerer Verfahren an Bedeutung verloren hat.

Dieser Prozess umfasste mehrstufige Reaktionen wie folgt:
- Aldolkondensation: Acetaldehyd unterliegt einer Aldolkondensation bei Umgebungstemperatur und -druck, wodurch Acetaldol mit einer Selektivität von ca. 95 % und einer Umwandlung von ca. 60 % entsteht. Nicht umgesetzter Acetaldehyd kann zur weiteren Verwendung zurückgewonnen werden.
- Dehydrierung: Die Ansäuerung von Acetaldol mit Essigsäure oder Phosphorsäure fördert die Wassereliminierung und die Bildung von Crotonaldehyd . Durch diesen Schritt wird eine nahezu quantitative Ausbeute an Crotonaldehyd als Primärdestillat erreicht.
- Hydrierung: Verschiedene Gas- und Flüssigphasenprozesse nutzen Kupferkatalysatoren für die effiziente Hydrierung von Crotonaldehyd zu 1-Butanol. Eine Ausbeute von ~1000 kg 1-Butanol pro 1350 kg Acetaldehyd ist erreichbar.
Die Wirtschaftlichkeit dieser Route hängt von den Rohstoffkosten ab. Da Rohöl, der Hauptrohstoff für die Oxo-Synthese, knapp und teuer wird, könnte sich aus Fermentation gewonnenes Ethanol als wettbewerbsfähige Alternative erweisen.
Der Überfluss und die Erschwinglichkeit von Biomasse in tropischen Ländern und Entwicklungsländern ohne Ölreserven machen diese Route besonders attraktiv. Ethanol kann zu Acetaldehyd dehydriert werden und dient als Ausgangsstoff für diesen Prozess.
3.4. Herstellung von 1-Butanol durch Fermentation von Biomasse
Die Herstellung von 1-Butanol durch Biomassefermentation war ein bedeutender industrieller Prozess, der das 20. Jahrhundert dominierte. Nach der Isolierung von Clostridium acetobutylicum durch Chaim Weizmann im Jahr 1914 wurde die sogenannte ABE-Fermentation (Aceton, Butanol, Ethanol) zum zweitgrößten biotechnologischen Verfahren, nur übertroffen von der Ethanol-Fermentation.
Andere Butanol produzierende Clostridium-Stämme, wie C. beijerinckii und C. saccharoperbutylacetonicum, tauchten ebenfalls auf und wurden verwendet.
Bei der klassischen ABE-Fermentation wurde ein 40–60 Stunden dauernder Batch-Prozess eingesetzt, bei dem stärkehaltige Biomasse wie Maisbrei oder Melasse als Substrate verwendet wurden. Die Produkte wurden gewonnen und durch Destillation fraktioniert, was eine Gesamtausbeute von 25–33 kg/100 kg Substrat ergab.
Die Lösungsmittelkonzentrationen erreichten 12–20 g/L, mit einer maximalen Butanolkonzentration von 14 g/L. Allerdings führten niedrige Rohölpreise und hohe Substratkosten im späten 20. Jahrhundert zu einem Rückgang der industriellen ABE-Fermentation, sodass die letzten Anlagen in Südafrika und China 2004 geschlossen wurden.
Das zunehmende Interesse an Biokraftstoffen und Chemikalien führte jedoch zu einem kommerziellen Interesse an der ABE-Fermentation, insbesondere für Butanol. In Brasilien und China sind neue Fermentationsanlagen entstanden, während Unternehmen wie Gevo und Butamax aktiv an der Butanolproduktion aus erneuerbaren Rohstoffen forschen.
Forschungsbemühungen konzentrieren sich auf die Maximierung der Butanolausbeute als einziges Fermentationsprodukt, die Verbesserung der Butanoltoleranz des Produktionsorganismus und die Erforschung alternativer Non-Food-Substrate wie Cellulose und Hemicellulose.
Theoretisch kann C. acetobutylicum aufgrund seiner Fermentationswege 0,41 g Butanol pro Gramm Glucose erzeugen. Forscher untersuchen verbesserte Stämme und Wachstumsbedingungen, um das Butanol/Aceton-Verhältnis zu steigern, indem sie Stoffwechseltechnik und Gentransfer nutzen, um die Butanolproduktion in anderen Organismen wie E. coli zu steigern.
Darüber hinaus erfordert die Überwindung der geringen Butanoltoleranz von C. acetobutylicum eine Stammauswahl und Fermentationsmodifikationen wie Gasstripping oder Absorption.
Der bisherige Erfolg und das jüngste Wiederaufleben der ABE-Fermentation unterstreichen ihr Potenzial für eine nachhaltige Butanolproduktion. Laufende Forschung zur Optimierung von Erträgen, Toleranz und Substratnutzung ebnet den Weg für eine erneuerte biobasierte Butanolindustrie.
4. Verwendung von 1-Butanol
In den USA werden etwa 85 % 1-Butanol hauptsächlich für Oberflächenbeschichtungen verwendet. Es dient direkt als Lösungsmittel für Lacke oder wird in abgeleitete Lösungsmittel oder Monomere umgewandelt. Zur Herstellung von Nitrozelluloselacken wird es mit Toluol, Ethanol oder bestimmten Estern vermischt und allein als Verdünner verwendet.
1-Butanol wird in einer Konzentration von 5–10 % zugesetzt, um ein „Rouge“ (unerwünschte weiße Trübung) zu verhindern, das durch Verdünner, insbesondere flüchtige, verursacht wird.
Es hilft bei der Regulierung der Viskosität, verbessert die Fließeigenschaften von Lacken und reduziert die Streifenbildung in spirituslöslichen Gummi-/Harzfarben und -lacken.
1-Butanol wird als Mischung von bis zu 20 % zur Verdünnung gängiger Lösungsmittel (hauptsächlich gesättigte Carbonsäureester, insbesondere Acetate) für Polystyrol und Chlorkautschuk verwendet.
1-Butanol-Acrylester ist ein wichtiger Bestandteil von Latexfarben, der aufgrund seiner Haltbarkeit und Wirtschaftlichkeit seit den 1990er Jahren stark an Bedeutung gewonnen hat.
Butylester der Phthalsäure, Adipinsäure, Sebacinsäure, Ölsäure, Azelainsäure, Stearinsäure und Phosphorsäure dienen als Weichmacher und Additive in Oberflächenbeschichtungen, wobei Di-1-butylphthalat (DBP) die wichtigste Rolle spielt. Allerdings stagnierte der DBP-Verbrauch in einigen Ländern seit dem Jahr 2000 oder ging leicht zurück.
1-Butanol wird bei der Herstellung von Butylaminen verwendet, insbesondere in den USA, Deutschland und Belgien. Es fungiert auch als Koagulationsbad beim Spinnen von Acrylfasern und beim Färben von Poly(vinylalkohol)-Fasern.
5. Toxikologie von 1-Butanol
Akute Toxizität:
- 1-Butanol weist eine mäßige Toxizität auf, wobei die niedrigsten gemeldeten tödlichen Dosen 790 mg/kg (oral, Ratte) und 3400 mg/kg (dermal, Kaninchen) betragen.
- Das Einatmen hoher Konzentrationen kann zu Atemwegs- und Augenreizungen, Koordinationsstörungen und Narkose führen. Die niedrigste veröffentlichte tödliche Konzentration beträgt 24,3 mg/L (Ratten, inhaliert, 4 Stunden).
- Direkter Augenkontakt mit 1-Butanol verursacht schwere Hornhautreizungen.
- Hautreizungen sind bei Kaninchen leicht bis mäßig.
- Gentests (Ames-Test) weisen auf nicht mutagene Eigenschaften hin.
Chronische Auswirkungen:
- Berufsbedingte Exposition gegenüber 1-Butanol-Dämpfen von 200 ppm und mehr wird mit Hornhautentzündungen, Brennen, verschwommenem Sehen und Hörverlust in Verbindung gebracht.
- Wiederholte Exposition bei 100 ppm kann zu leichten Augenreizungen führen.
- Niedrigere Konzentrationen (25 ppm) verursachen Berichten zufolge bei einigen Personen leichte Reizungen und Kopfschmerzen.
- Dermatitis der Finger und Hände kann bei direktem Hautkontakt auftreten.
Belastungsgrenzen:
- Threshold Limit Value (TLV)-Obergrenze: 50 ppm (Haut) [ACGIH]
- Maximal zulässige Konzentration (MAK-Wert): 100 mL/m³ [Deutsche Kommission zur Bestimmung gefährlicher Stoffe]
- TRGS 900-Wert: 100 mL/m³
Referenzen
- Butanols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_463.pub3
- Butyl Alcohols; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0221202502091212.a01.pub2




