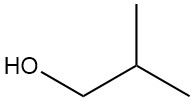
2-Methyl-1-propanol, auch bekannt als Isobutanol oder Isobutylalkohol, ist eine organische Verbindung mit der chemischen Formel (CH3)2CHCH2OH. Es handelt sich um eine farblose Flüssigkeit mit charakteristischem Geruch, die sowohl in Naturprodukten als auch in Fuselölen vorkommt.
Isobutanol ist ein Produkt der Fermentation von Melasse (ca. 74 % des Gesamtalkoholgehalts). Historisch gesehen wurde Isobutanol aus Fuselölen isoliert. Die Entwicklung der Isobutylölsynthese, ein Prozess analog zur Methanolsynthese aus Kohlenmonoxid und Wasserstoff, ermöglichte jedoch die Produktion im großen Maßstab.
In den 2010er Jahren kam es zu einem deutlichen Wandel, da die Propylen-Hydroformylierung (Oxo-Synthese) aufgrund ihrer Effizienz und Kosteneffizienz zur derzeit vorherrschenden Produktionsmethode wurde. Dies hat zu einem deutlichen Anstieg der Marktgröße für Isobutanol geführt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von 2-Methyl-1-propanol
2-Methyl-1-propanol (Isobutanol) ist eine farblose Flüssigkeit mit charakteristischem Geruch. Seine Dämpfe reizen die Schleimhäute und können in hohen Konzentrationen eine narkotische Wirkung haben. Dieser Alkohol ist mit üblichen organischen Lösungsmitteln mischbar.
Tabelle 1 fasst die wichtigsten physikalischen Eigenschaften von 2-Methyl-1-propanol zusammen:
| Eigenschaft | Wert |
|---|---|
| Molmasse | 74,12 g/mol |
| Schmelzpunkt (Fp.) | -107,9 °C |
| Siedepunkt (BP) | 107,9 °C |
| Dichte bei 20°C (d20) | 0,8027 g/ml |
| Brechungsindex bei 20°C (n20) | 1,3959 |
| Viskosität bei 20°C | 4,0 mPa·s |
| Spezifische Wärme (30–80 °C) | 2,5263 J·g-1·K-1 |
| Verdampfungswärme | 578,83 J/g |
| Verbrennungswärme | 35,981 kJ/g |
| Kritischer Druck | 48 hPa |
| Kritische Temperatur | 265 °C |
| Oberflächenspannung (Raumtemperatur) | 23,0 mN/m |
| Dielektrizitätskonstante (Raumtemperatur) | 18,8 |
| Verdampfungszahl (Ether = 1) | 24 |
| Löslichkeit in Wasser |
20 °C: 8,5 Gew.-% 30°C: 7,5 Gew.-% |
| Löslichkeit von Wasser in Isobutanol |
20 °C: 15 Gew.-% 30°C: 17,3 Gew.-% |
| Flammpunkt | 28 °C |
| Zündgrenzen in Luft | 1,7–10,9 Vol.-% |
| Zündtemperatur | 430 °C |
2. Chemische Eigenschaften von 2-Methyl-1-propanol
2.1. Dehydrierung
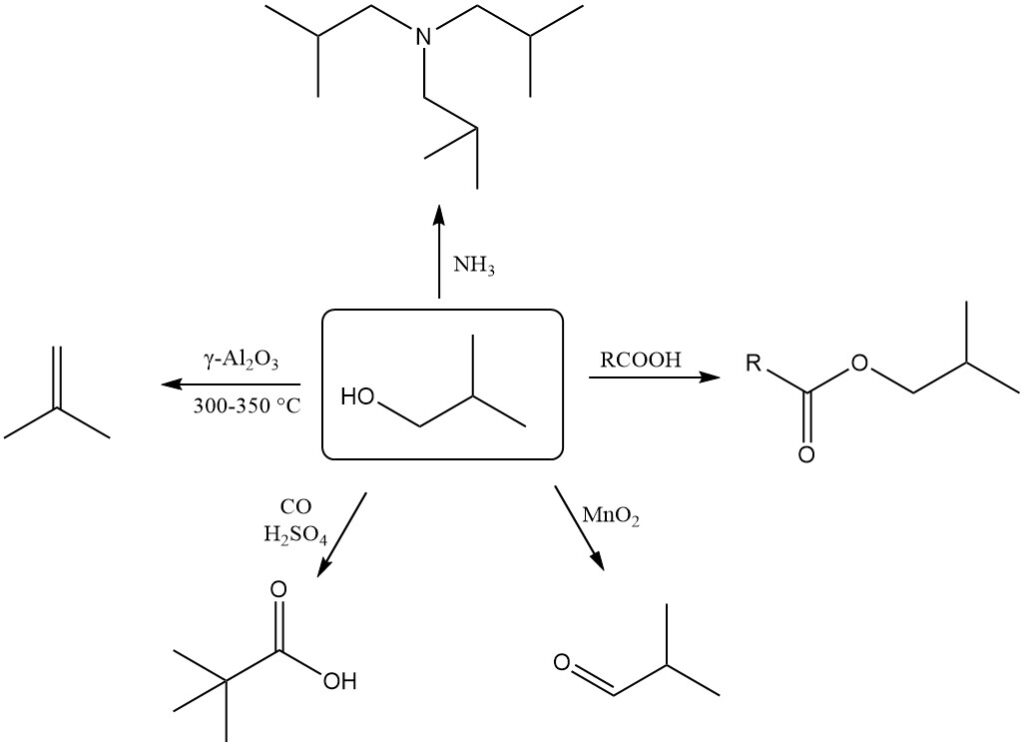
2-Methyl-1-propanol wird leicht dehydriert und bildet 2-Methylpropen (Isobuten). Diese Reaktion erfordert einen γ-Al2O3-Katalysator bei 300–350 °C und erreicht eine nahezu quantitative Umwandlung mit einer Selektivität von über 90 % für Isobuten.
2.2. Oxidation
2-Methyl-1-propanol kann mit Oxidationsmitteln wie Mangandioxid oder geeigneten Katalysatoren bei höheren Temperaturen zu 2-Methylpropanal (Isobutanal) dehydriert werden.
Die Koch-Haaf-Reaktion wandelt 2-Methyl-1-propanol in Gegenwart von Kohlenmonoxid und Schwefelsäure in hoher Ausbeute (89 %) in Trimethylessigsäure um.
Durch Oxidation von Isobutanol mit Dichromat in Gegenwart von Schwefelsäure entsteht Isobuttersäure.
2.3. Alkylierung
2-Methyl-1-propanol kann für Alkylierungsreaktionen mit Ammoniak oder Aminen zur Bildung verschiedener Alkylamine verwendet werden.
2.4. Veresterung
2-Methyl-1-propanol reagiert mit anorganischen und organischen Säuren in Gegenwart von Katalysatoren zu Isobutylestern sowie mit Säurechloriden und Säureanhydriden.
3. Herstellung von 2-Methyl-1-propanol
Drei wichtige industrielle Prozesse zur Herstellung von 2-Methyl-1-propanol (Isobutanol) sind wie folgt:
- Propenhydroformylierung (Oxo-Synthese)
- Katalytische Hydrierung von Kohlenmonoxid
- Homologisierungsreaktion
3.1. Propen-Hydroformylierung (Oxo-Synthese)
Die Oxosynthese ist die effizienteste und kostengünstigste Methode zur großtechnischen Produktion von Isobutanol. Dabei wird Propen mit Synthesegas (einem Gemisch aus Kohlenmonoxid und Wasserstoff) unter hohem Druck und hoher Temperatur unter Verwendung eines geeigneten Katalysators wie Rhodium- oder Kobaltcarbonylkomplexen umgesetzt.
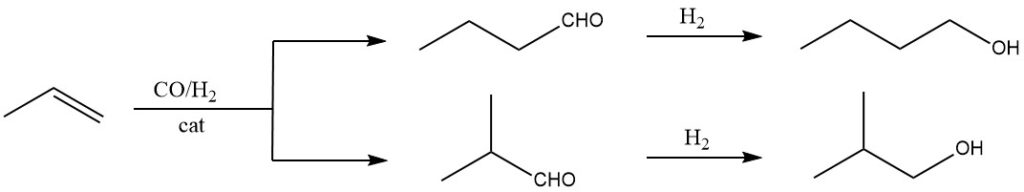
Es bildet sich eine Mischung aus Alkoholen (1-Butanol und 2-Methyl-1-propanol). Aufgrund seiner hohen Effizienz, Kosteneffizienz und leicht verfügbaren Ausgangsmaterialien ist dies derzeit die vorherrschende Methode zur Synthese von Isobutanol.
Weitere Informationen finden Sie im Artikel etwa 1-Butanol.
3.2. Katalytische Hydrierung von Kohlenmonoxid
Während die CO-H2-basierte Methanolsynthese in den 1920er-Jahren kommerziellen Erfolg hatte, stießen analoge Verfahren für höhere Alkohole nur auf begrenzte Akzeptanz. Trotz anfänglicher Versprechen sind diese Prozesse weitgehend aus der industriellen Landschaft verschwunden.
Unter diesen historischen Versuchen kommt der BASF-Isobutanol-Ölsynthese eine besondere Bedeutung zu. Bei diesem Verfahren wurde ein KOH-modifizierter Methanolsynthesekatalysator unter hohem Druck (30 MPa) und erhöhter Temperatur (430 °C) verwendet, um CO und H2 in eine Produktmischung umzuwandeln, die etwa 50 % Methanol, 11–14 % 2-Methyl-1- Propanol (Isobutanol) und andere Komponenten.
Allerdings gab die BASF 1952 die Isobutanol-Ölsynthese auf, als kostengünstigere Alternativen auftauchten. Die Oxosynthese und die petrochemischen Routen boten sowohl für Isobutanol als auch für sein wertvolles Folgeprodukt 2-Methylpropen eine überlegene Effizienz und Kosteneffizienz.
3.3. Homologisierungsreaktion
Bei diesem Prozess wird die Kohlenstoffkette eines kürzeren Alkohols wie Methanol, Ethanol oder Alkan verlängert, um Isobutanol herzustellen. Obwohl technisch möglich, sind geeignete Homologisierungsreaktionen für die Isobutanolproduktion im Vergleich zur Propenhydroformylierung nicht sehr effizient oder kommerziell rentabel.
Versuche, über Homologisierungsreaktionen eine direkte Butanolproduktion aus leicht verfügbarem Methanol und Ethanol zu erreichen, haben zu keinen nennenswerten Ergebnissen geführt. Trotz umfangreicher Forschungsanstrengungen wurde Isobutanol nur in geringen Mengen als Nebenprodukt gewonnen.
Andere Prozesse umfassen die Hydratisierung von 2-Methylpropen mit 65 %iger Schwefelsäure zu Isobutanol.

4. Verwendung von 2-Methyl-1-Propanol
2-Methyl-1-propanol wird aufgrund seiner ähnlichen Anwendungen oft mit 1-Butanol verglichen und findet aufgrund seiner geringeren Kosten und einzigartigen Eigenschaften in verschiedenen Branchen Verwendung.
Lösungsmittel und Zusatzstoffe:
- Kostengünstiger Ersatz für 1-Butanol: 2-Methyl-1-propanol dient als Lösungsmittel, Verdünnungsmittel und Zusatzstoff in Nitrozellulose und Kunstharze, Reinigungsmittel und Druckfarben.
- Harzkompatibilität: Es ist in der Lage, Ketonharze, Phthalatharze aufzulösen, Harnstoffharze und Melamin-formaldehydharze und wird kommerziell verwendet, obwohl es ist als Lösungsmittel für Phenol-Formaldehyd-Harze weniger wirksam als 1-Butanol.
Ester:
- Isobutylacetat: Dieser Ester wird als Lösungsmittel für Fette, Chlorkautschuk, Polystyrol und Cumaronharze verwendet.
- Weichmacher: Phthalsäure-, Adipin- und Dicarbonsäureester sowie der Phosphorsäureester von 2-Methyl-1-propanol, finden Verwendung als Weichmacher, insbesondere für PVC und seine Copolymere sowie für Cellulosederivate.
- Chlorphenoxyessigsäureester: Die Isobutylester der 2,4-Dichlor- und 2,4,5-Trichlorphenoxyessigsäure haben herbizide Wirkung.
Andere Anwendungen:
- Benzin-Frostschutzmittel: 2-Methyl-1-propanol besitzt Frostschutzeigenschaften in Benzin.
- Ammoniumphosphat-Extraktion: Seine Verwendung als Extraktionsmittel bei der Ammoniumphosphat-Rückgewinnung trägt zu seiner Vielseitigkeit bei.
5. Toxikologie von 2-Methyl-1-Propanol
2-Methyl-1-propanol zeigt eine geringe akute orale und dermale Toxizität, aber eine mäßige aquatische Toxizität. Zu den Auswirkungen zählen Augen- und Hautreizungen.
Akute Toxizität:
- Geringe orale Toxizität: LD50 bei Ratten beträgt 2460 mg/kg (niedrigster veröffentlichter Wert).
- Geringe dermale Toxizität: LD50 bei Kaninchen beträgt 3400 mg/kg.
- Mäßige aquatische Toxizität: LC50 für Fische beträgt 1330 mg/L (96 Stunden).
- Narkose bei Mäusen bei hoher inhalativer Exposition (6400 ppm) beobachtet.
Lokale Auswirkungen:
- Mäßige bis schwere Augenreizung bei Kaninchen.
- Mäßige Hautreizung bei Kaninchen (24-Stunden-Exposition).
Chronische Auswirkungen:
- Langzeitstudien deuten auf eine mögliche Karzinogenität bei Ratten hin (begrenzte Daten).
- Mutagen bei E. coli-Bakterien.
Menschliche Exposition:
- Keine Augenreizung beim Menschen bei geringer inhalativer Exposition (100 ppm) beobachtet.
- Die Exposition gegenüber gemischten Dämpfen (Butylacetat und 2-Methyl-1-Propanol) verursachte bei Arbeitern eine vakuoläre Keratitis (Erreger unklar).
- Die Anwendung auf der Haut verursachte beim Menschen leichte Erytheme und Hyperämie.
Belastungsgrenzen:
- TLV (Threshold Limit Value): 50 ppm (TWA), 75 ppm (STEL) [ACGIH]
- MAK (Maximal zulässige Konzentration): 100 ml/m³ [Deutschland]
- TRGS 900 (Arbeitsplatzgrenzwert): 100 mL/m³ [Deutschland]
Referenz
- Butanole; Ullmanns Enzyklopädie der industriellen Chemie. – https://onlinelibrary.wiley.com/doi/10.1002 /14356007.a04_463.pub3




