Was ist Ethanol?
Ethanol, auch bekannt als Ethylalkohol, ist einer der wichtigsten Alkohole mit der chemischen Formel CH3CH2OH. Es ist eine farblose, flüchtige Flüssigkeit mit einem charakteristischen Geruch und wird in einer Vielzahl von Anwendungen eingesetzt. Andere Namen für Ethanol sind Alkoholgeist, Weingeist, Getreidealkohol, absoluter Alkohol und Ethylhydrat.
Der Begriff „Alkohol“ stammt von den arabischen Wörtern „al“ und „kohl“ und bezieht sich auf ein fein gemahlenes Antimonpulver, das für kosmetische Zwecke verwendet wird. Im Laufe der Zeit entwickelte sich die Bedeutung dahingehend, dass sie einen hohen Grad an Feinheit oder Reinheit bezeichnete und schließlich spezifisch für Ethanol wurde, „Weingeist, der auf höchstem Niveau rektifiziert wurde“.
Ethylalkohol ist ein bekannter Bestandteil alkoholischer Getränke, die durch die Fermentation fermentierbarer Kohlenhydrate hergestellt werden. Die Fermentationsbrühe selbst kann als Getränk konsumiert werden, wie im Fall von Bier oder Wein, oder der Alkohol kann konzentriert werden, um Spirituosen mit höherem Alkoholgehalt herzustellen.
Bier enthält normalerweise 4–6 Volumenprozent Ethanol, Wein enthält 12–14 % und Spirituosen können zwischen 30–50 Volumenprozent liegen. Andere alkoholische Getränke enthalten unterschiedliche Mengen an Ethanol.
Für industrielle und kommerzielle Zwecke außer für alkoholische Getränke wird Ethanol durch Zugabe von Substanzen wie Methanol, Pyridin, Formaldehyd oder Sublimat denaturiert. Denaturiertes Ethanol wird als Lösungsmittel, Rohstoff für die chemische Herstellung und als Kraftstoff verwendet.
Die Geschichte des Ethanols reicht bis in die Antike zurück. Fermentiertes Bier wurde in Babylon konsumiert, während die Weinproduktion bis um 3000 v. Chr. im alten Ägypten zurückreicht, wo er von den Pharaonen zubereitet und konsumiert wurde.
Der Destillationsprozess entstand wahrscheinlich zwischen dem 10. und 14. Jahrhundert. In dieser Zeit erkannte man die „spirituelle“ Wirkung von Ethanol, was zur Bezeichnung „Spiritus“ für alkoholische Getränke führte. Frühe Weindestillate wurden hauptsächlich für medizinische Zwecke verwendet.
Bis zum 17. Jahrhundert galt die alkoholische Gärung als Verderbnisprozess. Die Natur der Gärung wurde erstmals im 19. Jahrhundert mit der Erfindung des Mikroskops geklärt, das Hefezellen als lebende Organismen enthüllte. Es dauerte jedoch etwa 150 Jahre, bis die Rolle dieser Organismen im Gärungsprozess erkannt wurde.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Ethanol
Reines Ethanol (absoluter Alkohol) ist eine flüchtige, entzündbare, klare und farblose Flüssigkeit mit angenehmem Geruch. Es ist mit Wasser, Ether, Aceton, Benzol und einigen anderen organischen Lösungsmitteln mischbar. Wasserfreies Ethanol ist hygroskopisch.
Ethanol bildet mit Wasser eine azeotrope Mischung, die 95,57 Gew.-% Ethanol und 4,43 Gew.-% Wasser enthält. Daher beträgt die höchste Ethanolkonzentration, die durch Destillation einer Ethanol-Wasser-Mischung erreicht werden kann, 95,57 Gew.-%. Um absolutes (wasserfreies) Ethanol herzustellen, muss eine azeotrope Destillation mit Hilfe eines tertiären Lösungsmittels (z. B. Benzol) durchgeführt werden.
Die wichtigen physikalischen Eigenschaften von wasserfreiem Ethanol sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [64-17-5] |
| Chemische Formel | C2H5OH |
| Molekulargewicht | 46,7 g/mol |
| Gefrierpunkt | -114,1 °C |
| Siedepunkt | 78,32 °C |
| Kritische Temperatur | 243,1 °C |
| Kritischer Druck | 6383,48 kPa |
| Kritisches Volumen | 0,167 l/mol |
| Dichte | 0,7893 g/mL |
| Brechungsindex | 1,36143 |
| Oberflächenspannung (bei 25 °C) | 23,1 mN/m |
| Viskosität (bei 20 °C) | 1,17 mPa·s |
| Löslichkeit in Wasser (bei 20 °C) | Mischbar |
| Verdampfungswärme (bei normalem Siedepunkt) | 839,31 J/g |
| Verbrennungswärme (bei 25 °C) | 29676,69 J/g |
| Schmelzwärme | 104,6 J/g |
| Entzündbarkeitsgrenzen in Luft | Untere: 4,3 Vol.-% Obere: 19,0 Vol.-% |
| Zündungstemperatur | 423 °C |
| Flammpunkt | 14 °C (geschlossener Tiegel) |
| Spezifische Wärmekapazität (bei 20 °C) | 2,42 J/(g·°C) |
| Wärmeleitfähigkeit (bei 20 °C) | 0,170 W/(m·K) |
| Dipolmoment (flüssig bei 25 °C) | 5,67 × 10-30 |
| Magnetische Suszeptibilität (bei 20 °C) | 0,734 × 10-6 |
| Dielektrizitätskonstante (bei 20 °C) | 25,7 |
2. Chemische Reaktionen von Ethanol
Die chemische Reaktivität von Ethanol wird hauptsächlich durch seine Hydroxylgruppe (-OH) beeinflusst, die an zahlreichen industriell bedeutsamen Reaktionen wie Dehydratation, Halogenierung, Esterbildung und Oxidation beteiligt ist.
Das Wasserstoffatom der Hydroxylgruppe kann durch ein aktives Metall wie Natrium, Kalium oder Calcium ersetzt werden, um unter Entwicklung von Wasserstoffgas Metallethoxide (Ethylate) zu bilden.
CH3CH2OH + M → CH3CH2OM + 1/2 H2
Natriumethoxid, ein häufig verwendetes Metallethoxid, kann durch die Reaktion von absolutem Ethylalkohol mit Natrium oder durch Rückflusskochen von absolutem Ethylalkohol mit wasserfreiem Natriumhydroxid hergestellt werden. Kommerziell wird Wasser durch azeotrope Destillation mit Benzol aus dem Reaktionsgemisch entfernt.
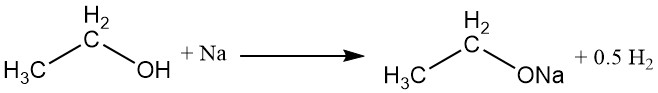
Natriumethoxid hydrolysiert leicht zu Ethylalkohol, Natriumionen und Hydroxidionen.
Natriumethoxid wird als Kondensations- und Reduktionsmittel in der organischen Synthese verwendet. Es reagiert mit Schwefelmonochlorid zu Diethylthiosulfit. Darüber hinaus ist Natriumethoxid ein Reagenz für die kommerzielle Herstellung von Barbituraten, Ethylorthoformiat und anderen Chemikalien.
Aluminium und Magnesium können auch mit Ethanol zu Ethoxiden reagieren, aber diese Reaktion erfordert eine Katalyse durch Amalgamierung des Metalls.
Gut gereinigte Aluminiumspäne reagieren bei Raumtemperatur in Gegenwart von Quecksilberchlorid mit Ethanol. Diese Reaktion kann in einem Autoklaven bei erhöhten Temperaturen ohne Katalysator oder mit Zusatz von Natriumethoxid durchgeführt werden.
Die Hydroxylgruppe von Ethanol kann auch an anderen Reaktionen teilnehmen, wie der Ringöffnung von Epoxiden zu Hydroxyethern und der Addition an Acetylen zu Ethylvinylether. Diese Reaktionen werden sowohl durch saure als auch durch basische Bedingungen katalysiert.
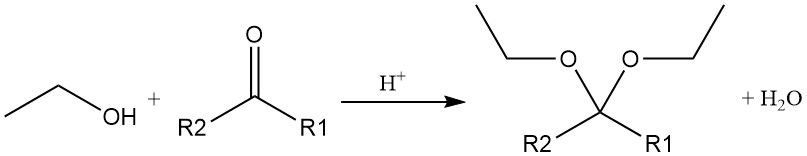
Die säurekatalysierte Addition von Ethanol an Acetylen oder Vinylether erzeugt Acetale, die ebenfalls durch die säurekatalysierte Reaktion von Ethylalkohol mit einem Aldehyd oder Keton entstehen.
Die Hydroxylgruppe kann durch Halogene aus anorganischen Säurehalogeniden oder Phosphorhalogeniden ersetzt werden, wodurch Ethylester der Säure und ein Ethylhalogenid entstehen. Zur Herstellung von Ethylchlorid werden üblicherweise Phosphortrichlorid und Thionylchlorid verwendet, wobei Triethylphosphit und Diethylsulfit als Nebenprodukte entstehen.
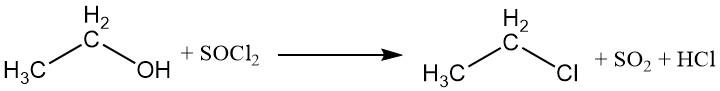
Halogensäuren können auch mit Ethanol reagieren und Alkylhalogenide bilden. Die Reaktivität der Halogensäuren variiert, wobei Iodwasserstoffsäure am reaktivsten ist. Ethylchlorid kann durch die Reaktion zwischen Ethanol und Chlorwasserstoff hergestellt werden.
CH3CH2OH + HX → CH3CH2X + H2O
Die Reaktion von Ethanol mit Bromwasserstoff ergibt Ethylbromid, das ein Vorläufer des Ethyl-Grignard-Reagenz und verschiedener Ethylamine ist.
2.1. Veresterung
Ethanol reagiert mit anorganischen und organischen Säuren, Säureanhydriden und Säurehalogeniden zu Estern. Wenn eine sauerstoffhaltige anorganische Säure wie Schwefelsäure oder Salpetersäure mit Ethylalkohol reagiert, enthält der entstehende Ester eine Kohlenstoff-Sauerstoff-Bindung, die hydrolysiert werden kann.
Organische Ester entstehen durch eine Dehydratationsreaktion zwischen Ethanol und einer organischen Säure. Diese Reaktion ist reversibel und erreicht langsam ein Gleichgewicht. Saure Katalysatoren wie Schwefelsäure, Salzsäure, Bortrifluorid und p-Toluolsulfonsäure werden üblicherweise eingesetzt, um den Veresterungsprozess zu beschleunigen.
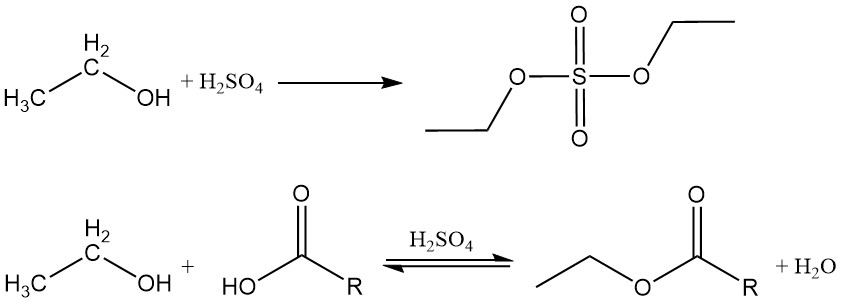
Ethanol reagiert auch mit Säureanhydriden oder Säurehalogeniden und bildet die entsprechenden Ester.
Die direkte Umwandlung von Ethanol in Ethylacetat erfolgt vermutlich über Acetaldehyd und dessen anschließende Kondensation (Tischtschenko-Reaktion). Mit einem Kupferoxidkatalysator mit 0,1-0,2 % Thoriumoxid bei 350 °C kann eine Ethylacetat-Ausbeute von etwa 24 % erreicht werden.
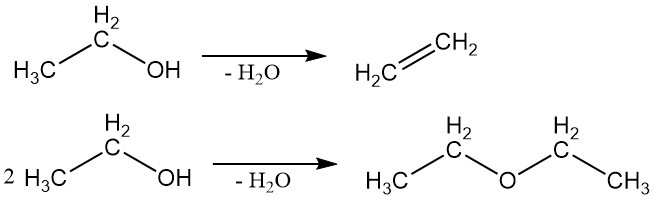
2.2. Dehydratation
Ethanol kann dehydratisiert werden, um Ethylen oder Ethylether zu erzeugen. Das gebildete spezifische Produkt hängt von den Reaktionsbedingungen ab.
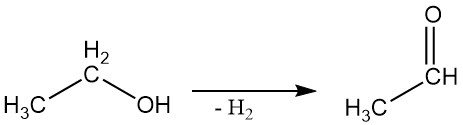
2.3. Dehydrierung
Ethylalkohol kann in einer Dampfphasenreaktion mit geeigneten Katalysatoren zu Acetaldehyd dehydriert werden.
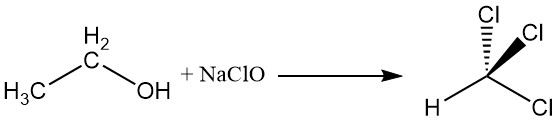
2.4. Haloform-Reaktion
Ethylalkohol reagiert mit Natriumhypochlorit zu Chloroform, eine Reaktion, die als Haloform-Reaktion bekannt ist.
3. Industrielle Produktion von Ethanol
Ethanol wird sowohl durch synthetische als auch durch Fermentationsverfahren hergestellt. Eine der frühesten synthetischen Methoden umfasste die Reaktion von Ethylen mit Schwefelsäure, ein Verfahren, das vor über einem Jahrhundert entdeckt wurde.
Die großtechnische Produktion von synthetischem Ethanol wurde jedoch erst in den 1930er Jahren wirtschaftlich machbar, als die Carbide and Chemical Corporation das indirekte Hydratationsverfahren entwickelte.
Dieses Verfahren, bei dem Ethylen in Schwefelsäure absorbiert und anschließend hydrolysiert wurde, wurde inzwischen weitgehend durch die direkte katalytische Hydratation von Ethylen ersetzt, die 1948 von der Shell Chemical Company eingeführt wurde.
In den letzten Jahrzehnten sind alternative Methoden zur Ethanolsynthese aufgetaucht, bei denen kohlebasierte Ausgangsstoffe wie Methanol oder Synthesegas verwendet werden. Zu diesen Verfahren gehören Homologisierung, Carbonylierung und die direkte Umwandlung von Synthesegas in Ethanol.
Die Fermentation von Zucker, Stärke oder Zellulose bleibt jedoch die vorherrschende Methode zur Ethanolproduktion und macht bis zu 90 % der weltweiten Produktion aus.
3.1. Herstellung von Ethanol durch direkte katalytische Hydratisierung von Ethylen
Die Hydratisierung von Ethylen zu Ethanol ist eine reversible Reaktion. Die Gleichgewichtskonstante für diese Reaktion wird von Temperatur und Druck beeinflusst. Höhere Temperaturen begünstigen eine höhere Ethylenumwandlung, erhöhen aber auch die Rate von Nebenreaktionen, wie etwa der Bildung von Diethylether.
Es wurden kinetische Studien an verschiedenen Katalysatoren durchgeführt, darunter Phosphorsäure-Kieselgel und blaues Wolframoxid-Kieselgel. Diese Studien haben Einblicke in die Aktivierungsenergie und Reaktionsrate unter verschiedenen Bedingungen geliefert.
Mehrere Prozessvariablen, darunter Druck, Temperatur und das Molverhältnis von Wasser zu Ethylen, beeinflussen die Ethylenumwandlung. Unter typischen Reaktorbedingungen (ungefähr äquimolare Ethylen-Wasser-Zufuhr, 250–300 °C, 5–8 MPa) liegt die Gleichgewichtsumwandlung von Ethylen zwischen 7 und 22 %.
Zusätzlich zur gewünschten Hydratisierungsreaktion können Nebenreaktionen auftreten, die zur Bildung von Nebenprodukten führen. Bei niedrigeren Temperaturen kann Diethylether entstehen, während bei höheren Drücken eine Polymerisation von Ethylen zu Butenen und höheren Olefinen stattfinden kann.
Der vorgeschlagene Mechanismus zur Ethylenhydratisierung umfasst vier Schritte:
- Ein Proton wird dem Ethylenmolekül hinzugefügt, um einen π-Komplex zu bilden.
- Der π-Komplex wird in ein Carbokation umgewandelt.
- Ein Wassermolekül wird dem Carbokation hinzugefügt.
- Ein Proton wird aus dem protonierten Ethanol entfernt, um Ethanol zu ergeben.
Katalysatoren
Die Hydratisierung von Ethylen zu Ethanol wird im Allgemeinen durch saure Katalysatoren katalysiert. Phosphorsäure auf verschiedenen Materialien, darunter Kieselgur (Kieselgur, Celite), Montmorillonit, Bentonit, Kieselgel und Opoka, gehört zu den am häufigsten verwendeten Katalysatoren für diese Reaktion.
Neben Katalysatoren auf Phosphorsäurebasis wurden auch andere Katalysatoren untersucht, wie saure Oxide, Heteropolysäuren, Zeolithe und Salze. Diese Materialien bieten potenzielle Vorteile in Bezug auf Aktivität, Selektivität und Stabilität.
Unter Reaktionsbedingungen muss der Träger resistent gegen Phosphorsäure sein, diese aber in großen Mengen zurückhalten können; er muss außerdem über ausreichende mechanische Festigkeit und eine ausreichend lange Lebensdauer verfügen; und schließlich muss er einen aktiven, selektiven Katalysator für die Hydratisierung bieten.
Um die Katalysatorleistung zu optimieren, wird der Träger mit Mineralsäuren wie Salz- oder Schwefelsäure vorbehandelt, um Verunreinigungen wie Eisen und Aluminium zu entfernen, und mit 50 bis 77 % Phosphorsäure imprägniert.
Eine Wärmebehandlung bei erhöhten Temperaturen (700–1100 °C) wird häufig eingesetzt, um die Bindung der Phosphorsäure an den Träger zu verbessern. Diese Behandlung kann zwar die anfängliche Aktivität und Selektivität des Katalysators leicht verringern, kann aber seine Langzeitstabilität und Haltbarkeit deutlich verbessern.
Produktionsprozess
Die katalytische Hydratisierung von Ethylen zu Ethanol umfasst eine Reihe von Schritten, wie in Abbildung 1 dargestellt.
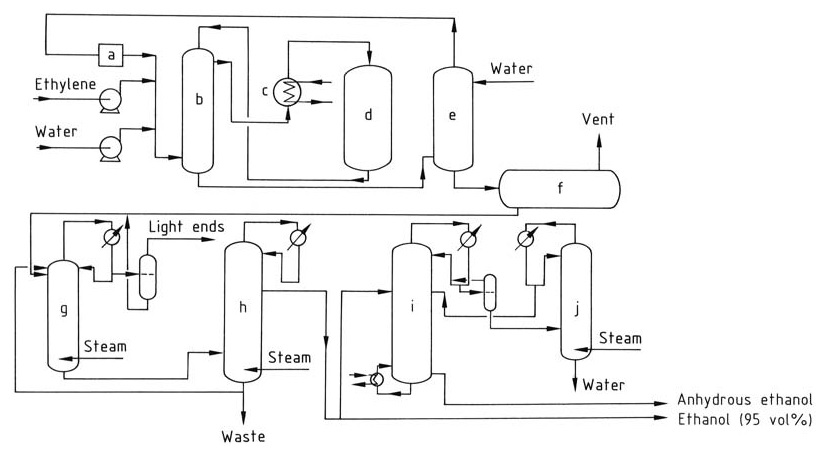
a) Umlaufkompressor; b) Wärmetauscher; c) Überhitzer; d) Reaktor; e) Wäscher; f) Rohethanoltank; g) Extraktivdestillationskolonne; h) Konzentrationskolonne; i) Dehydratisierung; j) Konzentrationskolonne
Ethylen und deionisiertes Wasser werden in einem Molverhältnis von 1:0,3 bis 1:0,8 durch einen Wärmetauscher und einen Überhitzer bei 6–8 MPa auf 250–300 °C erhitzt. Die Reaktion ist exotherm und setzt Wärme frei, die zurückgewonnen und zum Vorwärmen des Zufuhrstroms verwendet werden kann.
Der Gasstrom wird mit Wasser gewaschen, um etwaiges restliches Ethanol zu entfernen. Das gereinigte Gas wird dann erneut komprimiert und in den Reaktor zurückgeführt, um die gewünschte Ethylenkonzentration aufrechtzuerhalten.
Die Reaktionsprodukte werden gekühlt und kondensiert, um die flüssigen und gasförmigen Phasen zu trennen. Das im Waschsumpf gesammelte Rohethanolprodukt enthält ungefähr 10–25 % Ethanol nach Gewicht und wird durch Destillation weiter gereinigt, um ein 95 % Ethanol-Wasser-Azeotrop zu erhalten.
Um wasserfreies Ethanol herzustellen, kann das 95 % Ethanol durch azeotrope Destillation dehydriert werden.
Während der katalytischen Hydratisierung von Ethylen kann ein Teil des Phosphorsäurekatalysators vom Gasstrom mitgerissen werden. Um eine Säureansammlung in der nachgeschalteten Ausrüstung zu verhindern, wird eine verdünnte Natriumhydroxidlösung eingespritzt, um sie zu neutralisieren.
Die durch Mitreißen und Verdampfen verlorene Phosphorsäure wird durch regelmäßiges Aufsprühen auf das Katalysatorbett wieder aufgefüllt, um während des gesamten Reaktionsprozesses eine konstante Katalysatorkonzentration sicherzustellen.
Diethylether (ca. 2 %) ist ein häufiges Nebenprodukt der Reaktion und kann zurückgewonnen und für eine separate Verwendung gereinigt oder in den Reaktor zurückgeführt werden. Acetaldehyd, eine potenzielle Verunreinigung, wird durch Hydrierung in Ethanol umgewandelt, um die Bildung unerwünschter Verbindungen wie Crotonaldehyd zu vermeiden.
Die Prozessausrüstung besteht aus Reaktoren, Wärmetauschern, Destillationskolonnen und zugehörigen Rohrleitungen. Reaktoren bestehen normalerweise aus Stahl mit einer Kupfer- oder Kohlenstoffauskleidung zum Schutz vor Korrosion durch Phosphorsäure. Wärmetauscher und Rohrleitungen, die Phosphorsäure ausgesetzt sind, bestehen ebenfalls aus Kupfer oder Kupferlegierungen.
Der Prozess erzeugt nur minimalen Abfall. Abgelassenes Ethylen, das weniger als 15 % der gesamten Zufuhr ausmacht, kann in die Ethylenanlage zurückgeführt oder verbrannt werden. Abwasser aus der Destillation enthält nur wenige organische Verbindungen und Phosphate (ungefähr 0,3 kg Na2HPO4 pro Kubikmeter) und kann leicht entsorgt werden.
3.2. Herstellung von Ethanol durch indirekte Hydratisierung von Ethylen
Die indirekte Hydratisierung von Ethylen mit Schwefelsäure umfasst zwei Hauptschritte: die Absorption von Ethylen und die Hydrolyse des erzeugten Sulfats.
Ethylen reagiert mit konzentrierter Schwefelsäure zu Ethylhydrogensulfat und Diethylsulfat, die dann mit Wasser hydrolysiert werden, um Ethanol und Diethylether zu erzeugen.
Kinetische Studien haben gezeigt, dass die Absorptions- und Hydrolyseschritte einem ähnlichen Reaktionsmechanismus wie der direkte Hydratisierungsprozess folgen, jedoch von der Löslichkeit von Ethylen in Schwefelsäure beeinflusst werden.
Die Endprodukte des indirekten Hydratisierungsprozesses sind Ethanol und Diethylether (5–10 %). Die Ausbeute an Diethylether kann durch Anpassen der Reaktionsbedingungen, wie z. B. des Verhältnisses von Ethylen zu Schwefelsäure und der Hydrolysebedingungen, gesteuert werden.
Die Ethylsulfate können bei 104 °C mit Essigsäure umgeestert werden, um Ethylacetat zu erzeugen. Ethylacetat wird dann durch Destillation gewonnen und zu Ethanol und Essigsäure hydrolysiert. Dieses Verfahren bietet einen Vorteil gegenüber der herkömmlichen Hydrolysemethode, da keine erneute Konzentration der Schwefelsäure erforderlich ist.
Produktionsprozess
Abbildung 2 zeigt das Flussschema für die Herstellung von Ethanol durch indirekte Hydratisierung von Ethylen.
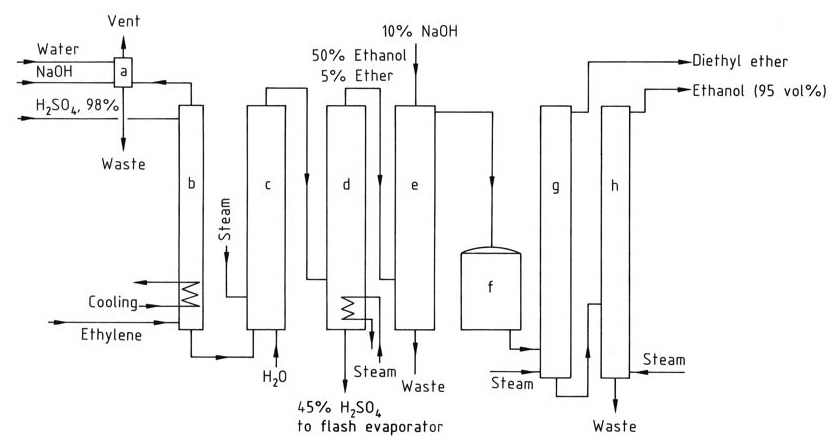
a) Waschkolonne für Restgas; b) Absorber; c) Hydrolysator; d) Strippkolonne; e) Waschkolonne für Rohethanol; f) Rohprodukttank; g) Diethylether-Destillationskolonne; h) Ethanol-Destillationskolonne
Das Ausgangsgas für den indirekten Hydratationsprozess muss mindestens 35 % Ethylen enthalten und sollte frei von höheren Homologen sein, die Harzbildung verursachen können. Inerte Gase wie Methan und Ethan können zugesetzt werden.
Die Absorption von Ethylen nimmt mit dem Druck zu, der im Allgemeinen zwischen 1 und 3,5 MPa liegt. Jedes Mol Schwefelsäure kann bis zu 1,4 Mol Ethylen absorbieren. Die Absorption wird in Waschtürmen bei 65–85 °C durchgeführt, und Temperaturen über 90 °C müssen vermieden werden, um Harzbildung zu verhindern.
Das absorbierte Ethylen reagiert nach mehrstündigem Rühren mit Schwefelsäure zu Ethylsulfaten. Die Hydrolyse dieser Sulfate erfolgt in zwei Stufen: einer Hydrolyse bei niedriger Temperatur (70 °C) zur Umwandlung von Diethylsulfat und einer anschließenden Hydrolyse bei hoher Temperatur (100 °C) für etwa 1 Stunde, um die Reaktion abzuschließen.
Die Schwefelsäure wird auf 40–55 Gew.-% verdünnt und Ethanol und Diethylether werden aus dem Reaktionsgemisch durch eine Strippkolonne gewonnen. Das Produktgemisch wird dann mit Natriumhydroxid neutralisiert und der Diethylether wird in einer separaten Destillationskolonne entfernt.
Das Ethanol wird durch Destillation weiter gereinigt, um ein 95 % Ethanol-Wasser-Azeotrop zu erhalten.
Die Rückkonzentrierung der verdünnten Schwefelsäure ist ein teurer Schritt des indirekten Hydratationsprozesses, der durch hohen Energieverbrauch, Korrosionsprobleme und Oxidation organischer Verbindungen (die Bildung von Teer) gekennzeichnet ist.
Um diese Herausforderungen zu überwinden, kann ein Betrieb bei niedrigeren Drücken unter 0,5 MPa und die Zugabe von bis zu 7 % Silbersulfat zur Schwefelsäure die Prozesseffizienz verbessern und den Rückkonzentrierungsbedarf verringern.
Die Wahl der Baumaterialien hängt von den spezifischen Prozessschritten ab. Stahl wird üblicherweise für Absorptions- und Destillationsgeräte verwendet. Blei und säurebeständige Materialien eignen sich für die Hydrolyse, während Silumin, Tantal, Gusseisen und Blei für die Schwefelsäure-Rückkonzentration verwendet werden.
3.3. Andere Methoden
Es wurden andere Methoden zur Synthese von Ethanol aus Methanol und Synthesegas entwickelt. Diese Verfahren werden in Zukunft wahrscheinlich von industrieller Bedeutung sein, da sie Ausgangsstoffe verwenden, die aus Kohle verfügbar sind und nicht aus Erdöl gewonnen werden.
3.3.1. Homologation von Methanol
Die Homologation, ein Verfahren, bei dem die Kohlenstoffkette eines Alkohols um ein Kohlenstoffatom verlängert wird, wurde als alternativer Weg zur Ethanolsynthese untersucht. Methanol kann in Gegenwart eines Kobaltcarbonylkatalysators mit Synthesegas (CO + H2) reagieren, um Ethanol herzustellen.
Frühe Versuche zur Homologation von Methanol führten zu geringen Ethanolausbeuten und komplexen Produktgemischen. Fortschritte im Katalysatordesign und bei den Reaktionsbedingungen haben jedoch die Selektivität für Ethanol verbessert.
Studien haben gezeigt, dass die Verwendung von Tetrahydrofuran als Lösungsmittel oder die Zugabe von Iod oder Iodid mit organischen Phosphinen die Ethanolselektivität verbessern kann.
3.3.2. Carbonylierung von Methanol und Methylacetat
Ein anderer Ansatz zur Herstellung von Ethanol ist die Carbonylierung von Methanol zu Essigsäure, gefolgt von einer Hydrierung. Diese Methode basiert auf dem Monsanto-Verfahren zur Essigsäuresynthese, bei dem ein Rhodiumcarbonyl-Iod-Katalysator verwendet wird.
Eine direkte Hydrierung von Essigsäure zu Ethanol ist zwar möglich, erfordert jedoch Hochdruckgeräte und kann korrosiv sein. Eine praktischere Methode ist die Veresterung von Essigsäure mit Ethanol zur Bildung von Ethylacetat, gefolgt von einer Hydrogenolyse von Ethylacetat zu Ethanol.
Es wurden mehrere Varianten des Carbonylierungsprozesses entwickelt, darunter die Verwendung von Methylacetat als Ausgangsmaterial. Methylacetat kann zu Essigsäureanhydrid carbonyliert werden, das dann mit Ethanol und Methanol reagiert, um Ethyl- und Methylacetate herzustellen. Das Ethylacetat kann anschließend zu Ethanol hydrogenolysiert werden.
3.3.3. Umwandlung von Synthesegas in Ethanol
Synthese durch heterogene Katalyse
Die Bemühungen, Synthesegas (CO + H2) in Ethanol umzuwandeln, konzentrierten sich auf die Modifizierung bestehender Katalysatoren, die für die Methanolsynthese verwendet werden. Studien haben gezeigt, dass die Einbeziehung von Alkalimetallen, Kobalt oder anderen Elementen die Ethanolausbeute verbessern kann.
Forschungseinrichtungen wie das Institut Français du Pétrole haben komplexe Katalysatoren entwickelt, die mehrere Elemente enthalten, darunter Kupfer, Kobalt, Chrom, Kalium, Lanthan und andere. Diese Katalysatoren können Alkoholmischungen erzeugen, die eine erhebliche Menge an Ethanol, Methanol und höheren Alkoholen enthalten.
Katalysatoren aus Platinmetallen wie Rhodium und Lanthantrioxid haben sich ebenfalls als vielversprechend bei der Umwandlung von Synthesegas in Ethanol erwiesen. Diese Katalysatoren können bei 200–240 °C und atmosphärischem Druck hohe Ethanolselektivitäten erreichen.
Synthese durch homogene Katalyse
Die homogene Katalyse unter Verwendung von Rutheniumkomplexen wurde zur Umwandlung von Synthesegas in Ethanol untersucht. Rutheniumkatalysatoren können in Kombination mit organischen Phosphorverbindungen Ethanolselektivitäten von über 50 % erreichen.
Verschiedene Lösungsmittel und Zusatzstoffe wie Tripropylphosphinoxid, Tetrabutylphosphoniumbromid und Alkyltriphenylphosphoniumbromide wurden untersucht, um die Ethanolproduktion zu optimieren.
3.4. Herstellung von Ethanol durch Fermentation
Fermentation, ein Biosyntheseprozess, wird seit Jahrhunderten zur Herstellung verschiedener Produkte, darunter Ethanol, eingesetzt. Während Mais in den letzten Jahrzehnten der wichtigste Rohstoff war, können auch andere landwirtschaftliche Materialien wie Melasse, Getreide, Zuckerrohr, Rüben, Obst, Molke und Sulfitablauge verwendet werden.
Derzeit wird an der Machbarkeit der Fermentierung von Abfallstoffen wie Müll geforscht.
Die Eignung verschiedener Rohstoffe für die Ethanolproduktion hängt von Faktoren wie Verfügbarkeit, Kosten, Zuckergehalt und Ethanolertrag ab. Einige landwirtschaftliche Produkte wie Kartoffeln sind aufgrund des geringen Ethanolertrags und der hohen Transportkosten möglicherweise wirtschaftlich weniger attraktiv.
Fermentierbare Materialien können grob in drei Typen eingeteilt werden:
- Zucker: Eine direkte Fermentation von Zucker aus Zuckerrohr, Zuckerrüben, Melasse oder Früchten ist möglich.
- Stärke: Stärke aus Getreide, Kartoffeln oder Wurzelgemüse muss mithilfe von Enzymen aus Malz oder Schimmel in fermentierbare Zucker hydrolysiert werden.
- Zellulose: Zellulosereiche Materialien, darunter Holz, landwirtschaftliche Rückstände und Sulfitablaugen, müssen vor der Fermentation mithilfe von Mineralsäuren in Zucker umgewandelt werden.
Fermentation ist die Umwandlung von Zucker in Ethanol und Kohlendioxid unter anaeroben Bedingungen. Während verschiedene Mikroorganismen Zucker fermentieren können, werden Hefen, insbesondere Saccharomyces cerevisiae, aufgrund ihrer hohen Ethanoltoleranz und -effizienz häufig verwendet.
Die Gärung von Glukose erfolgt über den Glykolyseweg, eine Reihe enzymatischer Reaktionen, die Glukose in Pyruvat zerlegen und ATP (Adenosintriphosphat) als Energie produzieren. Unter anaeroben Bedingungen wird Pyruvat in Acetaldehyd umgewandelt, das dann durch Alkoholdehydrogenase zu Ethanol reduziert wird.
Die optimalen Gärungsbedingungen variieren je nach Hefestamm, Rohstoff und gewünschten Produktspezifikationen. Wichtige Faktoren, die die Gärung beeinflussen, sind:
- Temperatur: Die meisten Hefen bevorzugen einen Temperaturbereich von 25–30 °C für optimales Wachstum und Ethanolproduktion.
- pH-Wert: Der pH-Wert sollte innerhalb eines bestimmten Bereichs, normalerweise zwischen 4,5 und 5,5, gehalten werden, um optimale Hefeaktivität zu gewährleisten und bakterielle Kontamination zu verhindern.
- Nährstoffverfügbarkeit: Hefen benötigen eine ausgewogene Versorgung mit Nährstoffen, einschließlich Stickstoff, Phosphor und Mikronährstoffen, für Wachstum und effiziente Gärung.
- Zuckerkonzentration: Die Zuckerkonzentration sollte innerhalb eines geeigneten Bereichs gehalten werden, um eine Hemmung des Hefewachstums und der Ethanolproduktion zu verhindern. Übermäßige Zuckerkonzentrationen können zu osmotischem Stress und verringerter Gärungseffizienz führen.
Die Gärung kann in Batch- oder kontinuierlichen Prozessen durchgeführt werden. Bei der Batch-Fermentation wird ein bestimmtes Volumen eines Mediums, das Zucker und Nährstoffe enthält, mit Hefe beimpft und gären gelassen, bis die gewünschte Ethanolkonzentration erreicht ist.
Bei der kontinuierlichen Fermentation wird ein stetiger Mediumstrom in einen Fermenter geleitet, während die fermentierte Brühe kontinuierlich entfernt wird, was eine effizientere und gleichmäßigere Ethanolproduktion ermöglicht.
Während der Fermentation können mehrere Herausforderungen auftreten, darunter bakterielle oder Pilzkontamination und Hemmung der Hefeaktivität durch hohe Ethanolkonzentrationen, Ansammlung von Nebenprodukten und Nährstoffbegrenzung.
4. Verwendung von Ethanol
Ethanol wird seit der Antike für eine breite Palette von Anwendungen verwendet. Es wird als Bestandteil alkoholischer Getränke, als Lösungsmittel, als Rohstoff für die chemische Synthese und als Kraftstoff verwendet.
In der Vergangenheit wurde durch Fermentation gewonnener Ethanol hauptsächlich für Getränke und Spezialchemikalien verwendet, während chemisch synthetisierter Ethanol in der Industrie eingesetzt wurde. Einige Länder wie Brasilien und Indien verwenden jedoch Fermentationsethanol für industrielle Anwendungen.
Um die Verwendung von Ethanol in industriellen Prozessen zu geringeren Kosten zu ermöglichen, haben viele Länder steuerfreie Richtlinien für industriellen und denaturierten Ethanol eingeführt. Diese Richtlinien umfassen häufig finanzielle, administrative und chemische Kontrollen, um den Missbrauch von steuerfreiem Ethanol für Getränke zu verhindern.
Basierend auf diesen Vorschriften wird industrieller Ethanol in vier Typen eingeteilt: vollständig denaturierter Alkohol, proprietäre Lösungsmittel und spezielle industrielle Lösungsmittel, speziell denaturierter Alkohol und reiner (absoluter) Ethanol.
Ethanol wird Benzin häufig als Kraftstoffzusatz zugesetzt, normalerweise in Verhältnissen von 5 % bis 85 % Ethanol (bekannt als E5 bis E85) oder als Benzinverdünner. Aufgrund seiner Fähigkeit, aus einer Reihe von Ressourcen wie Mais, Zuckerrohr und Zellulosematerialien hergestellt zu werden, wird Ethanol als Kraftstoffquelle immer beliebter.
Neben seiner Verwendung in traditionellen alkoholischen Getränken wird Ethanol auch zur Herstellung verschiedener aromatisierter Liköre und als Basis für viele Cocktails verwendet.
Ethanol ist nach Wasser ein weit verbreitetes Lösungsmittel, vor allem bei der Herstellung von Toilettenartikeln, Kosmetika, Reinigungsmitteln, Desinfektionsmitteln, Arzneimitteln, Oberflächenbeschichtungen sowie Lebensmitteln und Arzneimitteln.
Während sowohl synthetisches als auch fermentiertes Ethanol als Lösungsmittel verwendet werden kann, wird fermentiertes Ethanol im Allgemeinen bevorzugt, insbesondere in Europa, für Anwendungen, die den menschlichen Verzehr oder die Verwendung am Körper betreffen.
Ethanol ist ein starkes Desinfektionsmittel, das häufig in Krankenhäusern, Laboren und anderen Gesundheitseinrichtungen verwendet wird, um Bakterien, Viren und andere schädliche Mikroorganismen abzutöten. Es wird auch bei der Herstellung von Handdesinfektionsmitteln und Desinfektionssprays verwendet.
Ethanol wird als Rohstoff für die Herstellung verschiedener Chemikalien verwendet, darunter Acetaldehyd, Butadien, Diethylether, Ethylacetat, Ethylamine, Ethylen, Glykolether und andere Produkte, die durch Reaktionen mit Ethylenoxid oder Epoxiden und Essig entstehen.
Einige Länder, wie Brasilien, haben ethanolbasierte Chemieindustrien zur Herstellung von Chemikalien wie Acetaldehyd aufgebaut, die traditionell aus Petrochemikalien in Ländern mit reichlichen Erdölvorkommen gewonnen werden.
Brasilien war der weltweit größte Produzent von Ethanol aus Zucker und stellte 1985–1986 über 95 % der Gesamtproduktion her. Der größte Teil des in Brasilien produzierten Ethanols wird als Kraftstoff verwendet, während ein kleinerer Teil als chemischer Rohstoff eingesetzt wird.
1978 verwendete Indien über 50 % seiner gesamten Ethanolproduktion für die chemische Herstellung von Produkten wie Acetaldehyd, Essigsäure, Essigsäureanhydrid, DDT, organischen Acetaten, Aceton, Butanol, Polyethylen, Polyvinylchlorid und Styrol.
5. Toxikologie von Ethanol
Ethanol weist bei Ratten eine akute orale Toxizität auf, mit LD50-Werten zwischen 11,5 und 13,7 g/kg. Ähnliche LD50-Werte von 9,5, 9,6, 9,9 und 6 g/kg wurden bei Mäusen, Meerschweinchen, Kaninchen bzw. Hunden festgestellt.
Ethanol kann je nach Konzentration und verwendeter Menge leichte bis schwere Reizungen am Kaninchenauge verursachen. Es ist jedoch nicht signifikant reizend für intakte Haut.
Das Einatmen von Ethanol kann zu Schleimhautreizungen, Erregung, Ataxie, Schläfrigkeit, Narkose und schließlich zum Tod durch Atemstillstand führen. Die tödlichen Konzentrationen für Mäuse, Meerschweinchen und Ratten liegen nach mehrstündiger Einwirkung zwischen 20.000 und 40.000 ppm. Konzentrationen unter 6000 ppm können im Allgemeinen ohne Vergiftungserscheinungen toleriert werden.
Die wiederholte orale Verabreichung von Ethanol an junge Ratten in einer Dosis von 10 g/kg/Tag über 12 Wochen führte zu geringer Gewichtszunahme und Leberverfettung. Bei Affen, die mit einer Diät gefüttert wurden, die 40 % der Gesamtkalorien aus Ethanol enthielt, wurden Störungen des Triglycerid-, Cholesterin- und Phospholipidstoffwechsels sowie Fettverfettung in Leber und Myokard beobachtet.
Die Verabreichung von Ethanol an trächtige Ratten in Konzentrationen von 5 ml/kg erhöhte die Embryoletalität und verzögerte die fetale Entwicklung. Es kam jedoch nicht zu schwerwiegenden Missbildungen beim Fötus.
Ethanoldosen von 1–1,5 g/kg verursachten dominante letale Mutationen bei männlichen Mäusen, jedoch nicht bei weiblichen Mäusen. Im Ames-Test zeigte Ethanol keine mutagene Aktivität. In menschlichen Fibroblastenkulturen wurde jedoch eine Zunahme von Chromatidbrüchen beobachtet, was wahrscheinlich eher eine zytotoxische Wirkung als ein Zeichen von Mutagenität ist.
Ethanol wird hauptsächlich in der Leber durch drei Enzymsysteme metabolisiert:
- Alkoholdehydrogenase
- Katalase, die als Peroxidase wirkt und mit einem System gekoppelt ist, das sauerstoffhaltiges Wasser liefert
- Ein mikrosomales Ethanol-oxidierendes System, das NADPH als Coenzym benötigt
Etwa 80 % des absorbierten Ethanols werden zunächst zu Acetaldehyd metabolisiert, gefolgt von einer weiteren Oxidation zu Essigsäure. Essigsäure wird dann zu Kohlendioxid und Wasser abgebaut. Die Oxidation von Acetaldehyd zu Essigsäure ist im Allgemeinen schneller als die Oxidation von Ethanol zu Acetaldehyd.
Die Aufnahme von Ethanol beim Menschen kann je nach Konzentration verschiedene Symptome hervorrufen, wie in Tabelle 2 aufgeführt. Die individuellen Reaktionen auf Ethanol können jedoch erheblich variieren.
| Symptom | Blutethanolkonzentration, % |
|---|---|
| Beginn der Unsicherheit | 0,06 - 0,08 |
| Langsame Auffassungsgabe | 0,10 |
| Betäubung | 0,11 - 0,15 |
| Trunkenheit | 0,16 |
| Schwere Intoxikation | 0,2 - 0,4 |
| Tod | 0,4 - 0,5 |
Bei Personen, die an Alkoholismus leiden, wird die Fettleberdegeneration häufig auf eine erhöhte Fettsäuresynthese aus Acetat, einen erhöhten Lipidtransport aus peripheren Fettdepots zur Leber und eine verringerte Fettsäureoxidation zurückgeführt.
Fettinfiltration des Myokards und chronische Leptomeningitis werden ebenfalls bei chronischem Alkoholismus berichtet und sind mit spezifischen Symptomen verbunden.
Die Expositionsgrenzwerte von ACGIH, OSHA und MAK für Ethanol liegen alle bei 1000 ppm (1900 mg/m³).
Referenzen
- Ethanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a09_587.pub2
- Ethanol; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0520080112150719.a01.pub2