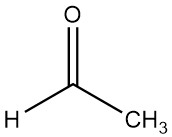
Acetaldehyd (Ethanal) mit der chemischen Formel CH3CHO wurde erstmals 1774 von SCHEELE beobachtet, als schwarzes Mangandioxid und Schwefelsäure mit Alkohol reagierten. Seine Zusammensetzung wurde später von LIEBIG im Jahr 1835 erklärt, der reines Acetaldehyd durch Oxidation von Ethanol mit Chromsäure erhielt.
Acetaldehyd ist eine flüchtige, leicht siedende und leicht entzündliche Flüssigkeit, die sich durch einen starken Geruch auszeichnet.
Aufgrund seiner bemerkenswerten chemischen Reaktivität spielt Acetaldehyd eine wichtige Rolle als Zwischenprodukt bei der Herstellung verschiedener Verbindungen, darunter Essigsäure, Essigsäureanhydrid, Ethylacetat, Peressigsäure, Butanol, 2-Ethylhexanol, Pentaerythrit, chlorierte Acetaldehyde (Chloral) und Glyoxal , Alkylamine, Pyridine und andere Chemikalien.
Seine erste kommerzielle Anwendung umfasste die Herstellung von Aceton durch Essigsäuresynthese, die zwischen 1914 und 1918 in Deutschland (Wacker-Chemie und Hoechst) sowie in Kanada (Shawinigan) stattfand.
Auch im Stoffwechsel von Pflanzen und Tieren kommt Acetaldehyd vor, wenn auch in geringen Mengen. Höhere Acetaldehydwerte können biologische Prozesse stören.
Es kommt natürlicherweise in Spuren während der alkoholischen Gärung vor und trägt zum Geschmack von Getränken wie Bier, Wein und Spirituosen bei. Darüber hinaus wurde Acetaldehyd in Pflanzensäften, ätherischen Ölen, geröstetem Kaffee und Tabakrauch nachgewiesen.
Zur Herstellung von Acetaldehyd werden verschiedene kommerzielle Methoden eingesetzt. Dazu gehören die Dehydrierung oder Oxidation von Ethanol, die Wasseraddition zu Acetylen, die partielle Oxidation von Kohlenwasserstoffen und die direkte Oxidation von Ethylen.
Inhaltsverzeichnis
2. Physikalische Eigenschaften von Acetaldehyd
Acetaldehyd mit der Summenformel C2H4O und einer Molmasse von 44,054 g/mol ist eine transparente Flüssigkeit mit einem starken und erstickenden Geruch. Beim Verdünnen verströmt es einen leicht fruchtigen Duft.
Acetaldehyd ist in Wasser und den meisten organischen Lösungsmitteln vollständig löslich. Es bildet keine Azeotrope mit Wasser, Methanol, Ethanol, Aceton, Essigsäure oder Benzol.
Es bildet jedoch binäre Azeotrope mit Butan (Siedepunkt -7 °C, enthält 84 Gew.-% Butan) und Diethylether (Siedepunkt 18,9 °C, enthält 23,5 Gew.-% Ether).
Nachfolgend sind einige physikalische Eigenschaften von Acetaldehyd aufgeführt:
- Siedepunkt bei 101,3 kPa = 20,16 °C
- Schmelzpunkt = -123,5 °C
- Kritische Temperatur = 181,5 °C
- Relative Dichte (t) = 0,8045-0,001325.t (t in °C)
- Brechungsindex (t) = 1,34240-0,0005635.t (t in °C)
- Viskosität der Flüssigkeit bei 20 °C = 0,21 mPa.s
3. Chemische Reaktionen und Verwendungen von Acetaldehyd
Acetaldehyd ist eine bemerkenswert reaktive Verbindung, die alle charakteristischen Reaktionen von Aldehyden zeigt, sowie solche, die mit einer Alkylgruppe verbunden sind, in der Wasserstoffatome durch die Anwesenheit einer Carbonylgruppe in der α-Position aktiviert werden.
Beim Erhitzen auf Temperaturen über 420 °C zersetzt sich Acetaldehyd, was zur Bildung von Methan und Kohlenmonoxid führt.
3.1. Additionsreaktionen
Acetaldehyd reagiert leicht mit Wasser und bildet ein instabiles Hydrat. Feste isolierbare Hydrate sind jedoch nur bei chlorierten Acetaldehyden bekannt. Alkohole können sich an Acetaldehyd addieren und Halbacetale bilden, die in Gegenwart von Säuren und anschließender Entfernung von Wasser in Kombination mit zusätzlichem Alkohol Acetale bilden können.
Diole führen zur Bildung zyklischer Acetale. Beispielsweise ergeben Ethylenglykol und Acetaldehyd 2-Methyl-1,3-dioxolan, während 1,3-Propandiol und Acetaldehyd 2-Methyl-1,3-dioxan ergeben.

Bei der Reaktion zwischen Acetaldehyd und wässriger Natriumbisulfitlösung entsteht ein kristallines Addukt, aus dem Acetaldehyd freigesetzt werden kann.
Trockenes Ammoniak reagiert mit Acetaldehyd, was zur Bildung von kristallinem Acetaldehydammoniak führt.
Acetaldehyd und Blausäure reagieren unter Bildung von Lactonitril (α-Hydroxypropionitril), einem potenziellen Zwischenprodukt bei der Herstellung von Acrylnitril.
Die Reaktion zwischen Acetaldehyd und Essigsäureanhydrid ergibt Ethylidendiacetat, ein Zwischenprodukt im Vinylacetat-Verfahren der Celanese Corp.
3.2. Derivate der Aldol-Addition
In Gegenwart alkalischer Katalysatoren oder bei milder Erwärmung verbinden sich zwei Moleküle Acetaldehyd zu Acetaldol. Bei höheren Temperaturen wird Wasser leicht aus Acetaldol abgespalten, was zur Bildung von Crotonaldehyd führt. Die industrielle Bedeutung der Weiterkondensation zu Aldehydharzen, beispielsweise synthetischem Schellack, hat jedoch abgenommen.
Harnstoff und Acetaldehyd können in Gegenwart von H2SO4 kondensieren, was zur Bildung von Crotonylidendiharnstoff (6-Methyl-4-ureidohexahydropyrimidin-2-on) führt, der als Langzeit-Stickstoffdünger genutzt wird.

Acetaldehyd dient als Zwischenprodukt bei der Synthese von Butadien. Es beginnt mit Acetylen und setzt sich über Acetaldol und sein Hydrierungsprodukt 1,3-Butandiol fort. Dieses Verfahren wurde Anfang des 20. Jahrhunderts eingeführt und wird in einigen osteuropäischen Ländern immer noch im kommerziellen Maßstab praktiziert.
Acrolein wird durch Aldolkondensation von Acetaldehyd und Formaldehyd mit anschließender Wasserabspaltung, ähnlich der Bildung von Crotonaldehyd, gewonnen. Dieser Methode mangelt es jedoch an zeitgenössischer kommerzieller Bedeutung.
Umgekehrt ist die Herstellung von Pentaerythrit aus Acetaldehyd und einer vierfachen Menge Formaldehyd in Gegenwart von Ca(OH)2 oder NaOH von großer industrieller Bedeutung.
3.3. Reaktion mit Stickstoffverbindungen
Primäre Amine reagieren mit Acetaldehyd unter Bildung von Schiffschen Basen, dargestellt als CH3CH=NR. Stickstoffverbindungen wie Hydroxylamin, Hydrazin, Phenylhydrazin und Semicarbazid können mit Acetaldehyd reagieren und leicht kristallisierbare Verbindungen ergeben, die für die analytische Bestimmung und Charakterisierung von Aldehyden verwendet werden.
Beispiele hierfür sind Semicarbazon (Schmelzpunkt 162–163 °C), p-Nitrophenylhydrazon (Schmelzpunkt 128,5 °C), 2,4-Dinitrophenylhydrazon (Schmelzpunkt 168 °C) und Oxim (Schmelzpunkt 47 °C).
Ähnliche Methoden können für die Charakterisierung anderer Aldehyde und Ketone eingesetzt werden, da ihre analogen Derivate im Allgemeinen unterschiedliche und genau definierte Schmelzpunkte besitzen.
Die Synthese von Pyridin und Pyridinderivaten hat zunehmend an Bedeutung gewonnen. 5-Ethyl-2-methylpyridin kann durch Reaktion von wässrigem Ammoniak mit Acetaldehyd in Gegenwart von Fluoridionen erhalten werden. Paraldehyd, das das Monomer nach und nach freisetzt, kann ebenfalls verwendet werden. In Gegenwart von Formaldehyd oder Acrolein entsteht ein Gemisch aus Pyridin und Alkylpyridinen.

3.4. Oxidation
Ein erheblicher Teil des kommerziell hergestellten Acetaldehyds wird bei der Herstellung von Essigsäure durch Oxidation mit Sauerstoff oder Luft verwendet.
Acetaldehydmonoperacetat ist ein Zwischenprodukt, das bei erhöhten Temperaturen und der Anwesenheit katalytischer Mengen an Eisen- oder Kobaltsalzen in Peressigsäure und Acetaldehyd zerfällt. In Gegenwart von Mn2+ -Salzen kann Essigsäure aus Acetaldehydmonoperacetat gewonnen werden. Darüber hinaus kann Essigsäureanhydrid durch den Einsatz von Co2+ und Cu2+ -Salzen gebildet werden.

Durch Oxidation mit Salpetersäure entsteht Glyoxal, während durch Halogenierung halogenierte Acetaldehyde hergestellt werden können.
Mono-, Di- und Trichloracetaldehyd sowie Tribromacetaldehyd (Bromal) finden Verwendung bei der Herstellung von Insektiziden (z. B. DDT, DDD), Pharmazeutika und Farbstoffen.
3.5. Die Ermäßigung
Acetaldehyd kann leicht zu Ethanol hydriert werden. Vor 1939, als in Europa petrochemisch hergestelltes Ethylen verfügbar wurde, wurde diese Reaktion industriell zur Herstellung von Ethanol aus Acetaldehyd und damit aus Acetylen eingesetzt.
Monoethylamin, Diethylamin und Triethylamin können aus Acetaldehyd, Ammoniak und Wasserstoff in Gegenwart eines Hydrierungskatalysators synthetisiert werden. Weitere Informationen finden Sie unter Herstellung aliphatischer Amine.
3.6. Verschiedene Reaktionen
Die Tischchenko-Reaktion von Acetaldehyd, katalysiert durch Aluminiumalkoholat, führt zur Produktion des kommerziell wichtigen Lösungsmittels Ethylacetat.
Acetaldehyd dient als „Radikalfänger“ bei der Polymerisation von Vinylverbindungen und kontrolliert die Kettenlänge der Polymere.
3.7. Polymere von Acetaldehyd
3.7.1. Paraldehyd
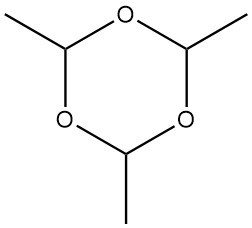
Paraldehyd, 2,4,6-Trimethyl-1,3,5-trioxan mit einem Molekulargewicht von 132,161, ist ein zyklisches Trimer von Acetaldehyd. Es hat ein farbloses Aussehen und verströmt einen ätherischen, durchdringenden Geruch.
Paraldehyd kann aus Acetaldehyd in Gegenwart saurer Katalysatoren wie Schwefelsäure, Phosphorsäure, Salzsäure oder sauren Kationenaustauschern synthetisiert werden. In einer homogenen Reaktion wird Acetaldehyd unter Rühren und Kühlen zu Paraldehyd mit einer geringen Menge Schwefelsäure gegeben.
Nach Beendigung wird weiter gerührt, um das Gleichgewicht herzustellen, und die Schwefelsäure wird präzise mit einem Natriumsalz wie Natriumacetat, Natriumcarbonat oder Natriumbicarbonat neutralisiert. Durch fraktionierte Destillation wird das Reaktionsgemisch in Acetaldehyd, Wasser und Paraldehyd getrennt.
Bei der kontinuierlichen Produktion wird flüssiges Acetaldehyd bei Temperaturen von 15 – 20 °C oder Acetaldehyddampf bei Temperaturen von 40 – 50 °C über einen sauren Kationenaustauscher geleitet, wodurch eine Umwandlungsrate von über 90 % erreicht wird. Anschließend wird Destillation eingesetzt, um Acetaldehyd von Paraldehyd zu trennen.
Bei der Depolymerisation erfolgt die langsame Destillation von Acetaldehyd in Gegenwart saurer Katalysatoren. Alternativ kann Paraldehyd in der Gasphase mithilfe von Katalysatoren wie HCl, HBr, H3PO4 oder Kationenaustauschern zersetzt werden. Die Depolymerisationsreaktion folgt einer Geschwindigkeit erster Ordnung.
Paraldehyd findet in der chemischen Synthese als Quelle für Acetaldehyd Anwendung und eliminiert Harzbildung und andere Sekundärreaktionen. Diese Synthese wird bei der Herstellung von Pyridinen und der Chlorierung von Chloral genutzt.
Zwischen 1939 und 1945 wurde Paraldehyd als Kraftstoff verwendet.
3.7.2. Metaldehyd

Metaldehyd ist das zyklische Tetramer von Acetaldehyd. Es bildet tetragonale Prismen mit einem Schmelzpunkt von 246,2 °C (geschlossene Kapillare) und einer Sublimationstemperatur von 115 °C. Die Verbrennungswärme bei konstantem Volumen beträgt 3370 kJ/mol.
Metaldehyd ist in Wasser, Aceton, Essigsäure und Schwefelkohlenstoff unlöslich.
Die Depolymerisation von Metaldehyd zu Acetaldehyd beginnt bei 80 °C und ist oberhalb von 200 °C abgeschlossen. Im Depolymerisationsprozess werden saure Katalysatoren wie verdünntes H2SO4 oder H3PO4 verwendet.
Metaldehyd zeigt nicht die typische Reaktivität von Acetaldehyd. Es wird durch Ammoniumcarbonat oder andere schwach basische Verbindungen stabilisiert, die potenziell saure Katalysatoren neutralisieren.
Metaldehyd entsteht neben erheblichen Mengen Paraldehyd bei der Polymerisation von Acetaldehyd in Gegenwart von HBr und Erdalkalimetallbromiden wie CaBr2 bei Temperaturen unter 0 °C.
Allerdings liegen die Renditen selten über 8 %. Höhere Ausbeuten von 14 – 20 % wurden berichtet, wenn 7 – 15 % eines aliphatischen oder cyclischen Ethers bei Temperaturen im Bereich von 0 bis 20 °C vorhanden sind. Anschließend wird unlöslicher Metaldehyd abfiltriert.
Aus dem Filtrat wird dann nach der Depolymerisation des Paraldehyds Acetaldehyd abdestilliert und kann wieder in den Polymerisationsprozess zurückgeführt werden. Allerdings führt diese Rückführung großer Acetaldehydmengen aufgrund von Verlusten zu erhöhten Prozesskosten.
Metaldehyd in Pelletform ist als Trockenbrennstoff (Meta) im Handel erhältlich. In Kombination mit Ködern wird Metaldehyd als Molluskizid eingesetzt.
3.7.3. Polyacetaldehyd
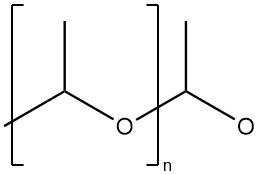
Polyacetaldehyd ist ein hochmolekulares Polymer mit Acetalstruktur (Polyoxymethylenstruktur).
Durch den Einsatz kationischer Initiatoren wird überwiegend ein amorphes Polymer erhalten. Dabei werden Temperaturen unter -40 °C bevorzugt. Oberhalb von -30 °C entstehen hauptsächlich Paraldehyd und Metaldehyd.
Die Initiatoraktivität hängt auch vom verwendeten Lösungsmittel ab. Zu geeigneten Initiatoren gehören H3PO4 in Ether und Pentan sowie HCl, HNO3, CF3COOH, AlCl3 in Ether und insbesondere BF3 in flüssigem Ethylen. Auch Al2O3 und SiO2 scheinen gute Initiatoren zu sein.
Das Polymer hat eine gummiartige Konsistenz und ist in gängigen organischen Lösungsmitteln löslich. Es depolymerisiert bei Raumtemperatur und setzt Acetaldehyd frei. Es verdunstet innerhalb weniger Tage oder Wochen vollständig. Saure Verbindungen beschleunigen die Depolymerisation und Amine (z. B. Pyridin) stabilisieren Polyacetaldehyd bis zu einem gewissen Grad.
3.8. Verbrauch
In den Vereinigten Staaten wurde Acetaldehyd ab 1993 nicht mehr in den Herstellungsprozessen von Essigsäure, Butanol und 2-Ethylhexanol eingesetzt, da für deren Herstellung nun alternative Methoden eingesetzt werden.
Allerdings ist die Nachfrage nach Acetaldehyd auch für andere Stoffe wie Peressigsäure und Pyridinbasen gestiegen.
Verbrauch von Acetaldehyd (t) im Jahr 2003
| Produkte | Verbrauch (t) |
|---|---|
| Essigsäure/Essigsäureanhydrid | 147,000 |
| Acetatester | 321,000 |
| Pentaerythrit | 80,000 |
| Pyridin und Pyridinbasen | 83,000 |
| Peressigsäure | 23,000 |
| 1,3-Butylenglykol | 14,000 |
| Andere | 98,000 |
Referenz
- Acetaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2




