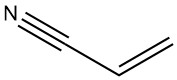
Acrylnitril, eine zentrale Verbindung in der chemischen Industrie, dient als entscheidendes Zwischenprodukt für eine Vielzahl von Produkten. Es hat verschiedene Namen, darunter 2-Propennitril, Propennitril, Acrylsäure-Nitril, Propylen-Nitril, Vinylcyanid und Propensäure-Nitril. Seine chemische Formel C3H3N entspricht einer Molekülmasse von 53,064.
Bei der kommerziellen Synthese von Acrylnitril kommt der Propylen-Ammoxidationsprozess zum Einsatz, der auch als SOHIO-Prozess bekannt ist. Diese erstmals 1960 eingeführte Methode beinhaltet die Reaktion von Propylen, Ammoniak und Sauerstoff unter Verwendung eines heterogenen Katalysators:
C3H6 + NH3 + 1,5 O2 → C3H3N + 3 H2O
Vor der Entdeckung des Propylen-Ammoxidationsverfahrens wurde Acrylnitril überwiegend durch das Ethylencyanhydrin-Verfahren hergestellt.
Die Implementierung des SOHIO-Prozesses führte zu einer erheblichen Reduzierung der Produktionskosten von Acrylnitril, was zu einem erheblichen Anstieg der Nachfrage nach dieser Verbindung in einem breiten Spektrum chemischer und Polymerprodukte führte.
Acrylfasern bleiben die Hauptanwendung für Acrylnitril, während auch die Märkte für Acrylnitril-Butadien-Styrol-Harze (ABS), Adipodinitril und Acrylamid ein schnelles Wachstum verzeichneten. Damit liegt die weltweite jährliche Produktionskapazität für Acrylnitril mittlerweile bei über 5 Millionen t/a.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Acrylnitril
Acrylnitril ist bei Raumtemperatur eine klare, farblose Flüssigkeit. Dieses Molekül besitzt aufgrund der elektronegativen funktionellen Nitrilgruppe, die mit einer Kohlenstoff-Kohlenstoff-Doppelbindung konjugiert ist, einen polaren Charakter.
In Bezug auf die Löslichkeit zeigt Acrylnitril eine Mischbarkeit mit mehreren organischen Lösungsmitteln wie Aceton, Benzol, Tetrachlorkohlenstoff, Diethylether, Ethylacetat, Ethylencyanhydrin, Petrolether, Toluol, bestimmten Kerosinen und Methanol.
In der folgenden Tabelle sind einige physikalische Eigenschaften von Acrylnitril aufgeführt.
| Eigenschaft | Wert |
|---|---|
| Molmasse | 53,064 g/mol |
| Dichte | 0,81 g/cm³ |
| Schmelzpunkt | -83,5 °C |
| Siedepunkt | 77,3 °C |
| Brechungsindex | 1,391 |
| Mischbarkeit in Wasser | 7,30 Gew.-% |
| Viskosität | 0,35 cP (bei 20 °C) |
| Kritischer Druck | 35,3 MPa |
| Kritische Temperatur | 245,8 °C |
| Selbstentzündungstemperatur | 481 °C |
2. Chemische Reaktivität von Acrylnitril
Die charakteristische chemische Reaktivität von Acrylnitril beruht auf der Anwesenheit zweier reaktiver Stellen, nämlich der Kohlenstoff-Kohlenstoff-Doppelbindung und der funktionellen Nitrilgruppe.
Die wichtigsten chemischen Reaktionen, denen es unterliegt, sind Polymerisation und Hydratation. Acrylnitril polymerisiert leicht und exotherm in Abwesenheit eines Hydrochinon-Inhibitors, insbesondere unter Lichteinwirkung.
Dieser Polymerisationsprozess wird durch freie Radikale, Redoxkatalysatoren oder Basen initiiert und kann in der flüssigen, festen oder gasförmigen Phase stattfinden. Die Flüssigphasenpolymerisation eignet sich besonders zur Herstellung von Homo- und Copolymeren.
Wenn Acrylnitril mit Schwefelsäure hydratisiert wird, bildet es Acrylamidsulfat (C3H5NO·H2SO4), das durch Neutralisation mit einer Base in Acrylamid (C3H5NO) umgewandelt werden kann und die vollständige Hydratisierung zur Bildung von Acrylsäure (C3H4O2) führt.
Acrylamid kann auch direkt aus Acrylnitril durch teilweise Hydratation mit Katalysatoren auf Kupferbasis erzeugt werden, was zum bevorzugten kommerziellen Weg für die Acrylamidproduktion geworden ist.
Industriell wichtige Acrylester entstehen durch die Reaktion von Acrylamidsulfat mit organischen Alkoholen.
Bei der kommerziellen Herstellung von Methylacrylat (C4H6O2) wird Acrylamidsulfat mit Methanol versetzt.
Darüber hinaus nimmt Acrylnitril an anderen Reaktionen teil, einschließlich der Diels-Alder-Addition an Diene, was zu zyklischen Produkten führt.
Die Hydrierung an Metallkatalysatoren ergibt Propionitril (C3H5N) und Propylamin (C3H9N). Darüber hinaus ist eine bedeutende industrielle Reaktion die Hydrodimerisierung von Acrylnitril unter Bildung von Adiponitril (C6H8N2).
Darüber hinaus kann Acrylnitril eine Halogenaddition an die Doppelbindung eingehen, um Dihalogenpropionitrile zu erzeugen. Es nimmt auch an Cyanoethylierungsreaktionen mit Alkoholen, Aldehyden, Estern, Amiden, Nitrilen, Aminen, Sulfiden, Sulfonen und Halogeniden teil.
3. Herstellung von Acrylnitril
Acrylnitril wird industriell durch einen von SOHIO entwickelten katalytischen Dampfphasenprozess namens Propylenammoxidation hergestellt. Das Verfahren nutzt einen Wirbelschichtreaktor, in dem Propylen, Ammoniak und Luft mit einem festen Katalysator bei Temperaturen von 400–510 °C und Drücken von 50–200 kPa Überdruck reagieren.
Die Reaktion erfolgt in einem Durchgang mit einer Propylenumwandlung von etwa 98 %. Hochselektive Katalysatoren führten zu einem geringeren Propylenverbrauch von etwa 1,1 kg pro Kilogramm produziertem Acrylnitril.
Neben Acrylnitril liefert das Verfahren nützliche Nebenprodukte wie HCN (wird bei der Herstellung von Methylmethacrylat und Natriumcyanid verwendet) und Acetonitril (ein wertvolles Lösungsmittel in pharmazeutischen und industriellen Anwendungen).
Bei der kommerziellen Produktion von Acrylnitril wird der heiße Reaktorausfluss in einem Gegenstromabsorber mit Wasser gekühlt und nicht umgesetztes Ammoniak mit Schwefelsäure neutralisiert. Das entstehende Ammoniumsulfat wird zurückgewonnen und als Dünger verwendet.

a) Wirbelschichtreaktor; b) Gegenstromabsorber; c) Rückgewinnungssäule; d) Zweite Rückgewinnungskolonne; e) Fraktionierungsspalten
Das Absorberabgas, das N2, CO, CO2 und nicht umgesetztes Propylen enthält, wird entweder direkt abgelassen oder durch eine Verbrennungsanlage geleitet, um Kohlenwasserstoffe und CO zu verbrennen. Die acrylnitrilhaltige Lösung wird dann in Rückgewinnungskolonnen verarbeitet, um rohes Acrylnitril und rohes Acetonitril zu erhalten , mit weiterer Reinigung für Acrylnitril in Acrylfaserqualität.
Die kommerzielle Realisierbarkeit der Acrylnitrilproduktion aus Propylen und Ammoniak wurde 1959 erreicht, als SOHIO einen Katalysator mit hoher Selektivität für Acrylnitril entwickelte. Verbesserungen im Laufe der Jahre waren hauptsächlich auf die Entwicklung neuer Katalysatoren mit höheren Acrylnitrilausbeuten aus Propylen zurückzuführen.
Mehrkomponentige gemischte Metalloxide, hauptsächlich auf der Basis von Wismut-Molybdänoxid, waren die Schlüsselkatalysatoren, wobei durch den Einbau von Eisen, Kobalt, Nickel und Alkalimetallen verschiedene Verbesserungen erzielt wurden.
Vorherrschend sind Molybdat-basierte Katalysatoren, kommerziell werden aber auch Antimonat-Katalysatoren eingesetzt. Die Forschungsanstrengungen konzentrierten sich auf das Verständnis der Oberflächenreaktionschemie und der Festkörpermechanismen von Katalysatoren auf Wismutmolybdatbasis.
Kinetische Studien haben gezeigt, dass der geschwindigkeitsbestimmende Schritt die Abstraktion eines Wasserstoffatoms von Propylen unter Bildung eines p-Allylkomplexes auf der Oberfläche beinhaltet, was zur Bildung von Acrolein und letztendlich Acrylnitril führt.
Verschiedene Techniken wie Raman-spektroskopische Analyse, Röntgen, Neutronenbeugung, Röntgenabsorptionsspektroskopie, Pulskinetikstudien und Untersuchungen von Sondenmolekülen haben zu einem tieferen Verständnis der komplexen Festkörper- und Oberflächenmechanismen von Propylen geführt Ammoxidation über Bismutmolybdat-basierte Katalysatoren.
4. Verwendung von Acrylnitril
Acrylnitril findet bedeutende Endanwendungen in verschiedenen Branchen, darunter Acrylfasern, Acrylnitril-Butadien-Styrol-Harze (ABS), Adipodinitril, Acrylamid, Nitrilkautschuk und Kohlenstofffasern. Unter diesen Anwendungen ist Acrylfaser die größte kommerzielle Verwendung.
| Produkt | % |
|---|---|
| Acrylfaser | 42 |
| ABS-Harze | 34 |
| Adiponitril | 8 |
| Acrylamid | 7 |
| Nitrilkautschuk | 5 |
| Kohlefaser | 2 |
| Andere | 2 |
Es wird jedoch erwartet, dass ABS und Acrylamid die am schnellsten wachsenden Anwendungen für Acrylnitril sein werden, wobei auch Kohlenstofffasern auf dem Vormarsch sind, insbesondere in hochfesten und leichten Anwendungen in der Luftfahrt- und Automobilindustrie.
Acrylfasern werden hauptsächlich bei der Herstellung von Bekleidung und Heimtextilien verwendet. Allerdings hat sich das Marktwachstum im Vergleich zu anderen Anwendungen von Acrylnitril verlangsamt, da ein Großteil der Produktionskapazität für Acrylfasern von den USA und Europa nach Asien, insbesondere nach China, verlagert wurde.
ABS, ein spezielles Hochleistungspolymer, erfreut sich aufgrund seiner hervorragenden Festigkeit, Farbeigenschaften und einfachen Verarbeitung zunehmender Beliebtheit. Es findet Anwendung in verschiedenen Branchen, darunter Automobil, Bauwesen, Haushaltsgeräte und Elektronik. SAN-Copolymere sind für ihre optische Transparenz bekannt und werden unter anderem in Verpackungen, optischen Fasern und Lebensmittelbehältern eingesetzt.
Adiponitril dient als Rohstoff für die Herstellung von Hexamethylendiamin (HMDA, C6H16N2) durch Elektrohydrodimerisierung. HMDA wird dann zur Herstellung von Nylon-6,6 verwendet.
Acrylamid wird durch einen kupferkatalysierten Prozess aus Acrylnitril hergestellt. Nach der Polymerisation findet es umfangreiche Verwendung in der Abwasserbehandlung, der Ölförderung, der Mineralverarbeitung und der Papierherstellung.
Nitrilkautschuke, bei denen es sich um Butadien-Acrylnitril-Copolymere handelt, werden in der Industrie wegen ihrer Chemikalien-, Öl- und Ozonbeständigkeit sowie ihrer hervorragenden Flexibilität, Stabilität und Hitzebeständigkeit hoch geschätzt. Sie werden häufig bei der Herstellung von Dichtungen, Dichtungen, Schläuchen, Riemen und Ummantelungen von Elektrokabeln verwendet.
5. Toxikologie und Arbeitsmedizin
Acrylnitril birgt erhebliche Toxizitätsrisiken, wenn es verschluckt, eingeatmet oder über die Haut aufgenommen wird. In flüssiger oder konzentrierter Dampfform ist es ätzend und kann Hautverbrennungen verursachen, die Verbrennungen zweiten Grades ähneln.
Eine übermäßige Einwirkung seiner Dämpfe kann zu schweren Reizungen der Bindehaut und der Atemwege sowie zu Symptomen wie Kopfschmerzen, Übelkeit, Erbrechen, Schwäche und Schwindel führen.
Eine längere Exposition kann zu Schläfrigkeit, Krampfanfällen, Halluzinationen, Bewusstlosigkeit und sogar zum Tod führen. Das Einsetzen dieser toxischen Wirkungen kann sich verzögern und einige Minuten bis mehrere Stunden nach der Exposition eintreten.
Darüber hinaus gilt Acrylnitril als mutmaßlich krebsgefährdend, wobei das Krebsrisiko von der Höhe und Dauer der Exposition abhängt. In-vitro-Studien haben schwache mutagene Eigenschaften gezeigt, während In-vivo-Studien diesen Effekt nicht bestätigten.
Studien an Tieren haben schädliche Auswirkungen auf die Entwicklung und Fortpflanzung des Fötus gezeigt, wenn es toxischen Mengen Acrylnitril ausgesetzt wird. Bei Tieren wurden embryotoxische und teratogene Wirkungen beobachtet, wenn ihre Mütter hohen Dosen ausgesetzt waren.
Studien, die an Acrylnitril-Arbeitern in China durchgeführt wurden, berichteten über unerwartet hohe Raten von Auswirkungen auf die Fortpflanzung und eine abnormale Entwicklung des Fötus. Die Zuverlässigkeit dieser Studien wurde jedoch aufgrund von Unsicherheiten hinsichtlich der Datenerhebungsmethode, der Exposition gegenüber Chemikalien, sozialen Einflüssen und Lebensstileinflüssen sowie Unstimmigkeiten mit anderen Informationen in Frage gestellt.
Epidemiologische Studien zum Zusammenhang zwischen Acrylnitril-Exposition und bestimmten Tumoren haben keine eindeutigen Beweise geliefert.
Obwohl Daten über die berufsbedingte Exposition von Menschen keinen eindeutigen Zusammenhang zwischen Acrylnitril und Krebs erkennen lassen, ist es dennoch ratsam, Acrylnitril als potenzielles Karzinogen zu behandeln. Die Expositionswerte sollten minimiert und der Kontakt mit flüssigem Acrylnitril vermieden werden.
Bei der Verbrennung entstehen bei Acrylnitril hochgiftige Nebenprodukte, darunter Blausäure, Stickstoffdioxid und Kohlenmonoxid.
Zum Schutz der Arbeitnehmer stuft die Arbeitsschutzbehörde der Vereinigten Staaten Acrylnitril als krebsgefährlich ein (29 CFR 1910.1045). Der zulässige Expositionsgrenzwert (PEL) ist auf 2 ppm in der Luft festgelegt, gemittelt über einen Zeitraum von 8 Stunden (zeitgewichteter Durchschnitt – TWA).
Der Höchstwert (CL) beträgt durchschnittlich 10 ppm über einen Zeitraum von 15 Minuten. Der Geruch von Acrylnitril ist ein schlechtes Warnsignal für eine Exposition, da seine Geruchsschwelle im Bereich von 13 bis 20 ppm liegt, was deutlich über sowohl dem PEL als auch dem CL liegt.
Die Toxizitätswerte für Acrylnitril wurden wie folgt definiert:
- Orale Toxizität: Ratte LD50 81 mg/kg
- Inhalationstoxizität: Ratte LC50 557 ppm/4 h, 946 ppm/4 h (durch Nase/Nebenhöhlen); Ratte LCL0 > 1008 ppm/1 h
- Dermale Toxizität: Kaninchen LD50 226–250 mg/kg
Referenz
- Acrylonitrile; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_177.pub3
FAQ zu Acrylnitril
Acrylnitril ist eine chemische Verbindung mit der chemischen Formel C3H3N. Es ist bei Raumtemperatur eine klare, farblose Flüssigkeit und besitzt eine funktionelle Nitrilgruppe, die an eine Kohlenstoff-Kohlenstoff-Doppelbindung gebunden ist. Acrylnitril ist ein wesentliches Zwischenprodukt in der chemischen Industrie und dient als Baustein für verschiedene Produkte.
Acrylnitril wird kommerziell durch einen katalytischen Dampfphasenprozess namens Propylenammoxidation hergestellt. Dieser Prozess beinhaltet die Reaktion von Propylen, Ammoniak und Luft an einem festen Katalysator bei bestimmten Temperaturen und Drücken. Das resultierende Acrylnitril wird dann abgetrennt und für verschiedene Anwendungen gereinigt.
Acrylnitril findet vielfältige Anwendungen in verschiedenen Branchen. Zu seinen Hauptanwendungen zählen die Herstellung von Acrylfasern, Acrylnitril-Butadien-Styrol (ABS)-Harzen, Adiponitril (ein Vorläufer für Nylon-6,6), Acrylamid (zur Verwendung in der Abwasserbehandlung und anderen industriellen Prozessen), Nitrilkautschuk (für Dichtungen, Dichtungen, Schläuche usw.) und Kohlenstofffasern (verwendet in hochfesten, leichten Anwendungen in der Luft- und Raumfahrt- und Automobilindustrie).
Acrylnitril wird hauptsächlich über einen radikalischen Polymerisationsweg polymerisiert. Es polymerisiert leicht in Gegenwart von Initiatoren wie freien Radikalen, Redoxkatalysatoren oder Basen. Die Polymerisation kann in flüssiger, fester oder gasförmiger Phase erfolgen, wobei die Flüssigphasenpolymerisation die bevorzugte Methode zur Herstellung von Homo- und Copolymeren ist.
Nein, Acrylnitril ist selbst kein Polymer; es ist ein Monomer. Es ist jedoch ein wichtiger Baustein bei der Herstellung verschiedener Polymere, darunter Polyacrylnitril (PAN), das die Vorstufe für Kohlenstofffasern ist, und anderer Copolymere, die in Kunststoffen und synthetischen Fasern verwendet werden.
Acrylnitril ist giftig, wenn es verschluckt, eingeatmet oder über die Haut aufgenommen wird. In flüssiger oder konzentrierter Dampfform ist es ätzend und verursacht Hautverbrennungen, die Verbrennungen zweiten Grades ähneln. Das Einatmen seiner Dämpfe kann zu schweren Reizungen der Bindehaut und der Atemwege sowie zu Symptomen wie Kopfschmerzen, Übelkeit, Erbrechen, Schwäche und Schwindel führen. Eine längere Exposition kann schwerwiegendere Auswirkungen haben, darunter Schläfrigkeit, Krampfanfälle, Halluzinationen, Bewusstlosigkeit und sogar den Tod. Acrylnitril gilt ebenfalls als mutmaßlich krebsgefährdend und es sollten Vorsichtsmaßnahmen getroffen werden, um die Exposition zu minimieren.


