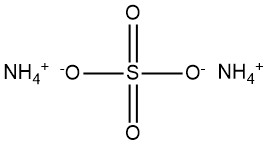
Ammoniumsulfat, (NH4)2SO4, entwickelte sich im 19. Jahrhundert zu einer bedeutenden Verbindung, die aus Ammoniak im Koksofengas hergestellt wurde. Zu Beginn des 20. Jahrhunderts gewann die industrielle Synthese von Ammoniak an Bedeutung, was zur Einführung von Ammoniumsulfat als Düngemittel führte.
Im Laufe der Zeit hat seine Bedeutung jedoch aufgrund des Aufkommens wirksamerer Düngemittel auf Stickstoffbasis abgenommen. Bemerkenswert ist, dass seine Anwendung für bestimmte industrielle Anwendungen in kleinerem Maßstab fortbesteht.
Seit etwa 1960 wird Ammoniumsulfat als Nebenprodukt in organischen Syntheseverfahren zunehmend produziert. In bestimmten Regionen wird Ammoniumsulfat aus Gips hergestellt.
Inhaltsverzeichnis
1. Eigenschaften von Ammoniumsulfat
Ammoniumsulfat mit einer Molmasse von 132,14 g/mol weist bei 20 °C eine Dichte von 1,77 g/cm³ sowie eine durchschnittliche spezifische Wärmekapazität von 1,423 J/g·K im Temperaturbereich von 2 bis 55 °C auf .
Seine Kristallstruktur ist rhombisch-bipyramidal. Bemerkenswert ist, dass die Größe und Form der Kristalle durch in der Kristallisationslösung vorhandene Substanzen beeinflusst werden kann, und dieser Aspekt ist für die kommerzielle Produktion von Bedeutung.
Das thermische Verhalten von Ammoniumsulfat ist kompliziert. Bei Atmosphärendruck kann es nicht ohne Zersetzung geschmolzen werden, was zur Freisetzung von Ammoniak und zur Bildung von Bisulfat führt.
Bei reinem wasserfreiem Ammoniumsulfat bleibt der Dampfdruck von Ammoniak jedoch praktisch Null, bis 80 °C erreicht sind. Beim Überschreiten von 300 °C führt die Zersetzung neben Ammoniak zur Bildung von N2, SO2, SO3 und H2O.
Ammoniumsulfat bildet keine Hydrate. Die Wärmeänderung beim Auflösen von 1 Mol des Salzes in 400 Mol Wasser beträgt +9,92 kJ bei 18 °C, während die integrale Lösungswärme bei +6,57 kJ/mol bei 30 °C liegt. Die differenzielle Lösungswärme einer gesättigten Lösung beträgt +6,07 kJ/mol bei 30 °C.
Ammoniumsulfat zerfließt erst ab einer relativen Luftfeuchtigkeit von 80 % und kann daher an trockener Luft gelagert werden. Durch die Zugabe von Ammoniak wird die Löslichkeit erheblich verringert.
Bei 10 °C sinkt die Löslichkeit von 73 g (NH4)2SO4 in 100 g Wasser auf etwa 18 g Salz in 100 g einer 24,5 %igen wässrigen Ammoniaklösung.
Die Löslichkeit von Calciumsulfat in Ammoniumsulfatlösung ist etwa doppelt so hoch wie die Löslichkeit in Wasser. Diese Eigenschaft unterstützt die Reaktion von Gips oder Anhydrit mit Lösungen, die Ammoniumcarbonat – Ammoniumsulfat – enthalten.
Die Verbindung bleibt in typischen organischen Lösungsmitteln unlöslich. Die Auflösung von Ammoniumsulfat in Ethanol, Propanol, Butanol, Aceton, Pyridin und ähnlichen Lösungsmitteln führt zur Bildung von zwei unterschiedlichen Phasen: einer wässrigen Phase und einer organischen Lösungsmittelphase.
Ammoniumsulfatlösungen und deren Lösungen in Schwefelsäure korrodieren speziellen Cr-Ni-Edelstahl nicht. Eisen und Aluminium bleiben in ammoniakalischen Lösungen unreaktiv. In Fällen, in denen die Lösungen korrosive Substanzen für Edelstahl enthalten (z. B. Cl−), können Behälter durch Auskleidung mit säurebeständigen Steinen geschützt werden.
2. Herstellung von Ammoniumsulfat
Ammoniumsulfat wird industriell hergestellt aus:
- Koksofengas
- Ammoniak und Schwefelsäure
- Organische Synthesen, etwa die Herstellung von Caprolactam
- Gips, Ammoniak und Kohlendioxid
2.1. Aus Kokereigas
Die Nutzung von Kokereigas als Vorprodukt für die Ammoniumsulfatproduktion ist in den letzten Jahrzehnten erheblich zurückgegangen. Dieser Trend ist auf die teilweise Schließung von Stahlwerken und Fortschritte bei den Verkokungsverfahren zurückzuführen, die geringere Mengen an Ammoniumsulfat liefern.
Bei der direkten Methode wird unbehandeltes Koksofengas in Schwefelsäure eingeleitet, wodurch Ammoniumsulfat entsteht, das mit pigmentierten Teerderivaten verunreinigt ist.
Alternativ besteht das indirekte Verfahren darin, Ammoniak aus Koksofengas durch Waschen mit Wasser zu extrahieren, es anschließend mithilfe einer Kalksuspension freizusetzen und mit Schwefelsäure zu kombinieren.
2.2. Aus Ammoniak und Schwefelsäure
Die bei der Reaktion zwischen Ammoniak und Schwefelsäure entstehende Wärme kann Wasser effektiv verdampfen, wenn die Säurekonzentration 70 % übersteigt. Die Reaktion stellt sich wie folgt dar:
2NH3(g) + H2SO4(l) → (NH4)2SO4(s) ΔH = -274 kJ/mol
In der heutigen Praxis findet die Reaktion in Sättigern statt, Geräten, die von früher verwendeten Verdampfungskristallisatoren abgeleitet sind. Der Sättigerprozess integriert Neutralisation und Kristallisation in einem einzigen Gerät.
Auf der Saugseite wird Schwefelsäure eingeleitet, auf der Druckseite einer Zwangsumlaufpumpe wird Ammoniak zugegeben. Die resultierende metastabile Lösung ergibt bei der Kristallisation Partikel mit einer Größe von 0,5 bis 3 mm.
Kontinuierliche Austrags-, Zentrifugations-, Trocknungs- und Kühlprozesse erleichtern die Isolierung von Ammoniumsulfat. Um das Kristallwachstum zu erleichtern, werden geringe Mengen Phosphorsäure, Harnstoff oder anorganische Salze zugesetzt.
2.3. Nebenprodukt in organischen Synthesen
Ammoniumsulfat entsteht als Nebenprodukt bei der Synthese synthetischer Faserzwischenprodukte wie Caprolactam, Acrylnitril und Methylmethacrylat sowie bei der Produktion von Ameisensäure und Acrylamid.
Die wichtige Quelle ist die Caprolactam-Produktion, die für die Nylon-6-Synthese von entscheidender Bedeutung ist. Herkömmliche Caprolactam-Verfahren liefern 2,5 – 4,5 Tonnen Ammoniumsulfat pro Tonne Lactam. Durch kürzlich von verschiedenen Unternehmen entwickelte Verfahren ist es gelungen, diesen Bereich auf 1,7 – 1,8 Tonnen pro Tonne Lactam zu reduzieren.
2.4. Aus Gips
Sowohl Anhydrit als auch Gips reagieren mit NH3 und CO2:
CaSO4(·2H2O) + (NH4)2CO3 → (NH4)2SO4 + CaCO3(·2H2O)
Dieses von BASF im Ersten Weltkrieg eingeführte Verfahren ist in Regionen mit begrenztem Zugang zu Schwefelsäure, darunter Indien, Pakistan und die Türkei, nach wie vor von Bedeutung. Fein gemahlener Gips wird in einer Rührkesselkaskade einer Ammoniumcarbonatlösung ausgesetzt.
Das Reaktionsgemisch, bestehend aus Calciumcarbonat und Ammoniumsulfatlösung, wird über Rotationsvakuumfilter filtriert. Das resultierende gewaschene Calciumcarbonat wird zur Düngung von Kalk, zur Herstellung von Calcium-Ammonsalpeter, als Rohstoff für Glas oder als Füllstoff für Gummi oder PVC verwendet.
Die leicht trübe Ammoniumsulfatlösung wird mittels Filterpressen filtriert, anschließend mit H2SO4 angesäuert und durch mehrstufige Verdampfungskristallisatoren zu grobkörnigem Ammoniumsulfat verarbeitet.
Bei einer alternativen Technik, dem Continental Engineering Process, werden NH3 und CO2 direkt in einen Gipsbrei in einem hohen, zylindrischen Rührgefäß eingebracht.
2.5. Andere Prozesse
Mehrere Methoden, die SO2 und Luftsauerstoff verwenden, sind veraltet.
Es besteht ein wachsendes Interesse an Verfahren, bei denen Ammoniak zur Entfernung von SO2 aus Kraftwerksabgasen eingesetzt wird, wie beispielsweise das Walther-Verfahren, bei dem staubfreie Abgase in zwei Stufen gewaschen werden, um eine konzentrierte Ammoniumsulfitlösung zu erzeugen. Diese Lösung wird anschließend mit Luftsauerstoff oxidiert und zu Ammoniumsulfat-Pulver sprühgetrocknet, das später granuliert wird.
3. Verwendung von Ammoniumsulfat
Ammoniumsulfat wird überwiegend als Düngemittel eingesetzt, die industrielle Nutzung ist minimal. In Industrienationen entsteht Ammoniumsulfat typischerweise als Koppel- oder Nebenprodukt und wird vor allem in Entwicklungsregionen hauptsächlich als Düngemittel verkauft.
Sein begrenzter Stickstoffgehalt in Industrienationen trägt im Vergleich zu anderen stickstoffbasierten Düngemitteln zu höheren Transportkosten pro Stickstoffeinheit bei.
In Afrika und Asien hat Ammoniumsulfat eine wichtige Funktion bei der Düngung von Reis-, Tee- und Gummipflanzen. In Regionen wie Europa, den Vereinigten Staaten und Brasilien ist es jedoch häufig Bestandteil von Misch- und Mehrnährstoffdüngern.
In der Industrie wird (NH4)2SO4 zur Synthese von Persulfaten, Flammschutzmitteln und Feuerlöschpulvern verwendet.
Es zeigt seine Nützlichkeit bei Bräunungsprozessen sowie in Branchen wie der Fotografie, Textil- und Glasproduktion. Außerdem dient Ammoniumsulfat als Nährstoffquelle für Hefe- und Bakterienkulturen.
Verweise
- Ammonium Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
- Industrial Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128498910000035
FAQ
Ammoniumsulfat (AS) ist eine chemische Verbindung bestehend aus Stickstoff, Wasserstoff, Schwefel und Sauerstoff. Es kommt üblicherweise als weißes, kristallines Pulver oder körnige Substanz vor.
Die chemische Formel für Ammoniumsulfat lautet (NH4)2SO4.
Ammoniumsulfat wird hauptsächlich als Düngemittel verwendet, um Pflanzen mit lebenswichtigen Nährstoffen, insbesondere Stickstoff und Schwefel, zu versorgen. Darüber hinaus dient es industriellen Zwecken wie der Herstellung von Persulfaten, Flammschutzmitteln und Feuerlöschpulvern. Es findet Anwendung in der Gerberei, Fotografie, Textilindustrie, Glasherstellung und als Nährstoff für Hefe- und Bakterienkulturen.
The molar mass of ammonium sulfate is approximately 132.14 grams per mole (g/mol).
Ammonium sulfate can be produced by various processes. One method involves reacting ammonia gas with sulfuric acid to yield (NH4)2SO4. It can also be derived from coke-oven gas or as a co-product in organic syntheses. Another approach entails the reaction of gypsum with ammonia and carbon dioxide.
Ammoniumsulfat gilt im Allgemeinen als sicher für den Menschen, wenn es gemäß den geltenden Richtlinien und Vorschriften verwendet wird. Als Düngemittel stellt es bei korrekter Anwendung auf Nutzpflanzen ein minimales Risiko dar.