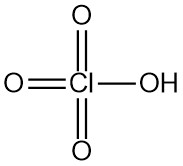
Perchlorsäure ist eine starke Mineralsäure mit der chemischen Formel HClO4. Es handelt sich um eine farb- und geruchlose Flüssigkeit, die üblicherweise in wässrigen Lösungen vorkommt. Perchlorsäure ist eine der stärksten Brønsted-Lowry-Säuren.
Inhaltsverzeichnis
1. Eigenschaften von Perchlorsäure
1.1. Physikalische Eigenschaften von Perchlorsäure
Wasserfreie Perchlorsäure kann durch Destillation bei vermindertem Druck aus einer Mischung hergestellt werden, die 1 Teil 20 %iges HClO4 und 4 Teile 20 %iges Oleum enthält.
Es ist eine farblose, stark hygroskopische Flüssigkeit mit einer Molekularmasse von 100,5 g/mol. Es schmilzt bei -102 °C und zersetzt sich bei 75 °C bei Atmosphärendruck.
Die Dichte und der Dampfdruck von Perchlorsäure bei verschiedenen Temperaturen sind in Tabelle 1 aufgeführt.
| Temperatur, °C | Dichte, g/cm3 | Dampfdruck, kPa |
|---|---|---|
| 0 | 1,808 | 1,546 |
| 10 | 1,789 | 2.506 |
| 20 | 1.770 | 3.913 |
| 25 | 1,761 | 4.826 |
Perchlorsäure ist mit Wasser in jedem Verhältnis mischbar und bildet verschiedene Hydrate (HClO4·n H2O, mit n = 1, 2, 2,5, 3 und 3,5) .
Siedepunkte und Dichten wässriger Lösungen sind in Tabelle 2 aufgeführt.
| Konzentration von HClO4, Gew.-% | Siedepunkt, °C | Dichte bei 25 °C, g/cm3 |
|---|---|---|
| 24,34 | 105,8 | 1,154 |
| 38,9 | 114,8 | 1.280 |
| 50,67 | 132,4 | 1.4058 |
| 56,65 | 148,0 | 1,4799 |
| 61,2 | 162,3 | 1,5413 |
| 65,20 | 189,2 | 1,5993 |
| 70,06 | 198,7 | 1,6748 |
| 72,5 | 203 | 1,7150 |
1.2. Chemische Eigenschaften von Perchlorsäure
Wasserfreie Perchlorsäure ist ein sehr starkes Oxidationsmittel. Während einige Metalle (Nickel, Kupfer, Silber und Gold) bei Raumtemperatur nur eine minimale Oxidation zeigen, bleibt Platin davon unberührt, katalysiert jedoch die Säurezersetzung. Perchlorsäure reagiert heftig mit brennbaren Materialien wie Papier, Holzkohle, Ethanol, Essigsäureanhydrid und Gelatine und bildet explosive Gemische.
Wässrige Lösungen bieten im Vergleich zur wasserfreien Form eine höhere Stabilität. Das azeotrope Gemisch (72,5 Gew.-% HClO4) zersetzt sich in Abwesenheit oxidierbarer Materialien erst oberhalb seines Siedepunkts.
Konzentrierte Perchlorsäurelösungen sind starke Oxidationsmittel, insbesondere bei erhöhten Temperaturen. Diese Lösungen bilden explosive Gemische mit organischen Verbindungen, die bei Erhitzung, Erschütterungen oder Einwirkung von Funken oder Flammen explodieren können.
Perchlorsäure ist eine starke Brønsted-Lowry-Säure, die in wässrigen Lösungen mit Metallen, Metalloxiden/-hydroxiden und Salzen flüchtiger Säuren unter Bildung entsprechender Perchlorate reagiert.
Bestimmte Oxide (z. B. CuO) können die Zersetzung von Perchlorsäure durch eine Reihe von Reaktionen katalysieren, wobei Chlor, Sauerstoff und Wasser als Endprodukte entstehen.
2. Herstellung von Perchlorsäure
Perchlorsäure wird durch chemische und elektrochemische Verfahren sowohl im Labor als auch kommerziell hergestellt.
2.1. Chemische Methoden
Im Jahr 1816 setzte Von Stadion Kaliumperchlorat mit Schwefelsäure unter Vakuumdestillation um, um Perchlorsäure herzustellen.
Im Jahr 1830 erhielt Serullas Perchlorsäure, indem er wässrige Chlorsäure unter Erhitzen zersetzte, und im Jahr 1831 stellte er erfolgreich unlösliches Kaliumfluorsilikat und Perchlorsäure her, indem er Kaliumperchlorat mit Hydrofluorkieselsäure umsetzte.
2 KClO4 + H2SiF6 → K2SiF6 + 2 HClO4
Im Jahr 1839 wandelte Henry Bariumperchlorat mithilfe von Schwefelsäure in Bariumsulfat und Perchlorsäurelösung um. Bei einer ähnlichen Methode wird Salzsäure anstelle von Schwefelsäure verwendet.
Später im 19. Jahrhundert oxidierte Willard Ammoniumperchlorat mit einer Mischung aus Salpetersäure und Salzsäure, um Perchlorsäure, Chlor, Lachgas und Wasser zu ergeben. Die verdünnte Perchlorsäurelösung wird durch Kochen eingeengt.
34 NH4ClO4 + 36 HNO3 + 8 HCl → 34 HClO4 + 4 Cl2 + 35 N2O + 73 H2O
In der modernen chemischen Methode hat Pernert, basierend auf der Arbeit von Kreider & Mathers, Perchlorsäure durch Reaktion von Natriumperchlorat mit konzentrierter Salzsäure hergestellt. Dieses Verfahren wurde erfolgreich kommerzialisiert.
NaClO4 + HCl → NaCl + HClO4
2.2. Elektrochemische Methoden
Ein in Deutschland entwickeltes kontinuierliches Verfahren zur Herstellung von Perchlorsäure nutzt die anodische Oxidation von Chlorgas, gelöst in gekühlter konzentrierter Perchlorsäure (40 %).
Cl2 + 8 H2O + 14 e– → 2 HClO4 + 14 H+
Mehrere Studien untersuchten die elektrochemische Herstellung von Perchlorsäure durch anodische Oxidation von Salzsäure bei niedrigen Temperaturen (20 bis -20 °C) unter Verwendung von Platinelektroden und spezifischen HCl-Konzentrationen (0,1–0,5 M), um eine ~60 %ige Perchlorsäurelösung zu erreichen.
Für die elektrochemische Herstellung von Perchlorsäure aus Natriumchlorat wurde eine Dreikammerzelle mit einer Platinanode und einer Eisenkathode entwickelt. Der Prozess umfasst die Oxidation von Chlorat an der Anode zu Perchlorsäure, gefolgt von Konzentrations- und Destillationsschritten zur Reinigung. Optimale Bedingungen sind niedrige Temperaturen unter 35 °C und eine Anodenstromdichte von 3,5 A/dm².
Das kommerzielle Verfahren zur Herstellung hochreiner Perchlorsäure verwendet eine 5000-Ampere-Zelle mit Platinanoden und horizontal angeordneten Silberblechkathoden in PVC-Rahmen. Bei diesem Verfahren werden eine Stromdichte von 20–25 A/dm² und eine Zellspannung von 4,4 V bei Temperaturen von -5 bis 3 °C eingesetzt.
Die Chlorkonzentration am Eintrittspunkt beträgt 3 g/L. Die erzeugte Perchlorsäure wird einer Destillation unterzogen, um restliches Chlor und HCl zu entfernen und eine hohe Reinheit zu erreichen. Der Platinverbrauch ist minimal und der Energieverbrauch pro Tonne 70 % HClO4 beträgt 9600 kWh.
Dieses Verfahren ermöglicht die direkte Herstellung verschiedener Perchlorate durch die direkte Umwandlung von Perchlorsäure, ohne dass der Natriumchloratprozess erforderlich ist.
Wasserfreie Perchlorsäure wird durch Vakuumdestillation einer Mischung aus konzentrierter Perchlorsäure (72 %) und rauchender Schwefelsäure (20 %) im Verhältnis 1:4 hergestellt. Anschließend wird das Produkt durch Abkühlen auf eine niedrige Temperatur von -78 °C mit Trockeneis gewonnen.
3. Verwendung von Perchlorsäure
Im Handel erhältliche Perchlorsäure ist in erster Linie eine azeotrope wässrige Lösung mit 72,5 Gew.-% HClO4, die ein Gleichgewicht zwischen chemischer Stabilität und Oxidationskraft bietet und kontrollierte Oxidationen mit hoher Energie ermöglicht.
Perchlorsäure wird vor allem als Vorprodukt für die Herstellung von hochreinem Ammoniumperchlorat verwendet, einem Schlüsselbestandteil von Sprengstoffen und Festtreibstoffen für Raketen und Flugkörper, was in jüngster Zeit zu einem Anstieg der Perchlorsäureproduktion geführt hat.
Es findet Anwendung in der analytischen Chemie zur Bestimmung von Metallelementen, die in oxidierbaren Materialien, insbesondere organischen Verbindungen, vorhanden sind.
Weitere Anwendungen von Perchlorsäure sind:
- Als Katalysator für die Acetylierung von Cellulose und Glucose, verwendet bei der Herstellung von Cellulosefasern.
- Bei der Polymerisation von Phenolen und Styrol.
- In der Metallverarbeitung wird Perchlorsäure zum Elektropolieren, Bearbeiten und Verdünnen von Metallteilen, Filmen und Legierungen sowie zum Beizen und Passivieren von Eisen, Stahl und anderen Metallen verwendet.
- Als Elektrolyt bei der Anodisierung von Metallen, der eine schützende Oxidschicht erzeugt.
- Als Dehydrierungsmolekül.
- Bei Oxidationsreaktionen, insbesondere zur Bestimmung von Chrom in Stahlproben.
Referenz
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2

