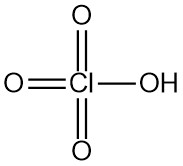
El ácido perclórico es un ácido mineral fuerte con la fórmula química HClO4. Es un líquido incoloro e inodoro que suele encontrarse en soluciones acuosas. El ácido perclórico es uno de los ácidos de Brønsted-Lowry más fuertes.
Tabla de contenido
1. Propiedades del ácido perclórico
1.1. Propiedades físicas del ácido perclórico
El ácido perclórico anhidro se puede producir por destilación a presión reducida a partir de una mezcla que contiene 1 parte de HClO4 al 20% y 4 partes de óleum al 20%.
Es un líquido incoloro y fuertemente higroscópico con una masa molecular de 100,5 g/mol. Se funde a -102 °C y se descompone a 75 °C a presión atmosférica.
La densidad y presión de vapor del ácido perclórico a diferentes temperaturas se detallan en la Tabla 1.
| Temperatura, °C | Densidad, g/cm3 | Presión de vapor, kPa |
|---|---|---|
| 0 | 1.808 | 1.546 |
| 10 | 1.789 | 2.506 |
| 20 | 1.770 | 3.913 |
| 25 | 1.761 | 4.826 |
El ácido perclórico es miscible con agua en todas las proporciones y forma diferentes hidratos (HClO4·n H2O, con n = 1, 2, 2,5, 3 y 3,5) .
Los puntos de ebullición y las densidades de las soluciones acuosas se presentan en la Tabla 2.
| Concentración de HClO4, % en peso | Punto de ebullición, °C | Densidad a 25 °C, g/cm3 |
|---|---|---|
| 24.34 | 105,8 | 1.154 |
| 38,9 | 114,8 | 1.280 |
| 50,67 | 132,4 | 1,4058 |
| 56,65 | 148.0 | 1,4799 |
| 61,2 | 162,3 | 1,5413 |
| 65,20 | 189,2 | 1,5993 |
| 70.06 | 198,7 | 1,6748 |
| 72,5 | 203 | 1,7150 |
1.2. Propiedades químicas del ácido perclórico
El ácido perclórico anhidro es un agente oxidante muy fuerte. Mientras que algunos metales (níquel, cobre, plata y oro) muestran una oxidación mínima a temperatura ambiente, el platino no se ve afectado pero cataliza la descomposición ácida. El ácido perclórico reacciona violentamente con materiales combustibles como papel, carbón, etanol, anhídrido acético y gelatina, formando mezclas explosivas.
Las soluciones acuosas ofrecen mayor estabilidad en comparación con la forma anhidra. La mezcla azeotrópica (72,5% en peso de HClO4) se descompone sólo por encima de su punto de ebullición en ausencia de materiales oxidables.
Las soluciones concentradas de ácido perclórico son agentes oxidantes fuertes, particularmente a temperaturas elevadas. Estas soluciones forman mezclas explosivas con compuestos orgánicos que pueden detonar al calentarlas, percutirlas o exponerlas a chispas o llamas.
El ácido perclórico es un ácido de Brønsted-Lowry fuerte que reacciona en soluciones acuosas con metales, óxidos/hidróxidos metálicos y sales de ácidos volátiles para formar los correspondientes percloratos.
Ciertos óxidos (p. ej., CuO) pueden catalizar la descomposición del ácido perclórico mediante una serie de reacciones que producen cloro, oxígeno y agua como productos finales.
2. Producción de ácido perclórico
El ácido perclórico se produce mediante métodos químicos y electroquímicos, tanto en laboratorios como comercialmente.
2.1. Métodos químicos
En 1816, Von Stadion hizo reaccionar perclorato de potasio con ácido sulfúrico mediante destilación al vacío para producir ácido perclórico.
En 1830, Serullas obtuvo ácido perclórico descomponiendo ácido clórico acuoso mediante calentamiento, y en 1831 produjo con éxito fluorosilicato de potasio insoluble y ácido perclórico haciendo reaccionar perclorato de potasio con ácido hidrofluosilícico.
2 KClO4 + H2SiF6 → K2SiF6 + 2 HClO4
En 1839, Henry transformó el perclorato de bario en una solución de sulfato de bario y ácido perclórico utilizando ácido sulfúrico. Un método similar utiliza ácido clorhídrico en lugar de ácido sulfúrico.
Más tarde, en el siglo XIX, Willard oxidó perclorato de amonio con una mezcla de ácido nítrico y ácido clorhídrico para producir ácido perclórico, cloro, óxido nitroso y agua. La solución diluida de ácido perclórico se concentra mediante ebullición.
34 NH4ClO4 + 36 HNO3 + 8 HCl → 34 HClO4 + 4 Cl2 + 35 N2O + 73 H2O
Con el método químico moderno, Pernert, basándose en el trabajo de Kreider & Mathers, produjo ácido perclórico haciendo reaccionar perclorato de sodio con ácido clorhídrico concentrado. Este proceso se comercializó con éxito.
NaClO4 + HCl → NaCl + HClO4
2.2. Métodos electroquímicos
Un proceso continuo desarrollado en Alemania para producir ácido perclórico utiliza la oxidación anódica de cloro gaseoso disuelto en ácido perclórico concentrado enfriado (40%).
Cl2 + 8 H2O + 14 e– → 2 HClO4 + 14 H+
Varios estudios exploraron la preparación electroquímica de ácido perclórico mediante oxidación anódica de ácido clorhídrico a bajas temperaturas (20 a -20 °C) utilizando electrodos de platino y concentraciones específicas de HCl (0,1 a 0,5 M) para lograr una solución de ácido perclórico de ~60 %.
Para la producción electroquímica de ácido perclórico a partir de clorato de sodio se ha desarrollado una celda de tres compartimentos con un ánodo de platino y un cátodo de hierro. El proceso implica la oxidación del clorato en el ánodo para formar ácido perclórico, seguido de pasos de concentración y destilación para la purificación. Las condiciones óptimas son temperaturas bajas por debajo de 35 °C y una densidad de corriente del ánodo de 3,5 A/dm².
El proceso comercial para producir ácido perclórico de alta pureza utiliza una celda de 5000 amperios con ánodos de platino y cátodos de láminas de plata colocados horizontalmente dentro de marcos de PVC. Este proceso emplea una densidad de corriente de 20 a 25 A/dm² y un voltaje de celda de 4,4 V a temperaturas que oscilan entre -5 y 3 °C.
La concentración de cloro en el punto de entrada es de 3 g/L. El ácido perclórico producido se destila para eliminar el cloro residual y el HCl y lograr una alta pureza. El consumo de platino es mínimo y el consumo de energía por tonelada de HClO4 al 70% es de 9600 kWh.
Este proceso permite la producción directa de diferentes percloratos mediante la conversión directa de ácido perclórico sin necesidad del proceso de clorato de sodio.
El ácido perclórico anhidro se produce mediante destilación al vacío de una mezcla de ácido perclórico concentrado (72%) y ácido sulfúrico fumante (20%) en una proporción de 1:4. A continuación, el producto se recupera enfriándolo a una temperatura baja de -78 °C utilizando hielo seco.
3. Usos del ácido perclórico
El ácido perclórico disponible comercialmente es principalmente una solución acuosa azeotrópica que contiene 72,5% en peso de HClO4, que ofrece un equilibrio entre estabilidad química y poder oxidante, lo que permite oxidaciones controladas de alta energía.
El ácido perclórico se utiliza principalmente como precursor para la producción de perclorato de amonio de alta pureza, un componente clave en explosivos y propulsores sólidos para cohetes y misiles, lo que ha llevado a un aumento en la producción de ácido perclórico en los últimos tiempos.
Encuentra aplicación en química analítica para la determinación de elementos metálicos presentes en materiales oxidables, particularmente compuestos orgánicos.
Otras aplicaciones del ácido perclórico incluyen:
- Como catalizador para la acetilación de celulosa y glucosa, utilizado en la preparación de fibras de celulosa.
- En la polimerización de fenoles y estireno.
- En el procesamiento de metales, el ácido perclórico se utiliza para el electropulido, mecanizado y adelgazamiento de piezas, películas y aleaciones metálicas, así como para el decapado y pasivación de hierro, acero y otros metales.
- Como electrolito en la anodización de metales, que crea una capa protectora de óxido.
- Como molécula de deshidratación.
- En reacciones de oxidación, particularmente para la determinación de cromo en muestras de acero.
Referencia
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2