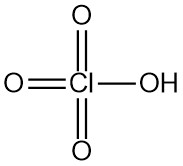
Perchloorzuur is een sterk mineraalzuur met de chemische formule HClO4. Het is een kleurloze, geurloze vloeistof die meestal in waterige oplossingen wordt aangetroffen. Perchloorzuur is een van de sterkste Brønsted-Lowry-zuren.
Inhoudsopgave
1. Fysische eigenschappen van perchloorzuur
Watervrij perchloorzuur kan worden geproduceerd door destillatie bij verlaagde druk uit een mengsel dat 1 deel 20% HClO4 en 4 delen 20% oleum bevat.
Het is een kleurloze, sterk hygroscopische vloeistof met een moleculaire massa van 100,5 g/mol. Het smelt bij -102 °C en ontleedt bij 75 °C bij atmosferische druk.
De dichtheid en dampspanning van perchloorzuur bij verschillende temperaturen worden gedetailleerd in Tabel 1.
| Temperatuur, °C | Dichtheid, g/cm3 | Dampspanning, kPa |
|---|---|---|
| 0 | 1,808 | 1,546 |
| 10 | 1,789 | 2,506 |
| 20 | 1,770 | 3,913 |
| 25 | 1,761 | 4,826 |
Perchloorzuur is mengbaar met water in alle verhoudingen en vormt verschillende hydraten (HClO4·n H2O, met n = 1, 2, 2,5, 3 en 3,5).
Kookpunten en dichtheden van waterige oplossingen worden weergegeven in Tabel 2.
| Concentratie van HClO4, gew. % | Kookpunt, °C | Dichtheid bij 25 °C, g/cm3 |
|---|---|---|
| 24,34 | 105,8 | 1,154 |
| 38,9 | 114,8 | 1,280 |
| 50,67 | 132,4 | 1,4058 |
| 56,65 | 148,0 | 1,4799 |
| 61,2 | 162,3 | 1,5413 |
| 65,20 | 189,2 | 1,5993 |
| 70,06 | 198,7 | 1,6748 |
| 72,5 | 203 | 1,7150 |
2. Chemische eigenschappen van perchloorzuur
Watervrij perchloorzuur is een zeer sterk oxidatiemiddel. Terwijl sommige metalen (nikkel, koper, zilver en goud) minimale oxidatie vertonen bij kamertemperatuur, blijft platina onaangetast maar katalyseert het zuurontleding. Perchloorzuur reageert heftig met brandbare materialen zoals papier, houtskool, ethanol, azijnzuuranhydride en gelatine, waardoor explosieve mengsels ontstaan.
Waterige oplossingen bieden een grotere stabiliteit vergeleken met de watervrije vorm. Het azeotrope mengsel (72,5 gew.% HClO4) ontleedt alleen boven het kookpunt bij afwezigheid van oxideerbare materialen.
Geconcentreerde perchloorzuuroplossingen zijn sterke oxidatiemiddelen, met name bij verhoogde temperaturen. Deze oplossingen vormen explosieve mengsels met organische verbindingen die kunnen ontploffen bij verhitting, percussie of blootstelling aan vonken of vlammen.
Perchloorzuur is een sterk Brønsted-Lowry-zuur dat in waterige oplossingen reageert met metalen, metaaloxiden/hydroxiden en zouten van vluchtige zuren om overeenkomstige perchloraten te vormen.
Bepaalde oxiden (bijv. CuO) kunnen de ontleding van perchloorzuur katalyseren door een reeks reacties die chloor, zuurstof en water als eindproducten opleveren.
3. Productie van perchloorzuur
Perchloorzuur wordt geproduceerd door chemische en elektrochemische methoden, zowel in laboratoria als commercieel.
3.1. Chemische methoden
In 1816 reageerde Von Stadion kaliumperchloraat met zwavelzuur onder vacuümdestillatie om perchloorzuur te produceren.
In 1830 verkreeg Serullas perchloorzuur door waterig chloorzuur te ontleden met verhitting, en in 1831 produceerde hij met succes onoplosbaar kaliumfluorosilicaat en perchloorzuur door kaliumperchloraat te laten reageren met waterstoffluosiliciumzuur.
2 KClO4 + H2SiF6 → K2SiF6 + 2 HClO4
In 1839 transformeerde Henry bariumperchloraat in bariumsulfaat en perchloorzuuroplossing met behulp van zwavelzuur. Een vergelijkbare methode gebruikt zoutzuur in plaats van zwavelzuur.
Later in de 19e eeuw oxideerde Willard ammoniumperchloraat met een mengsel van salpeterzuur en zoutzuur, om perchloorzuur, chloor, stikstofoxide en water te verkrijgen. De verdunde perchloorzuuroplossing wordt geconcentreerd door te koken.
34 NH4ClO4 + 36 HNO3 + 8 HCl → 34 HClO4 + 4 Cl2 + 35 N2O + 73 H2O
In de moderne chemische methode, Pernert, gebaseerd op het werk van Kreider & Mathers heeft perchloorzuur geproduceerd door natriumperchloraat te laten reageren met geconcentreerd zoutzuur. Dit proces werd succesvol gecommercialiseerd.
NaClO4 + HCl → NaCl + HClO4
3.2. Elektrochemische methoden
Een continu proces dat in Duitsland is ontwikkeld om perchloorzuur te produceren, maakt gebruik van de anodische oxidatie van chloorgas opgelost in gekoeld geconcentreerd perchloorzuur (40%).
Cl2 + 8 H2O + 14 e– → 2 HClO4 + 14 H+
Diverse studies onderzochten de elektrochemische bereiding van perchloorzuur door anodische oxidatie van zoutzuur bij lage temperaturen (20 tot -20 °C) met behulp van platina-elektroden en specifieke HCl-concentraties (0,1–0,5 M) om een perchloorzuuroplossing van ~60% te bereiken.
Een cel met drie compartimenten met een platina-anode en een ijzeren kathode is ontwikkeld voor de elektrochemische productie van perchloorzuur uit natriumchloraat. Het proces omvat de oxidatie van chloraat bij de anode om perchloorzuur te vormen, gevolgd door concentratie- en destillatiestappen voor zuivering. Optimale omstandigheden zijn lage temperaturen onder 35 °C en een anodestroomdichtheid van 3,5 A/dm².
Het commerciële proces voor het produceren van perchloorzuur met een hoge zuiverheid maakt gebruik van een 5000 ampère cel met platina-anodes en horizontaal geplaatste zilveren plaatkathodes in PVC-frames. Dit proces maakt gebruik van een stroomdichtheid van 20-25 A/dm² en een celspanning van 4,4 V bij temperaturen van -5 tot 3 °C.
De chloorconcentratie bij het intredepunt is 3 g/L. Het geproduceerde perchloorzuur ondergaat destillatie om restchloor en HCl te verwijderen en een hoge zuiverheid te bereiken. Het platinaverbruik is minimaal en het energieverbruik per ton 70% HClO4 is 9600 kWh.
Dit proces maakt de directe productie van verschillende perchloraten mogelijk door de directe omzetting van perchloorzuur zonder de noodzaak van het natriumchloraatproces.
Watervrij perchloorzuur wordt geproduceerd door vacuümdestillatie van een mengsel van geconcentreerd perchloorzuur (72%) en rokend zwavelzuur (20%) in een verhouding van 1:4. Het product wordt vervolgens teruggewonnen door afkoeling tot een lage temperatuur van -78 °C met behulp van droogijs.
4. Toepassingen van perchloorzuur
Commercieel verkrijgbaar perchloorzuur is voornamelijk een azeotrope waterige oplossing die 72,5 gew.% HClO4 bevat, wat een balans biedt tussen chemische stabiliteit en oxiderend vermogen, waardoor gecontroleerde oxidaties met hoge energie mogelijk zijn.
Perchloorzuur wordt voornamelijk gebruikt als voorloper voor de productie van zeer zuiver ammoniumperchloraat, een belangrijk onderdeel in explosieven en vaste stuwstoffen voor raketten en projectielen, wat de laatste tijd heeft geleid tot een toename van de productie van perchloorzuur.
Het vindt toepassing in analytische chemie voor de bepaling van metaalelementen die aanwezig zijn in oxideerbare materialen, met name organische verbindingen.
Andere toepassingen van perchloorzuur zijn:
- Als katalysator voor de acetylering van cellulose en glucose, gebruikt bij de bereiding van cellulosevezels.
- Bij de polymerisatie van fenolen en styreen.
- Bij metaalbewerking wordt perchloorzuur gebruikt voor elektrolytisch polijsten, bewerken en verdunnen van metalen onderdelen, films en legeringen, evenals voor het beitsen en passiveren van ijzer, staal en andere metalen.
- Als elektrolyt bij de anodisatie van metalen, wat een beschermende oxidelaag creëert.
- Als dehydratiemolecuul.
- Bij oxidatiereacties, met name voor de bepaling van chroom in staalmonsters.
Referentie
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2