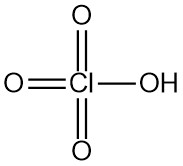
L’acide perchlorique est un acide minéral fort de formule chimique HClO4. C’est un liquide incolore et inodore que l’on trouve généralement dans les solutions aqueuses. L’acide perchlorique est l’un des acides de Brønsted-Lowry les plus puissants.
Table des matières
1. Propriétés de l’acide perchlorique
1.1. Propriétés physiques de l’acide perchlorique
L’acide perchlorique anhydre peut être produit par distillation sous pression réduite à partir d’un mélange contenant 1 partie de HClO4 à 20 % et 4 parties d’oléum à 20 %.
C’est un liquide incolore, fortement hygroscopique, d’une masse moléculaire de 100,5 g/mol. Il fond à -102 °C et se décompose à 75 °C à pression atmosphérique.
La densité et la pression de vapeur de l’acide perchlorique à différentes températures sont détaillées dans le tableau 1.
| Température, °C | Densité, g/cm3 | Pression de vapeur, kPa |
|---|---|---|
| 0 | 1.808 | 1,546 |
| 10 | 1,789 | 2.506 |
| 20 | 1,770 | 3.913 |
| 25 | 1,761 | 4,826 |
L’acide perchlorique est miscible à l’eau en toutes proportions et forme différents hydrates (HClO4·n H2O, avec n = 1, 2, 2,5, 3 et 3,5) .
Les points d’ébullition et les densités des solutions aqueuses sont présentés dans le Tableau 2.
| Concentration de HClO4, % en poids | Point d'ébullition, °C | Densité à 25 °C, g/cm3 |
|---|---|---|
| 24h34 | 105,8 | 1.154 |
| 38,9 | 114,8 | 1.280 |
| 50,67 | 132,4 | 1.4058 |
| 56,65 | 148,0 | 1,4799 |
| 61.2 | 162.3 | 1.5413 |
| 65.20 | 189,2 | 1,5993 |
| 70.06 | 198,7 | 1.6748 |
| 72,5 | 203 | 1,7150 |
1.2. Propriétés chimiques de l’acide perchlorique
L’acide perchlorique anhydre est un oxydant très puissant. Alors que certains métaux (nickel, cuivre, argent et or) présentent une oxydation minime à température ambiante, le platine reste inchangé mais catalyse la décomposition acide. L’acide perchlorique réagit violemment avec les matériaux combustibles comme le papier, le charbon de bois, l’éthanol, l’anhydride acétique et la gélatine, formant des mélanges explosifs.
Les solutions aqueuses offrent une plus grande stabilité par rapport à la forme anhydre. Le mélange azéotropique (72,5 % en poids de HClO4) se décompose uniquement au-dessus de son point d’ébullition en l’absence de matières oxydables.
Les solutions concentrées d’acide perchlorique sont de puissants agents oxydants, en particulier à des températures élevées. Ces solutions forment des mélanges explosifs avec des composés organiques qui peuvent exploser sous l’effet de la chaleur, de la percussion ou de l’exposition à des étincelles ou des flammes.
L’acide perchlorique est un acide de Brønsted-Lowry fort, réagissant dans des solutions aqueuses avec des métaux, des oxydes/hydroxydes métalliques et des sels d’acides volatils pour former les perchlorates correspondants.
Certains oxydes (par exemple CuO) peuvent catalyser la décomposition de l’acide perchlorique par une série de réactions produisant du chlore, de l’oxygène et de l’eau comme produits finaux.
2. Production d’acide perchlorique
L’acide perchlorique est produit par des méthodes chimiques et électrochimiques, tant en laboratoire que commercialement.
2.1. Méthodes chimiques
En 1816, Von Stadion a fait réagir du perchlorate de potassium avec de l’acide sulfurique sous distillation sous vide pour produire de l’acide perchlorique.
En 1830, Serullas obtint de l’acide perchlorique en décomposant de l’acide chlorique aqueux par chauffage, et en 1831, il réussit à produire du fluorosilicate de potassium insoluble et de l’acide perchlorique en faisant réagir du perchlorate de potassium avec de l’acide hydrofluosilicique.
2 KClO4 + H2SiF6 → K2SiF6 + 2 HClO4
En 1839, Henry transforma le perchlorate de baryum en solution de sulfate de baryum et d’acide perchlorique à l’aide d’acide sulfurique. Une méthode similaire utilise de l’acide chlorhydrique au lieu de l’acide sulfurique.
Plus tard au XIXe siècle, Willard oxyda le perchlorate d’ammonium avec un mélange d’acide nitrique et d’acide chlorhydrique, pour produire de l’acide perchlorique, du chlore, du protoxyde d’azote et de l’eau. La solution diluée d’acide perchlorique est concentrée par ébullition.
34 NH4ClO4 + 36 HNO3 + 8 HCl → 34 HClO4 + 4 Cl2 + 35 N2O + 73 H2O
Dans la méthode chimique moderne, Pernert, sur la base des travaux de Kreider & Mathers, a produit de l’acide perchlorique en faisant réagir du perchlorate de sodium avec de l’acide chlorhydrique concentré. Ce procédé a été commercialisé avec succès.
NaClO4 + HCl → NaCl + HClO4
2.2. Méthodes électrochimiques
Un procédé continu développé en Allemagne pour produire de l’acide perchlorique utilise l’oxydation anodique du chlore gazeux dissous dans de l’acide perchlorique concentré réfrigéré (40 %).
Cl2 + 8 H2O + 14 e– → 2 HClO4 + 14 H+
Plusieurs études ont exploré la préparation électrochimique de l’acide perchlorique par oxydation anodique de l’acide chlorhydrique à basse température (20 à -20 °C) à l’aide d’électrodes de platine et de concentrations spécifiques de HCl (0,1 à 0,5 M) pour obtenir une solution d’acide perchlorique d’environ 60 %.
Une cellule à trois compartiments avec une anode en platine et une cathode en fer a été développée pour la production électrochimique d’acide perchlorique à partir de chlorate de sodium. Le processus implique l’oxydation du chlorate à l’anode pour former de l’acide perchlorique, suivie d’étapes de concentration et de distillation pour la purification. Les conditions optimales sont des températures basses inférieures à 35 °C et une densité de courant anodique de 3,5 A/dm².
Le processus commercial de production d’acide perchlorique de haute pureté utilise une cellule de 5 000 ampères avec des anodes en platine et des cathodes en feuille d’argent placées horizontalement dans des cadres en PVC. Ce processus utilise une densité de courant de 20 à 25 A/dm² et une tension de cellule de 4,4 V à des températures allant de -5 à 3 °C.
La concentration de chlore à l’entrée est de 3 g/L. L’acide perchlorique produit subit une distillation pour éliminer le chlore résiduel et le HCl et atteindre une pureté élevée. La consommation de platine est minime et la consommation d’énergie par tonne de HClO4 à 70 % est de 9 600 kWh.
Ce procédé permet la production directe de différents perchlorates par conversion directe de l’acide perchlorique sans avoir recours au procédé au chlorate de sodium.
L’acide perchlorique anhydre est produit par distillation sous vide d’un mélange d’acide perchlorique concentré (72 %) et d’acide sulfurique fumant (20 %) dans un rapport 1:4. Le produit est ensuite récupéré par refroidissement à une basse température de -78 °C à l’aide de neige carbonique.
3. Utilisations de l’acide perchlorique
L’acide perchlorique disponible dans le commerce est principalement une solution aqueuse azéotropique contenant 72,5 % en poids de HClO4, qui offre un équilibre entre stabilité chimique et pouvoir oxydant, permettant des oxydations contrôlées à haute énergie.
L’acide perchlorique est principalement utilisé comme précurseur pour la production de perchlorate d’ammonium de haute pureté, un composant clé des explosifs et des propulseurs solides pour fusées et missiles, ce qui a conduit à une augmentation de la production d’acide perchlorique ces derniers temps.
Il trouve une application en chimie analytique pour la détermination des éléments métalliques présents dans les matériaux oxydables, en particulier les composés organiques.
D’autres applications de l’acide perchlorique comprennent :
- Comme catalyseur pour l’acétylation de la cellulose et du glucose, utilisé dans la préparation des fibres cellulosiques.
- Dans la polymérisation des phénols et du styrène.
- Dans le traitement des métaux, l’acide perchlorique est utilisé pour l’électropolissage, l’usinage et l’amincissement des pièces, films et alliages métalliques, ainsi que pour le décapage et la passivation du fer, de l’acier et d’autres métaux.
- En tant qu’électrolyte dans l’anodisation des métaux, créant une couche d’oxyde protectrice.
- En tant qu’agent de déshydratation.
- Dans les réactions d’oxydation, notamment pour la détermination du chrome dans les échantillons d’acier.
Référence
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2


