Wat is ammoniumsulfaat?
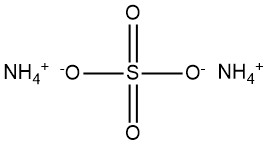
Ammoniumsulfaat is een chemische verbinding met de formule (NH4)2SO4. Het wordt vaak aangetroffen als een wit, kristallijn poeder of korrelige substantie. Het is in de 19e eeuw een belangrijke verbinding geworden, geproduceerd uit ammoniak in cokesovengas.
Aan het begin van de 20e eeuw werd de industriële synthese van ammoniak steeds belangrijker, wat leidde tot de acceptatie van ammoniumsulfaat als meststof.
In de loop van de tijd is het belang ervan echter afgenomen door de komst van krachtigere stikstofhoudende meststoffen. Opvallend is dat het op kleinere schaal is blijven worden toegepast voor specifieke industriële toepassingen.
Sinds ongeveer 1960 is de productie van ammoniumsulfaat toegenomen als bijproduct in de organische syntheseprocedures. In bepaalde regio’s wordt ammoniumsulfaat geproduceerd uit gips.
Inhoudsopgave
1. Eigenschappen van ammoniumsulfaat
Ammoniumsulfaat heeft een molaire massa van 132,14 g/mol, een dichtheid van 1,77 g/cm³ bij 20 °C en een gemiddelde specifieke warmtecapaciteit van 1,423 J/g·K binnen het temperatuurbereik van 2 tot 55 °C.
De kristalstructuur is rhombisch bipyramidaal. Het is opmerkelijk dat de grootte en vorm van de kristallen kunnen worden beïnvloed door stoffen die aanwezig zijn in de kristalliserende oplossing, en dit aspect is belangrijk bij de commerciële productie.
Het thermische gedrag van ammoniumsulfaat is ingewikkeld. Bij atmosferische druk kan het niet worden gesmolten zonder te ontleden, wat leidt tot de vrijgave van ammoniak en de vorming van bisulfaat.
Toch blijft de dampspanning van ammoniak in het geval van zuiver watervrij ammoniumsulfaat praktisch nul totdat 80 °C is bereikt. Bij het overschrijden van 300 °C resulteert ontleding in de generatie van N2, SO2, SO3 en H2O, afgezien van ammoniak.
Ammoniumsulfaat vormt geen hydraten. De warmteverandering bij het oplossen van 1 mol van het zout in 400 mol water is +9,92 kJ bij 18 °C, terwijl de integrale warmte van de oplossing +6,57 kJ/mol bedraagt bij 30 °C. De differentiële warmte van de oplossing voor een verzadigde oplossing is +6,07 kJ/mol bij 30 °C.
Ammoniumsulfaat vertoont alleen vervloeiing boven 80% relatieve vochtigheid, waardoor het in droge lucht kan worden opgeslagen en ammoniaktoevoeging de oplosbaarheid aanzienlijk vermindert.
Bij 10 °C daalt de oplosbaarheid van 73 g (NH4)2SO4 in 100 g water tot ongeveer 18 g zout in 100 g van een 24,5% waterige ammoniakoplossing.
De oplosbaarheid van calciumsulfaat in ammoniumsulfaatoplossing is ongeveer het dubbele vergeleken met de oplosbaarheid in water. Deze eigenschap ondersteunt de reactie van gips of anhydriet met oplossingen die ammoniumcarbonaat – ammoniumsulfaat bevatten.
De verbinding blijft onoplosbaar in typische organische oplosmiddelen. Oplossen van ammoniumsulfaat in ethanol, propanol, butanol, aceton, pyridine en soortgelijke oplosmiddelen resulteert in de vorming van twee afzonderlijke fasen: een waterige fase en een organische oplosmiddelfase.
Ammoniumsulfaatoplossingen en de oplossingen ervan in zwavelzuur corroderen geen speciaal Cr-Ni roestvrij staal. IJzer en aluminium blijven niet-reactief in ammoniakale oplossingen. In gevallen waarin de oplossingen corrosieve stoffen voor roestvrij staal bevatten (bijv. Cl–), kunnen vaten worden beschermd door ze te bekleden met zuurbestendige stenen.
2. Productie van ammoniumsulfaat
Ammoniumsulfaat wordt industrieel geproduceerd uit:
- Cokesovengas
- Ammoniak en zwavelzuur
- Organische syntheses, zoals de productie van caprolactam
- Gips, ammoniak en koolstofdioxide
2.1. Productie van ammoniumsulfaat uit cokesovengas
Het gebruik van cokesovengas als voorloper voor de productie van ammoniumsulfaat is de afgelopen decennia aanzienlijk afgenomen. Deze trend kan worden toegeschreven aan de gedeeltelijke sluiting van staalfabrieken en ontwikkelingen in cokesmethoden die minder ammoniumsulfaat opleveren.
Bij de directe methode wordt onbehandeld cokesovengas in zwavelzuur geïntroduceerd, wat resulteert in ammoniumsulfaat dat is verontreinigd door gepigmenteerde teerderivaten.
Als alternatief omvat het indirecte proces de extractie van ammoniak uit cokesovengas door waterwassen, gevolgd door vrijmaking met behulp van een kalksuspensie en het combineren ervan met zwavelzuur.
2.2. Productie van ammoniumsulfaat uit ammoniak en zwavelzuur
De warmte die wordt gegenereerd door de reactie tussen ammoniak en zwavelzuur kan water effectief verdampen als de zuurconcentratie 70% overschrijdt. De reactie wordt als volgt weergegeven:
2 NH3(g) + H2SO4(l) → (NH4)2SO4(s) ΔH = -274 kJ/mol
In de hedendaagse praktijk vindt de reactie plaats in verzadigers, apparaten die zijn afgeleid van eerder gebruikte verdampingskristallisatoren. Het verzadigingsproces integreert neutralisatie en kristallisatie in één apparaat.
Zwavelzuur wordt aan de zuigzijde ingebracht, terwijl ammoniak aan de drukzijde van een geforceerde circulatiepomp wordt toegevoegd. De resulterende metastabiele oplossing levert deeltjes op van 0,5 tot 3 mm groot bij kristallisatie.
Continue afvoer-, centrifugatie-, droog- en koelprocessen vergemakkelijken de isolatie van ammoniumsulfaat. Om kristalgroei te vergemakkelijken, worden kleine hoeveelheden fosforzuur, ureum of anorganische zouten toegevoegd.
2.3. Ammoniumsulfaat als coproduct in organische syntheses
Ammoniumsulfaat ontstaat als bijproduct tijdens de synthese van synthetische vezelintermediairen, zoals caprolactam, acrylonitril en methylmethacrylaat, samen met de productie van mierenzuur en acrylamide.
De belangrijke bron is caprolactamproductie, essentieel voor nylon 6-synthese. Traditionele caprolactamprocessen leveren 2,5 – 4,5 ton ammoniumsulfaat per ton lactam op. Recente processen die door verschillende entiteiten zijn ontwikkeld, zijn erin geslaagd dit bereik terug te brengen tot 1,7 – 1,8 ton per ton lactam.
2.4. Productie van ammoniumsulfaat uit gips
Zowel anhydriet als gips reageren met NH3 en CO2:
CaSO4·2 H2O + (NH4)2CO3 → (NH4)2SO4 + CaCO3·2 H2O
Dit proces, dat door BASF tijdens de Eerste Wereldoorlog werd opgezet, blijft belangrijk in regio’s met beperkte toegang tot zwavelzuur, waaronder India, Pakistan en Turkije. Fijngemalen gips wordt blootgesteld aan ammoniumcarbonaatoplossing in een cascade van geroerde vaten.
Het reactiemengsel, bestaande uit calciumcarbonaat en ammoniumsulfaatoplossing, wordt gefiltreerd met behulp van roterende vacuümfilters. Het resulterende gewassen calciumcarbonaat wordt gebruikt voor het bemesten van kalk, de productie van calcium-ammoniumnitraat, grondstof voor glas of vulstof voor rubber of PVC.
De licht troebele ammoniumsulfaatoplossing ondergaat filtratie met behulp van filterpersen, gevolgd door verzuring met H2SO4 en verwerking door meertraps verdampingskristallisatoren om grofkorrelig ammoniumsulfaat te verkrijgen.
Een alternatieve techniek, het Continental Engineering Process, introduceert NH3 en CO2 direct in een gipsbrij in een hoog, cilindrisch geroerd vat.
2.5. Andere processen
Verschillende methoden met SO2 en atmosferische zuurstof zijn verouderd.
Er is een groeiende interesse in processen waarbij ammoniak wordt gebruikt om SO2 uit de uitlaat van energiecentrales te verwijderen, zoals het Walther-proces, dat gebruikmaakt van een tweetrapswassing van stofvrije uitlaatgassen om een geconcentreerde ammoniumsulfietoplossing te genereren. Deze oplossing wordt vervolgens geoxideerd met atmosferische zuurstof en gesproeidroogd tot ammoniumsulfaatpoeder, dat later wordt gegranuleerd.
3. Toepassingen van ammoniumsulfaat
Ammoniumsulfaat wordt voornamelijk gebruikt als meststof, met minimaal industrieel gebruik. In geïndustrialiseerde landen ontstaat ammoniumsulfaat doorgaans als een co-product of bijproduct en wordt het voornamelijk verkocht als meststof, met name in ontwikkelingsgebieden.
Het beperkte stikstofgehalte in geïndustrialiseerde landen draagt bij aan hogere transportkosten per eenheid stikstof in vergelijking met andere stikstofhoudende meststoffen.
In Afrika en Azië heeft ammoniumsulfaat een belangrijke functie bij het bemesten van rijst-, thee- en rubbergewassen. In regio’s zoals Europa, de Verenigde Staten en Brazilië vormt het echter vaak een bestanddeel van gemengde en complexe meststoffen.
In de industrie wordt (NH4)2SO4 gebruikt voor de synthese van persulfaten, vlamvertragers en brandbluspoeders.
Het blijkt bruikbaar in looiprocessen, maar ook in industrieën zoals fotografie, textiel en glasproductie. Ammoniumsulfaat dient ook als voedingsbron voor gist- en bacterieculturen.
Referenties
- Ammonium Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
- Industrial Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128498910000035