Was ist Fluorschwefelsäure?
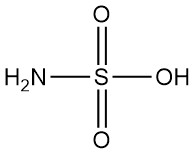
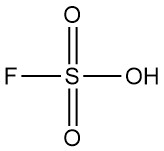
Fluorschwefelsäure ist eine anorganische Verbindung mit der chemischen Formel HSO3F. Sie ist eine farblose bis blassgelbe Flüssigkeit mit stechendem Geruch, die in feuchter Luft leicht raucht. Sie gilt als eine der stärksten kommerziell erhältlichen Säuren.
Die Fluor-Schwefel-Bindung ist stärker als die von Chlorschwefelsäure, daher wird Fluorschwefelsäure langsamer hydrolysiert als Chlorschwefelsäure. Unter optimalen Bedingungen ist die Synthese von Fluorschwefelsäuresalzen in einer wässrigen Lösung möglich.
Fluorschwefelsäure wurde erstmals 1892 erwähnt, zusammen mit einer Synthesemethode, bei der Fluorwasserstoff und Schwefeltrioxid verwendet werden, was nach wie vor das bevorzugte Produktionsverfahren ist.
In der Vergangenheit wurde Fluorschwefelsäure in Fluorierungsreaktionen und als Katalysator in Alkylierungs- und Cyclisierungsprozessen verwendet. Industrielle Prozesse wie die Herstellung von Bortrifluorid und die Tetrahydrofuran-Polymerisation verwenden Fluorschwefelsäure. Außerdem wird sie seit den 1960er Jahren zum chemischen Polieren von Bleikristallglas eingesetzt.
Handelsübliche Fluorschwefelsäure besteht zu etwa 99,0 % aus HSO3F, mit geringfügigen Verunreinigungen wie Schwefelsäure, Schwefeltrioxid, Schwefeldioxid und Eisen.
Bis heute haben Salze und Derivate der Fluorschwefelsäure nur eine begrenzte industrielle Bedeutung.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Fluorschwefelsäure
Fluorschwefelsäure ist eine farblose Flüssigkeit, die in polaren organischen Lösungsmitteln (z. B. Nitrobenzol, Essigsäure und Ethylacetat) löslich, in unpolaren Lösungsmitteln jedoch schlecht löslich ist.
Die physikalischen Eigenschaften von Fluorschwefelsäure sind in Tabelle 1 zusammengefasst.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [7789-21-1] |
| Chemische Formel | HSO3F |
| Molekulargewicht | 100,07 g/mol |
| Schmelzpunkt | - 88,98 °C |
| Siedepunkt |
bei 101,3 kPa: 162,7 °C bei 16,0 kPa: 110 °C bei 2,5 kPa: 77 °C |
| Dichte |
bei 18 °C: 1,740 g/cm3 bei 25 °C: 1,725 g/cm3 |
| Dampfdruck bei 25 °C | 330 Pa |
| Viskosität bei 25 °C | 1,56 mPa.s |
| Bildungswärme (Flüssigkeit) | 792,45 kJ/mol |
2. Herstellung von Fluorschwefelsäure
Fluorschwefelsäure wird industriell durch Rühren von Fluorwasserstoff und Schwefeltrioxid in Fluorschwefelsäure als Lösungsmittel für die Reaktion hergestellt. Die Fluorschwefelsäure wird gekühlt, um die Temperatur im Reaktor konstant bei < 100 °C zu halten, wie in Abbildung 1 dargestellt.
HF + SO3 → HSO3F
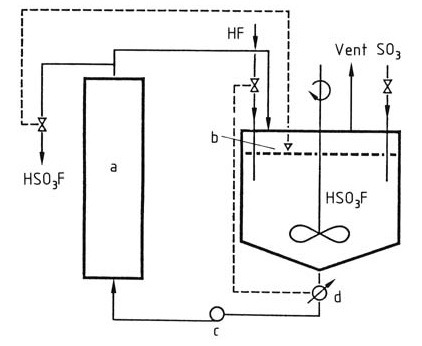
Abbildung 1: Herstellung von Fluorschwefelsäure
a) Kühler; b) Füllstandsregelung; c) Pumpe; d) Konduktometer
Alternativ kann Fluorschwefelsäure synthetisiert werden, indem Kaliumfluorid oder Calciumfluorid bei erhöhten Temperaturen (ca. 250 °C) mit Oleum (rauchende Schwefelsäure) umgesetzt werden.
Nach der Reaktion wird jeglicher verbleibender Fluorwasserstoff durch Spülen mit einem Inertgas entfernt. Die resultierende Fluorschwefelsäure kann dann durch Destillation in einer Glasapparatur gereinigt werden.
Aufgrund der ätzenden Natur von Fluorschwefelsäure erfordern ihre Herstellung und Handhabung spezielle Geräte und strenge Sicherheitsprotokolle.
3. Verwendung von Fluorschwefelsäure
3.1. Verwendung von Fluorschwefelsäure in der anorganischen Chemie
Fluorschwefelsäure wird als Fluorierungsmittel verwendet, das im Vergleich zu Flusssäure eine mildere Reaktivität aufweist. Beispiele für Fluorierungsreaktionen sind die Umwandlung von Siliziumdioxid in Siliziumtetrafluorid, Borsäure in Bortrifluorid, Arsentrioxid in Arsentrifluorid und Kaliumperchlorat in Perchlorylfluorid. Letztere Verbindung wird als Fluorierungsmittel in der organischen Synthese eingesetzt.
3.2. Verwendung von Fluorschwefelsäure beim Glaspolieren
Fluorschwefelsäure wird zur Wiederherstellung von Bleiglaspolierbädern verwendet, die aus 60–70 % Schwefelsäure, 2–6 % Flusssäure und Wasser bestehen. Der Polierprozess verbraucht diese Säuren, indem er die Glasoberfläche teilweise auflöst, wie in den folgenden Gleichungen gezeigt:
PbO + H2SO4 → PbSO4 + H2O
SiO2 + 6 HF → H2SiF6 + 2 H2O
Wenn Fluorschwefelsäure dem Polierbad zugesetzt wird, wird sie hydrolysiert, um diese Säuren im Säuremedium zu reproduzieren, indem ein Teil des gebildeten Wassers verbraucht wird.
HSO3F + H2O → H2SO4 + HF
Diese Methode reduziert den Flusssäureverbrauch um etwa 28 % und verringert auch den Säureabfall im Vergleich zu herkömmlichen Regenerationstechniken mit Schwefel- und Flusssäure.
3.3. Verwendung von Fluorschwefelsäure in der organischen Chemie
Fluorschwefelsäure katalysiert Alkylierungs-, Polymerisations- und Isomerisierungsreaktionen in der organischen Synthese. Das reaktive Alkylfluorsulfat-Zwischenprodukt ist für die katalytische Aktivität verantwortlich. Beispiele für diese Reaktion sind:
- Alkylierung von Olefinen und Isoparaffinen
- Bildung von hochoktanigen Kraftstoffen aus niedrigoktanigen Kohlenwasserstoffen
- Herstellung von alkylierten Aromaten und Alkylierung von Phenol zu tert-Butylphenol.
Darüber hinaus wird es in Polymerisationsreaktionen verwendet, wie etwa der Polymerisation von Tetrahydrofuran, von Ethylen zu langkettigen ungesättigten Kohlenwasserstoffen und von Trioxan zu Polyoxymethylen. Die Isomerisierung von C7-Kohlenwasserstoffen, Penten und Methylpenten wird ebenfalls durch Fluorschwefelsäure katalysiert.
Die selektive Herstellung von Beta-Naphthol aus Naphthalin durch katalytische Hydroxylierung mit Wasserstoffperoxid wird durch eine Kombination aus Fluorschwefelsäure und Antimonpentafluorid als Katalysatorsystem erreicht.
3.4. Verwendung von Fluorschwefelsäure bei der Fluorreinigung
Fluorschwefelsäure bietet eine Alternative zu Natriumfluorid zur Entfernung von Fluorwasserstoff aus elementarem Fluor. Im Gegensatz zu Natriumfluorid, das schwerlösliches Natriumhydrogenfluorid bildet, kann das mit Fluorschwefelsäure gebildete Produkt durch Destillation entfernt werden.
4. Sicherheitsrisiken und Handhabung von Fluorschwefelsäure
Fluorschwefelsäure birgt aufgrund ihrer ätzenden Wirkung und Reaktivität erhebliche Risiken für die menschliche Gesundheit. Kontakt mit Augen, Haut oder Schleimhäuten kann zu schweren Verbrennungen und Gewebeschäden führen. Die Einwirkung von Dämpfen kann die Atemwege reizen. Die Hydrolyse von Fluorschwefelsäure in Gegenwart von Feuchtigkeit erzeugt Fluorwasserstoff und Schwefelsäure, was die ätzende Wirkung verschlimmert.
Fluorwasserstoff hat einzigartige toxikologische Eigenschaften; er dringt in die Haut ein und verursacht tiefe Gewebeschäden. Seine Fähigkeit, Calcium- und Magnesiumionen zu chelatieren, stört den Zellstoffwechsel.
Beim Umgang mit Fluorschwefelsäure ist die strikte Einhaltung der Sicherheitsprotokolle unerlässlich. Persönliche Schutzausrüstung, einschließlich Atemschutz, chemikalienbeständiger Handschuhe, Augenschutz und in schweren Fällen Ganzkörperanzüge, ist obligatorisch.
Notfallmaßnahmen bei Expositionsvorfällen erfordern eine sofortige Dekontamination mit Wasser und einer Calciumgluconatlösung, gefolgt von ärztlicher Versorgung. Bei Einnahme ist die Verabreichung von Magnesia-Milch oder Calciumgluconatlösung erforderlich.
Fluorschwefelsäure kann unter bestimmten Bedingungen organische Materialien entzünden. Bei verschütteten Flüssigkeiten ist äußerste Vorsicht geboten. Zur Verdünnung sind große Mengen Wasser zu verwenden, wobei die Bildung ätzender Nebel zu vermeiden ist.
Bei kleinen verschütteten Flüssigkeiten wird die Zugabe kalter konzentrierter Schwefelsäure empfohlen, gefolgt von Verdünnung und Neutralisierung mit Kalk.
Referenz
- Fluorschwefelsäure; Ullmanns Enzyklopädie der technischen Chemie. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a11_431.pub2