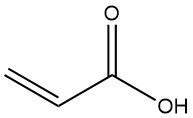
Acrylsäure, auch 2-Propensäure genannt, ist die einfachste ungesättigte Carbonsäure mit der Formel CH2=CHCOOH. Es ist eine farblose Flüssigkeit, die brennbar, flüchtig und leicht giftig ist.
Um eine Polymerisation zu verhindern, enthalten kommerzielle Präparate typischerweise Hydrochinon oder seinen Monomethylether.
In der Vergangenheit wurden für die industrielle Herstellung von Acrylsäure verschiedene Methoden wie die Acrylnitril hydrolyse und das modifizierte Reppe-Verfahren eingesetzt. Bedeutende Fortschritte bei der katalytischen Oxidation, insbesondere bei der Umwandlung von Propen in Acrylsäure über Acrolein, haben diese früheren Techniken jedoch fast vollständig verdrängt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Acrylsäure
Acrylsäure ist eine transparente und farblose Flüssigkeit mit einem Siedepunkt von 141,0 °C bei 101,3 kPa und einem Schmelzpunkt von 13,5 °C, die beim Erstarren kristalline Nadeln bildet.
Es weist eine hohe Mischbarkeit mit Wasser, Alkoholen, Estern und verschiedenen anderen organischen Lösungsmitteln auf und ist daher in diesen Substanzen gut löslich.
Weitere wichtige physikalische Eigenschaften sind unten aufgeführt:
| Eigenschaft | Wert |
|---|---|
| Molmasse | 72,06 g/mol |
| Brechungsindex | 1,421 |
| Dichte | 1,05 g/cm³ |
| Viskosität | 1,15 mPa.s (bei 25°C) |
| Kritische Temperatur | 380 °C |
| Kritischer Druck | 5,06 MPa |
| Dissoziationskonstante | 5,46 x 10-5 (bei 25 °C) |
| pKa | 4,25 |
2. Chemische Reaktionen von Acrylsäure
Acrylsäure zeigt charakteristische Reaktionen, die sowohl für ungesättigte Verbindungen als auch für aliphatische Carbonsäuren charakteristisch sind. Seine hohe Reaktivität lässt sich auf das Vorhandensein zweier ungesättigter Zentren in konjugierter Position zurückführen.
Das durch die Carbonylgruppe polarisierte β-Kohlenstoffatom fungiert als Elektrophil und ermöglicht die Addition verschiedener Nukleophiler und aktiver Wasserstoffverbindungen an die Vinylgruppe.
Darüber hinaus ist die Kohlenstoff-Kohlenstoff-Doppelbindung an radikalisch initiierten Additionsreaktionen, Diels-Alder-Reaktionen mit Dienen und Polymerisationsreaktionen beteiligt.
Was die Carboxylfunktion betrifft, so unterliegt sie den für aliphatische Säuren typischen Verdrängungsreaktionen, wie z. B. der Veresterung.
Wenn die Vinyl- und Carboxylfunktionen gemeinsam reagieren, insbesondere mit bifunktionellen Reagenzien, dienen sie häufig als bequeme Wege zur Bildung polyzyklischer und heterozyklischer Substanzen.
Acrylsäure unterliegt leicht einer Polymerisation, die durch Wärme, Licht und Peroxide katalysiert werden kann, aber durch Stabilisatoren wie den Monomethylether von Hydrochinon oder Hydrochinon selbst gehemmt wird.
Bemerkenswert ist, dass diese phenolischen Inhibitoren nur in Gegenwart von Sauerstoff wirksam sind. Der Polymerisationsprozess von Acrylsäure ist stark exotherm und kann äußerst heftig sein.
2.1. Additionsreaktionen
Acrylsäure geht leicht Additionsreaktionen mit verschiedenen Substanzen wie Wasserstoff, Halogenwasserstoffen und Cyanwasserstoff ein, die üblicherweise an Olefine addiert werden:
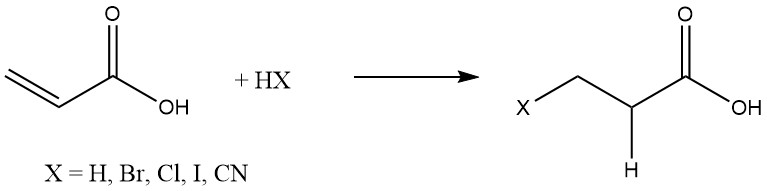
Michael-Additionen organischer Substanzen erfolgen in Gegenwart basischer Katalysatoren wie tertiären Aminen, quartären Ammoniumsalzen und Alkalialkoxiden.
Da Ammoniak und Amine ausreichend basisch sind, können sie ohne Katalysator reagieren. Die Zugabe eines einzelnen NH3-Moleküls kann mit einer wässrigen Lösung aus Ammoniak und Ammoniumcarbonat erreicht werden.
Die Addition von aromatischen Aminen bzw. Amiden und tert.-Alkyl-primären Aminen wird durch Säuren wirksamer gefördert. Amine können sowohl die Vinyl- als auch die Carboxylfunktionen angreifen, aber die resultierenden Produkte aus solchen Reaktionen zerfallen und ergeben N-substituierte Amide.
Unter basischen Bedingungen gehen auch Alkohole, Phenole, Schwefelwasserstoff und Thiole Additionsreaktionen ein. Schwefelwasserstoff ergibt in Kombination mit Schwefel- und Ammoniumpolysulfid- oder Aminkatalysatoren Polythiodipropionsäuren. Unterdessen werden Zugaben aromatischer Kohlenwasserstoffe effizienter durch Lewis-Säuren gefördert.
Stehen im Additionsprodukt weitere saure Wasserstoffatome zur Verfügung, kann ein zweites (und drittes) Molekül Acrylsäure addieren. Dies geschieht bei der Reaktion von Acrylsäure mit H2S, NH3, RNH2 und Pyrrol.
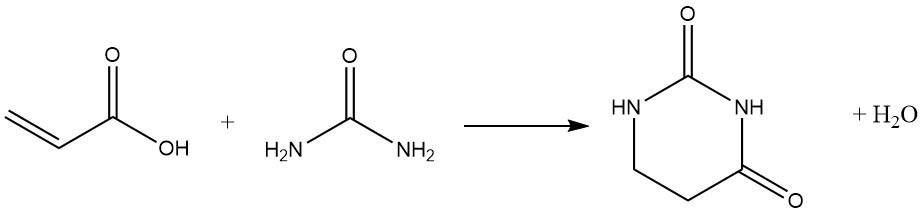
Heterocyclische Substanzen entstehen häufig durch Folgereaktionen der Carboxylfunktion, insbesondere mit bifunktionellen Nukleophilen:
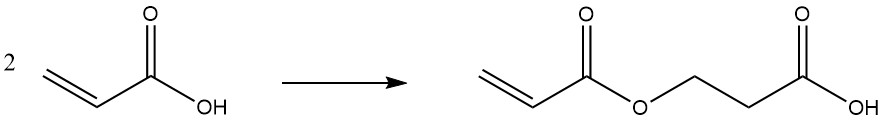
Bei erhöhten Temperaturen oder bei längerer Lagerung dimerisiert Acrylsäure:
2.2. Reaktionen der Carboxylgruppe
Acrylsäure lässt sich leicht in die entsprechenden Salze umwandeln, durch Reaktion mit Essigsäureanhydrid in Acrylanhydrid umwandeln oder durch Reaktion mit Benzoyl- oder Thionylchlorid in Acryloylchlorid umwandeln. Die Veresterung von Acrylsäure und die Umesterung von Acrylsäureestern sind wirtschaftlich bedeutsame Reaktionen.
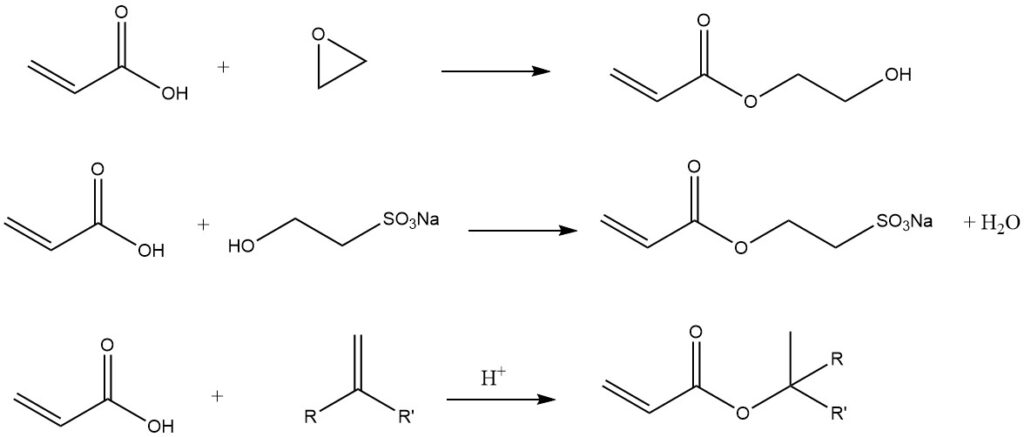
Einige andere Beispiele für Carboxylgruppen sind:
3. Herstellung von Acrylsäure
Handelsübliche Acrylsäure wird hauptsächlich aus Propen hergestellt, das auch als Rohstoff für die Acroleinproduktion genutzt wird. Zur Herstellung von Acrylsäure und ihren Estern wurden in der Vergangenheit verschiedene Verfahren eingesetzt, die zum Teil noch heute in begrenztem Umfang eingesetzt werden.
1. Prozesse auf Basis von Acetylen:
Acrylsäure und ihre Ester können aus Acetylen in Gegenwart von Säure und Nickelcarbonyl bei Atmosphärendruck und 40 °C synthetisiert werden:
4 C2H2 + 4 ROH + 2 HCl + Ni(CO)4 → 4 H2C=CHCOOR + NiCl2 + H2
Diese Methode wurde jedoch aufgrund der Herausforderungen im Umgang mit giftigem und korrosivem Nickelcarbonyl aufgegeben.
2. Hochdruck-Reppe-Prozess:
BASF verwendete ein Verfahren unter Verwendung eines Nickelbromid-Kupfer(II)-bromid-Katalysators bei etwa 14 MPa und 200 °C, um Acrylsäure aus Acetylen, CO und Wasser herzustellen. Dennoch wurde dieses Verfahren durch die kostengünstigere Direktoxidation von Propen ersetzt.
3. Acrylnitril-Hydrolyse:
Diese Methode, die die Hydrolyse von Acrylnitril beinhaltet, erwies sich aufgrund der geringen Ausbeute und der großen Mengen an NH4HSO4-Abfällen als wirtschaftlich unattraktiv. Einige Unternehmen haben dieses Verfahren aufgegeben, mit Ausnahme von Asahi Chemical, das es immer noch verwendet.
4. Ketene-Prozess:
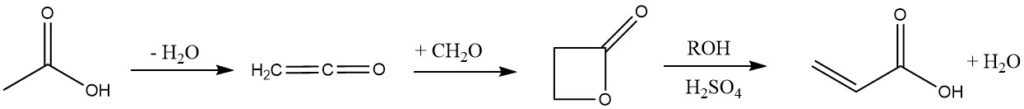
Bei diesem Verfahren wird Essigsäure oder Aceton zu Keten pyrolysiert, aber Unternehmen wie Celanese und B. F. Goodrich haben es aufgrund seiner vielen Schritte und der Toxizität von β-Propiolacton aufgegeben.
5. Thermische Depolymerisation von Polypropiolacton:
Novomer hat proprietäre Katalysatoren zur Herstellung von Polypropiolacton (PPL) als Zwischenprodukt entwickelt, das thermisch zu Acrylsäure oder Acrylatestern depolymerisiert werden kann, um die Herausforderungen des Transports zu bewältigen und die Herstellungskomplexität zu reduzieren.
6. Ethylencyanhydrin-Prozess:
Ethylencyanhydrin wird durch Anlagerung von Cyanwasserstoff an Ethylenoxid erzeugt und anschließend katalytisch unter Verwendung von Schwefelsäure zu Acrylsäure dehydriert. Dieses Verfahren wurde von Union Carbide und Rohm & Haas verwendet, aber aufgrund von Schwierigkeiten bei der Handhabung von HCN- und NH4HSO4-Abfällen aufgegeben.
7. Partielle Oxidation von Allylether:
Ein katalytisches System auf Basis von Li-dotiertem mesoporösem Manganoxid kann die aerobe partielle Oxidation von Diallylether zu Allylacrylat unter Umgebungsbedingungen in Acetonitril als Lösungsmittel katalysieren.
3.1. Herstellung von Acrylsäure durch Propenoxidation
Die Herstellung von Acrylsäure aus Propen erfolgt durch heterogene katalytische Oxidation in der Dampfphase unter Verwendung von Luft und Wasserdampf. Das resultierende Produkt wird typischerweise in Wasser absorbiert, anschließend mit einem geeigneten Lösungsmittel extrahiert und dann destilliert, um Eisacrylsäure in technischer Qualität zu erhalten.
Die Forschung an Katalysatoren für die Propenoxidation zu Acrylsäure begann Ende der 1950er Jahre mit zwei Methoden zur heterogen katalysierten Gasphasenoxidation von Propen: einstufigen und zweistufigen Verfahren.
Beim einstufigen Verfahren ist die Ausbeute begrenzt, bestenfalls etwa 50–60 %, und die Lebensdauer des Katalysators ist aufgrund des Vorhandenseins von Telluroxid, das zur Sublimierung neigt, kurz.
Der zweistufige Prozess erfordert unterschiedliche Reaktionsbedingungen und Katalysatoren, um in jedem Schritt eine optimale Umwandlung und Selektivität zu erreichen. Für die Acrolein-selektive Propenoxidation werden Katalysatoren der ersten Stufe eingesetzt, die eine Ausbeute von über 85 % an Acrolein und Acrylsäure liefern.
Frühe Katalysatoren der zweiten Stufe für die Acroleinoxidation zu Acrylsäure basierten hauptsächlich auf Kobalt-Molybdänoxiden und lieferten Ausbeuten von weniger als 70 Mol-%. Weitere Untersuchungen zeigten jedoch, dass verschiedene Mehrkomponenten-Metalloxidkatalysatoren, darunter Molybdän und Vanadium, sowie andere Elemente und Träger die Aktivität und Ausbeute steigern könnten.
Bei der Säurerückgewinnung und -reinigung wird das Abgas gekühlt und mit Wasser gewaschen, um eine wässrige Lösung von Acrylsäure zu erhalten. Diese Lösung wird dann durch Extraktion mit einem organischen Lösungsmittel, Destillation und Zugabe von Inhibitor gereinigt, um eine Polymerisation während der Destillation zu verhindern. Die Reinheit der resultierenden Acrylsäure liegt üblicherweise über 99,5 Gew.-%, mit einer gereinigten Ausbeute von etwa 98 %.
Es wurden verschiedene Reinigungsmethoden wie Oligomerisierung und direkte Veresterung untersucht, aber das Extraktionsverfahren mit leichtem Lösungsmittel ist aufgrund seiner Energieeffizienz und Produktqualität nach wie vor das am besten geeignete Verfahren für kommerzielle Anlagen. Andere Methoden wurden aufgrund ihres hohen Energieverbrauchs oder der Produktqualitätsprobleme nicht weithin kommerziell übernommen.
3.2. Biobasierte Acrylsäure
Bei biobasierten Technologien zur Herstellung von Acrylsäure werden aus Biomasse gewonnene Substanzen wie Zucker fermentiert, um Milchsäure, 3-Hydroxypropansäure und 3-Hydroxypropanal herzustellen. Anschließend werden diese Fermentationszwischenprodukte einer chemischen Umwandlung unterzogen, um Acrylsäure zu ergeben.
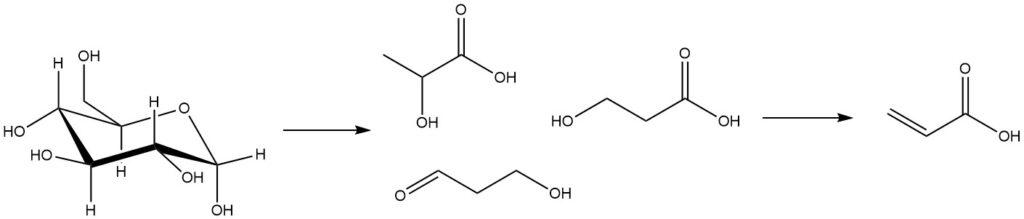
Die Dehydratisierung des Zwischenprodukts Milchsäure erfolgt typischerweise durch Acetoxylierung, wobei Essigsäure als azeotropes Lösungsmittel verwendet wird.
Von 2008 bis 2010 wurden mehrere biobasierte Technologien zur Acrylsäureproduktion eingeführt, die Rohstoffe wie Glukose, Glykol, Milchsäure und Biomasse nutzen.
Joint Ventures und einzelne Unternehmen wie Cargill/Novozymes/BASF, OPXBio/Dow, Arkema/THE, Nippon Shokubai, Geneomatica und Choren waren aktiv an der Entwicklung dieser Technologien beteiligt. Es wird erwartet, dass einige dieser Ansätze bis 2025 kommerzialisiert werden.
Verschiedene Joint Ventures, darunter Cargill/Novozymes/BASF und OPXBio/Dow, konzentrieren sich auf die Entwicklung von Enzymen oder Mikroorganismen zur Herstellung von Acrylsäure aus erneuerbaren Rohstoffen wie Mais und Zuckerrohr.
Arkema arbeitet in Zusammenarbeit mit HTE an der Entwicklung von Katalysatoren für die Herstellung von Acrylsäure aus Glycerin über Acrolein. Nippon Shokubai erforscht ein Gasphasenverfahren zur Herstellung von Acrylsäure aus Glycerin, das als Nebenprodukt bei der Biodieselproduktion aus Pflanzenölen anfällt. Das Kommerzialisierungspotenzial dieser Verfahren hängt von der Verfügbarkeit und dem Preis von Glycerin ab.
Der Ansatz von Genomatica umfasst die Fermentation von Zucker zu Fumarsäure und die anschließende Kreuzmetathese mit Ethylen zur Herstellung von Acrylsäure. Obwohl diese Technologie patentiert wurde, müssen noch erhebliche technische Herausforderungen bewältigt werden.
Der Fortschritt und Erfolg dieser biobasierten Technologien wird nicht nur von technologischen Fortschritten abhängen, sondern auch vom gesellschaftlichen Druck und der Forderung, Waren und Chemikalien aus erneuerbaren und nachhaltigen Quellen herzustellen.
4. Verwendung von Acrylsäure
Acrylsäure dient als Zwischenprodukt bei der Herstellung von Acrylaten. Acrylate sind eine Gruppe von Verbindungen, die von Acrylsäure abgeleitet sind und aufgrund ihrer Vielseitigkeit und Leistungseigenschaften in verschiedenen Branchen weit verbreitet sind.
Darüber hinaus finden Acrylsäure und ihre Natriumsalze zunehmend Anwendung als Flockungsmittel und Dispergiermittel. Diese polymeren Formen der Acrylsäure, insbesondere die polymeren Natriumsalze, gewinnen aufgrund ihrer wirksamen Eigenschaften bei der Förderung der Flockung (Verklumpung von Partikeln) und der Dispersion (gleichmäßige Verteilung der Partikel) in verschiedenen Prozessen und Anwendungen zunehmend an industrieller Bedeutung.
Im Jahr 2014 betrugen die weltweiten Produktionskapazitäten für Acrylsäure und ihre Ester mehr als 5,2 Millionen Tonnen pro Jahr bzw. 3,6 Millionen Tonnen pro Jahr.
China hat sich zu einem wachstumsstarken Markt für Acrylsäure entwickelt und übertrifft die gemeinsame Nachfrage in Nordamerika und Europa. Zwischen 2002 und 2014 hat sich Chinas Produktionskapazität für Acrylsäure nahezu vervierfacht, was auf die bedeutende Rolle des Unternehmens in der Branche hinweist.
Im Jahr 2014 wurden 50 % des gesamten Acrylsäureverbrauchs als Zwischenprodukt in der Esterproduktion genutzt, die anderen 50 % wurden zur Herstellung von Eisessig verarbeitet.
5. Toxikologie und Arbeitsmedizin
Acrylsäure ist mäßig giftig und stark ätzend. Beim Verschlucken kann es zu schweren Magen-Darm-Verätzungen kommen, außerdem reizt der Dampf die Augen und die Atemwege. Bei Hautkontakt kann es zu Verbrennungen kommen. Die folgenden physiologischen Reaktionsdaten sind verfügbar:
- LD50: 340 mg/kg (Ratte, oral)
- LC50: 3600 mg/m3 (Ratte, Inhalation, 5 l, 4 Stunden)
- LD50: 280 mg/kg (Kaninchen, Haut)
Der Schwellenwert (TLV) für Acrylsäure im zeitlich gewichteten Durchschnitt (TWA) ist auf 10 ppm (parts per million) oder 30 mg/m3 festgelegt. Dieser Wert dient als Richtlinie zur Kontrolle der Expositionswerte im beruflichen Umfeld.
Referenz
- Acrylic Acid and Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_161.pub4
FAQ zu Acrylsäure
Acrylsäure ist eine farblose flüssige organische Verbindung mit der chemischen Formel CH2=CHCOOH. Es gehört zur Familie der ungesättigten Carbonsäuren und hat einen starken, stechenden Geruch. Acrylsäure ist aufgrund des Vorhandenseins zweier ungesättigter Zentren hochreaktiv und somit ein wesentlicher Baustein für verschiedene chemische Prozesse und Polymerisationen.
Acrylsäure wird hauptsächlich als Zwischenprodukt bei der Herstellung von Acrylaten verwendet, einer vielseitigen Gruppe von Verbindungen, die häufig bei der Herstellung von Farben, Klebstoffen, Beschichtungen und superabsorbierenden Polymeren eingesetzt werden. Darüber hinaus werden Acrylsäure und ihre Natriumsalze als Flockungsmittel und Dispergiermittel in verschiedenen industriellen Anwendungen eingesetzt.
Acrylsäure wird typischerweise durch die katalytische Oxidation von Propen in der Dampfphase unter Verwendung von Luft und Dampf hergestellt. Der zweistufige Prozess umfasst die Oxidation von Propen zu Acrolein, gefolgt von der weiteren Oxidation von Acrolein zu Acrylsäure.
Unter Acrylsäurepolymer versteht man das Polymerisationsprodukt der Acrylsäure. Es ist allgemein als Polyacrylsäure (PAA) bekannt, wenn es in seiner löslichen Form vorliegt, oder als Natriumpolyacrylat, wenn es in seiner Natriumsalzform vorliegt. Diese Polymere sind wasserlöslich und verfügen über ausgezeichnete Flockungs- und Dispergiereigenschaften, was sie für Anwendungen wie Abwasserbehandlung, Waschmittelformulierungen und Körperpflegeprodukte wertvoll macht.
Acrylsäure gilt als schwache Säure. In seiner reinen Form weist es saure Eigenschaften auf, seine Stärke ist jedoch im Vergleich zu starken Mineralsäuren wie Schwefelsäure oder Salzsäure relativ geringer. In wässrigen Lösungen dissoziiert Acrylsäure teilweise unter Freisetzung von Wasserstoffionen, was ihr ein charakteristisches saures Verhalten verleiht.