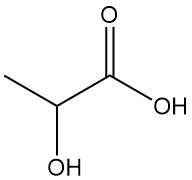
Milchsäure, auch 2-Hydroxypropionsäure genannt, ist eine natürliche organische Säure mit der Summenformel CH3CH(OH)COOH. Reine Milchsäure ist ein weißer, kristalliner Feststoff mit niedrigem Schmelzpunkt, der in vielen biologischen Systemen, einschließlich des menschlichen Körpers, vorkommt.
Es spielt eine wichtige Rolle bei der Zellatmung.
Milchsäure wurde erstmals 1780 vom schwedischen Chemiker Carl Wilhelm Scheele aus Sauermilch isoliert. Zunächst erschien es als unreiner bräunlicher Sirup. Später zeigte der französische Chemiker Michel Braconnot, dass Milchsäure durch Fermentationsprozesse hergestellt werden kann.
Das Jahr 1881 markierte den Beginn der Milchsäureproduktion im industriellen Maßstab in den USA.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Milchsäure
Milchsäure [50-21-5] ist die einfachste Hydroxycarbonsäure mit einem asymmetrischen Kohlenstoffatom und einer Molmasse von 90,08 g/mol. Es existiert in drei Formen:
- Racemische Mischung (DL): eine nicht optisch aktive Form, die gleiche Mengen der beiden optisch aktiven Isomere enthält.
- L-(+)-Milchsäure (CAS-Nummer: 79-33-4): Das optisch aktive L-Isomer.
- D-(-)-Milchsäure (CAS-Nummer: 10326-41-7): Das optisch aktive D-Isomer.
Reine, wasserfreie racemische Milchsäure ist ein weißer, kristalliner Feststoff mit niedrigem Schmelzpunkt, obwohl der genaue Wert aufgrund der Herausforderungen bei der Gewinnung einer vollständig wasserfreien Form schwer zu bestimmen ist. Die in der Literatur angegebenen Werte liegen zwischen 18 °C und 33 °C. Milchsäure durchläuft eine interne Veresterung zu Lactoylmilchsäure.
Die Isolierung einzelner optischer Isomere kann durch fraktionierte Kristallisation frisch destillierter Milchsäure erreicht werden. Der Schmelzpunkt reiner optischer Isomere liegt bei etwa 52,7–52,8 °C. Wasserfreie Milchsäure hat einen Siedepunkt von etwa 125–140 °C bei 27 kPa.
Aufgrund ihrer hygroskopischen Eigenschaft wird Milchsäure typischerweise als konzentrierte wässrige Lösung (bis zu 90 Gew.-%) gewonnen, die farblos und praktisch geruchlos ist und erhebliche Mengen an Lactoylmilchsäure und anderen Milchsäureoligomeren enthält.
Diese Lösung ist vollständig mit Wasser, Ethanol, Diethylether und anderen wassermischbaren organischen Lösungsmitteln mischbar. Es ist in Benzol und Chloroform.
Historisch gesehen war synthetische Milchsäure eine razemische Mischung. Durch Fermentation hergestellte Milchsäure ist jedoch optisch aktiv, wobei das spezifische produzierte Isomer von der Art der beteiligten Bakterien abhängt.
Milchsäure hat eine Dissoziationskonstante (K) von 1,38 x 10-4 bei 25 °C, was einem pKa von 3,86 entspricht. Eine 10 Gew.-%ige wässrige Milchsäurelösung hat einen pH-Wert von etwa 1,75.
Dichte-, Viskositäts-, Brechungsindex- und Leitfähigkeitsdaten für wässrige Milchsäurelösungen unterschiedlicher Konzentration sind in Tabelle 1 aufgeführt.
| Konzentration, Gew.-% | Dichte, g/ml | Viskosität, mPa·s | Brechungsindex | Leitfähigkeit, mS/cm |
|---|---|---|---|---|
| 6,29 | 1,0115 | 1.042 | 1.3390 | 3.670 |
| 25.02 | 1,0570 | 1,725 | 1,3586 | 3.823 |
| 54,94 | 1.1302 | 4,68 | 1.3909 | 1.530 |
| 88,60 | 1.2006 | 36,9 | 1,4244 | 0,0567 |
2. Chemische Reaktionen von Milchsäure
2.1. Interne Veresterung und Polymerisation
Milchsäure, die sowohl funktionelle Hydroxyl- als auch Carbonsäuregruppen besitzt, unterliegt einer internen Veresterung, um durch bimolekulare Veresterung Lactoylmilchsäure (2-(2-Hydroxypropanoyloxy)propansäure) (1) oder Lactid (2), einen zyklischen Ester, zu bilden.
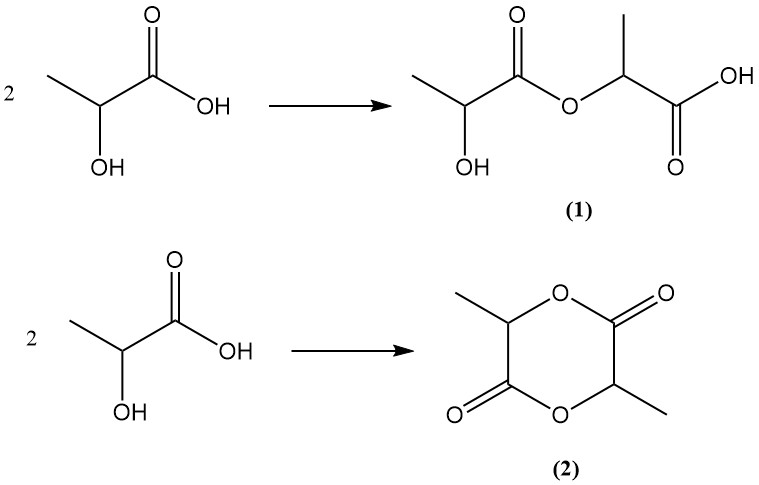
Lactid liegt in drei stereoisomeren Formen vor: L,L-Lactid, D,D-Lactid und D,L-Lactid, abhängig von der Chiralität der Milchsäurebestandteile.
Polymilchsäuren können durch weitere Kondensation von Lactoylmilchsäure hergestellt werden. Dabei handelt es sich um lineare Polyester mit unterschiedlichen Kettenlängen. , können identische chemische Strukturen durch die ringöffnende Polymerisation von Lactid erhalten werden, wobei in diesem Fall typischerweise der Begriff „Polylactid“ verwendet wird.
Handelsübliche wässrige Milchsäurelösungen enthalten je nach Konzentration und Lagerzeit unterschiedliche Anteile an Lactoylmilchsäure und Polymilchsäuren.
Verdünnte Lösungen (etwa 6,5 Gew.-%) können etwa 0,2 Gew.-% Lactoylmilchsäure enthalten, während konzentrierte Lösungen (88 Gew.-%) möglicherweise weniger als 60 % freie Milchsäure enthalten und selbst 100 %ige Milchsäurelösungen möglicherweise nur 32 % der freien Milchsäure enthalten Monomerform.
2.2. Veresterung mit Alkoholen
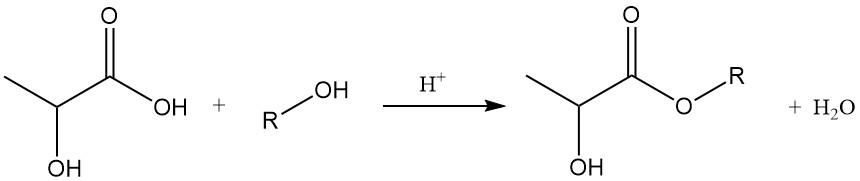
Lactate niederer Alkohole können leicht durch direkte Reaktion mit dem entsprechenden Alkohol synthetisiert werden. Die Reaktionsausbeute kann verbessert werden, indem das erzeugte Wasser durch azeotrope Destillation entfernt wird. Alternativ können Laktatester durch minimale wassererzeugende Reaktionen zwischen Alkoholen und Polymilchsäure hergestellt werden.
2.3. Andere Reaktionen
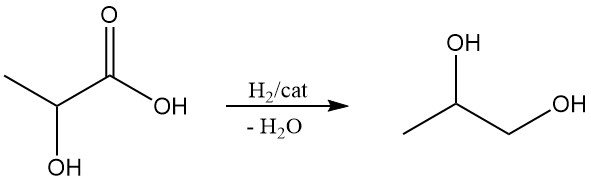
Milchsäure könnte ein kostengünstiger Ausgangsstoff für Propylenglykol (1,2-Propandiol) und Acrylsäure sein, zwei wichtige Chemikalien. Propylenglykol kann durch Reduktion von Milchsäure gewonnen werden, und durch Dehydrierung von Milchsäure entsteht Acrylsäure.
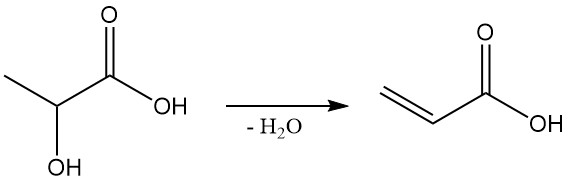
Darüber hinaus spielt Milchsäure eine wichtige Rolle in biologischen Prozessen.
3. Produktion von Milchsäure
Milchsäure wird kommerziell entweder durch Fermentation oder durch synthetische Methoden hergestellt. Seit etwa 1995 dominiert jedoch der Fermentationsprozess die neue Produktionskapazität. Diese Verschiebung wird durch die Fähigkeit der Fermentation vorangetrieben, Milchsäure mit hoher chiraler Reinheit zu erzeugen, ein entscheidender Faktor für Anwendungen in der Lebensmittel- und Polymerindustrie.
3.1. Produktion von Milchsäure durch Fermentation
Bei der Milchsäureproduktion durch Fermentation werden Kohlenhydrate, Nährstoffe und bestimmte Mikroorganismen verwendet.
Die verwendeten Kohlenhydrate bestehen überwiegend aus Hexosen (Glukose, Fruktose) oder leicht abbaubaren Hexosevorläufern (Maissirup, Melasse, Zuckerrübensaft, Molke). Es werden auch Stärken aus Reis, Weizen, Mais und Kartoffeln verwendet.
Mit der Weiterentwicklung der Hydrolysetechnologie von Lignozellulosematerialien könnten diese Rohstoffe neben Pentosezuckern (Xylose, Arabinose) zu einer kostengünstigen Kohlenhydratquelle werden.
Verschiedene Mikroorganismen sind in der Lage, Milchsäure in großen Mengen zu produzieren, darunter die Stämme Lactobacillus, Bacillus und Rhizopus. Rhizopus-Pilze bieten den Vorteil, dass sie keine komplexen Stickstoffquellen benötigen, produzieren aber im Vergleich zu Bakterienstämmen typischerweise weniger Milchsäure.
Bakterienstämme führen im Allgemeinen eine anaerobe Fermentation durch, während Rhizopus aerobe Prozesse nutzt. Bevorzugt werden homofermentative Bakterienstämme, die die Bildung von Nebenprodukten minimieren.
Die bei der Fermentation verwendeten Mikroorganismen benötigen lösliche Peptide, Aminosäuren, Phosphate, Ammoniumsalze und Vitamine. Komplexe Stickstoffquellen wie Hefeextrakt, Maisquellwasser oder Peptone (Soja, Fleisch) werden häufig in kleinen Mengen zur einfacheren Milchsäurereinigung verwendet.
Der pH-Wert der Brühe muss während der Fermentation zwischen 5,0 und 6,5 gehalten werden. Neutralisierungsmittel wie Calciumhydroxid, Carbonat oder Natrium-/Ammoniumhydroxid werden verwendet, um der Milchsäureproduktion entgegenzuwirken, was zur Bildung von Calciumlactat-, Ammoniumlactat- oder Natriumlactatsalzen in der Brühe führt.
Für die Produktion im industriellen Maßstab sind große Mengen an bakteriellem Inokulum erforderlich, das in einer speziellen Saatgutkette kultiviert wird. Um hohe Erträge und chirale Reinheit zu gewährleisten, sind strenge Maßnahmen erforderlich, um die Kontamination im Saatgutstrang und in den Produktionsbehältern zu minimieren.

Die Milchsäureausbeute liegt typischerweise zwischen 85 % und 95 %, basierend auf den vergärbaren Zuckern. Übliche Fermentationsnebenprodukte wie Ameisensäure und Essigsäure sind normalerweise in Konzentrationen unter 0,5 Gew.-% vorhanden.
Zu den jüngsten Fortschritten in der Fermentationstechnologie gehören gentechnisch veränderte Hefestämme für die Milchsäureproduktion unter neutralen oder niedrigen pH-Bedingungen. Diese manipulierten Mikroorganismen bieten Vorteile wie definierte Medienanforderungen und die Fähigkeit, Milchsäure direkt (keine Laktatsalze) in der Brühe zu produzieren.
Durch die Fermentation mit niedrigem pH-Wert entfallen möglicherweise die Kosten, die mit Neutralisierungsmitteln, Säuerungsmitteln und der Entsorgung von Nebenproduktsalzen verbunden sind.
3.2. Milchsäurereinigung
Nach der Fermentation muss die milchsäurehaltige Brühe für bestimmte Endanwendungen gereinigt werden. Der Grad der Reinigung variiert je nach Anwendung. Lebensmittelanwendungen erfordern möglicherweise nur eine minimale Reinigung, während Anwendungen wie die Produktion von Polylactidmonomeren eine umfassende Reinigung erfordern.
Die Wahl der Nährstoffe und Mikroorganismen während der Fermentation hat erheblichen Einfluss auf die nachgelagerten Reinigungsschritte. Komplexe Stickstoffquellen und Nebenprodukte von Mikroorganismen tragen zu Verunreinigungen bei, die entfernt werden müssen. Einheitsoperationen werden verwendet, um restliche Proteine, Aminosäuren, Zucker, Kationen, Anionen und andere organische Säuren zu entfernen.
In jedem Fall ist die Entfernung von Mikroorganismen aus der Brühe unerlässlich. Die Entfernungstechnik hängt von dem spezifischen Mikroorganismus ab, der bei der Fermentation verwendet wird.
- Bakterienstämme können durch Flockung unter alkalischen Bedingungen oder Ultrafiltration entfernt werden.
- Für Rhizopus ist eine sorgfältige Kontrolle der Zellmorphologie im Fermenter entscheidend für eine effiziente Trennung auf Filtern.
Bei der Gärung entstehende Laktatsalze müssen in Milchsäure umgewandelt werden. Eine gängige großtechnische Methode ist die Zugabe von Schwefelsäure zu Calciumlactat. Bei dieser Methode entsteht ein minderwertiges Calciumsulfat (Gips) als Nebenprodukt mit begrenzter Wasserlöslichkeit.
Umfangreiche Forschungsarbeiten haben sich auf alternative Verfahren zur Vermeidung der Bildung von Nebenproduktsalzen konzentriert, beispielsweise die wasserspaltende Elektrodialyse und die kohlendioxidunterstützte Flüssig-Flüssig-Extraktion.
Bei bestimmten Lebensmittelanwendungen wird die Brühe zur Reinigung durch Aktivkohle und Ionenaustauscherharze geleitet. Im Anschluss an diesen Schritt wird die Brühe entsprechend den Kundenspezifikationen konzentriert.
Pharmazeutische, Polymer- und andere Anwendungen erfordern eine weitere Reinigung der Milchsäure. Es kommen mehrere großtechnische Verfahren zum Einsatz, wobei die Flüssig-Flüssig-Extraktion mit langkettigen tertiären Aminen in der organischen Phase eine interessante Methode ist.
Dabei wird Milchsäure bei niedriger Temperatur selektiv in die organische Phase extrahiert und anschließend bei hoher Temperatur in Wasser rückextrahiert, um einen hochwertigen Milchsäurestrom zu erhalten. Die Säure-Amin-Komplexierung trägt zu einer hohen Selektivität für Milchsäure gegenüber Restzuckern und Proteinen bei.
Die Milchsäuredestillation ist unter bestimmten Betriebsbedingungen möglich, die die Bildung von Milchsäureoligomeren minimieren, die die Ausbeute begrenzen können. Durch die Destillation eines Laktatesters wie Ethyllactat kann ebenfalls hochwertige Milchsäure hergestellt werden, die Veresterungs- und Hydrolysereaktionen sind jedoch zusätzlich aufwändig.
Umfangreiche Forschungsarbeiten haben die Verwendung von Membranen zur Milchsäurereinigung, einschließlich Elektrodialyse und Anionenaustausch, untersucht. Diese Technologien könnten in zukünftigen Milchsäureproduktionsanlagen eine Rolle spielen.
3.3. Synthese von Milchsäure
Während die Fermentation seit Mitte der 1990er Jahre die Milchsäureproduktion dominiert, gibt es seit den 1960er Jahren auch synthetische Verfahren. Das derzeitige industrielle Verfahren zur Herstellung von Milchsäure umfasst die Reaktion von Acetaldehyd mit Cyanwasserstoff und die anschließende Hydrolyse des resultierenden Lactonitrils.
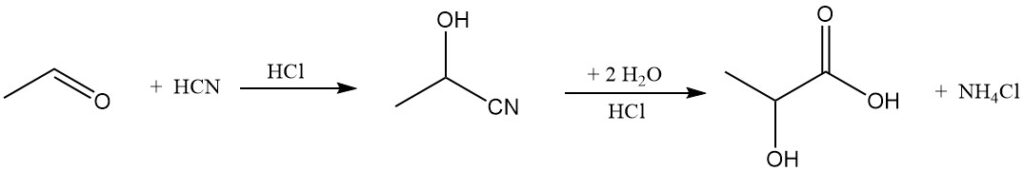
Musashino ist derzeit der letzte große Hersteller synthetischer Milchsäure. Allerdings könnte die mögliche Entwicklung einer kostengünstigen Syntheseroute, die einen enantioselektiven Katalysator zur Erzeugung chiral reiner Milchsäure nutzt, in Zukunft zu einem teilweisen Ersatz von Fermentationsmethoden führen.
4. Verwendung von Milchsäure
Milchsäure und ihre Derivate (Salze und Ester) werden in drei Hauptsektoren verwendet: Lebensmittel, Polymere und Industrie.
4.1. Verwendung in Lebensmitteln
Traditionell ist die Lebensmittelindustrie der größte Verbraucher von Milchsäure und Laktatsalzen. Milchsäure wird hauptsächlich als Säuerungsmittel und Konservierungsmittel verwendet. Sein mild-säuerlicher Geschmack passt zu verschiedenen Speisen, ohne andere Geschmacksrichtungen zu übertönen.
Da es sich bei Milchsäure um eine natürlich vorkommende Substanz handelt, gelangen keine Fremdstoffe in die Nahrung. Ihre gut löslichen Salze machen sie zu geeigneten Teilersatzstoffen für Säuren in Puffersystemen.
Milchsäure und ihre Salze werden häufig in verschiedenen Lebensmitteln verwendet, darunter Getränke, Süßigkeiten, Fleisch und Saucen. Zur Herstellung kalziumangereicherter Produkte kann den Lebensmitteln Kalziumlaktat zugesetzt werden. Steroyllactat und seine Natrium- und Calciumsalze werden in Brot verwendet.
4.2. Verwendung in Polymeren
Milchsäure ist ein Monomer, das zur Herstellung von Polymilchsäure oder Polylactid verwendet wird. NatureWorks LLC ist ein bedeutender Hersteller von Polymilchsäure, die durch ringöffnende Polymerisation von Lactid synthetisiert wird. Lactid selbst entsteht durch die Kondensation zweier Milchsäuremoleküle.
Zu den Anwendungen von Polymilchsäure gehören Lebensmittel- und Getränkebehälter, Folien und starre Verpackungsbehälter sowie Servicegeschirr wie Tassen, Teller und Utensilien. Polymilchsäure kann zu Fasern gesponnen werden, die in Kleidung, Faserfüllungen (Kissen, Bettdecken), Teppichen und Vliesstoffanwendungen wie Tüchern verwendet werden.
4.3. Industrielle Anwendungen
Milchsäure und ihre Derivate werden in der Metallbeschichtung, in der Kosmetik-, Textil- und Lederindustrie verwendet. Laktatester werden bei der Herstellung von Farben und Tinten, Elektronik und Metallreinigungslösungen verwendet. Milchsäure wird auch in der Landwirtschaft als Tierfutter verwendet.
5. Toxikologie von Milchsäure
Milchsäure ist eine ungiftige, natürlich vorkommende Speisesäure, die als Säuerungsmittel in der Lebensmittelindustrie verwendet wird. Aufgrund seiner sauren Natur kann es jedoch bei Kontakt mit den Augen oder verletzter Haut zu Reizungen führen. In solchen Fällen wird eine sofortige Spülung mit Wasser empfohlen.
Unter normalen Verwendungsbedingungen stellt die orale Toxizität kein großes Problem dar. Allerdings kann die Aufnahme großer Mengen schädlich sein, mit einer LD50 (letale Dosis 50 %) von 3730 mg/kg bei Ratten. Vermeiden Sie als allgemeine Sicherheitsvorkehrung den Kontakt mit Augen und Haut und nehmen Sie keine großen Mengen ein.
Verweise
- Lactic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a15_097.pub3
- Technological and economic potential of poly(lactic acid) and lactic acid derivatives


