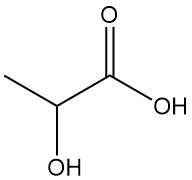
L’acide lactique, également connu sous le nom d’acide 2-hydroxypropionique, est un acide organique naturel de formule moléculaire CH3CH(OH)COOH. L’acide lactique pur est un solide cristallin blanc avec un point de fusion bas que l’on trouve dans de nombreux systèmes biologiques, y compris le corps humain.
Il joue un rôle important dans la respiration cellulaire.
L’acide lactique a été isolé pour la première fois en 1780 par le chimiste suédois Carl Wilhelm Scheele à partir du lait aigre. Initialement, il apparaissait comme un sirop brunâtre impur. Plus tard, le chimiste français Michel Braconnot a démontré que l’acide lactique pouvait être produit par des processus de fermentation.
L’année 1881 marque le début de la production industrielle d’acide lactique aux États-Unis.
Table des matières
1. Propriétés physiques de l’acide lactique
L’acide lactique [50-21-5] est l’acide hydroxycarboxylique le plus simple contenant un atome de carbone asymétrique avec une masse molaire de 90,08 g/mol. Il existe sous trois formes :
- Mélange racémique (DL) : forme non optiquement active contenant des quantités égales des deux isomères optiquement actifs.
- Acide L-(+)-lactique (numéro CAS : 79-33-4) : l’isomère L optiquement actif.
- Acide D-(-)-lactique (numéro CAS : 10326-41-7) : l’isomère D optiquement actif.
L’acide lactique racémique pur et anhydre est un solide cristallin blanc avec un point de fusion bas, bien que la valeur exacte soit difficile à déterminer en raison des difficultés rencontrées pour obtenir une forme complètement anhydre. Les valeurs rapportées dans la littérature vont de 18°C à 33°C. L’acide lactique subit une estérification interne pour former de l’acide lactoyllactique.
L’isolement d’isomères optiques individuels peut être réalisé par cristallisation fractionnée d’acide lactique fraîchement distillé. Le point de fusion des isomères optiques purs se situe entre 52,7 et 52,8 °C. L’acide lactique anhydre a un point d’ébullition d’environ 125 à 140 °C à 27 kPa.
En raison de sa propriété hygroscopique, l’acide lactique est généralement obtenu sous forme d’une solution aqueuse concentrée (jusqu’à 90 % en poids), incolore, pratiquement inodore et contenant des quantités importantes d’acide lactoyllactique et d’autres oligomères d’acide lactique.
Cette solution est complètement miscible avec l’eau, l’éthanol, l’éther diéthylique et d’autres solvants organiques miscibles à l’eau. Il est pratiquement insoluble dans le benzène et le chloroforme.
Historiquement, l’acide lactique synthétique était un mélange racémique. Cependant, l’acide lactique produit par fermentation est optiquement actif, l’isomère spécifique produit dépendant du type de bactérie impliquée.
L’acide lactique a une constante de dissociation (K) de 1,38 x 10-4 à 25 °C, correspondant à un pKa de 3,86. Une solution aqueuse à 10 % en poids d’acide lactique a un pH d’environ 1,75.
Les données de densité, de viscosité, d’indice de réfraction et de conductivité pour les solutions aqueuses d’acide lactique de différentes concentrations sont fournies dans le Tableau 1.
| Concentration, % en poids | Densité, g/mL | Viscosité, mPa·s | Indice de réfraction | Conductivité, mS/cm |
|---|---|---|---|---|
| 6.29 | 1.0115 | 1.042 | 1.3390 | 3.670 |
| 25.02 | 1.0570 | 1,725 | 1.3586 | 3.823 |
| 54,94 | 1.1302 | 4,68 | 1.3909 | 1.530 |
| 88,60 | 1.2006 | 36,9 | 1.4244 | 0,0567 |
2. Réactions chimiques de l’acide lactique
2.1. Estérification interne et polymérisation
L’acide lactique, possédant à la fois des groupes fonctionnels hydroxyle et acide carboxylique, subit une estérification interne pour former de l’acide lactoyllactique (acide 2-(2-hydroxypropanoyloxy)propanoïque) (1) ou du lactide (2), un ester cyclique, par estérification bimoléculaire.
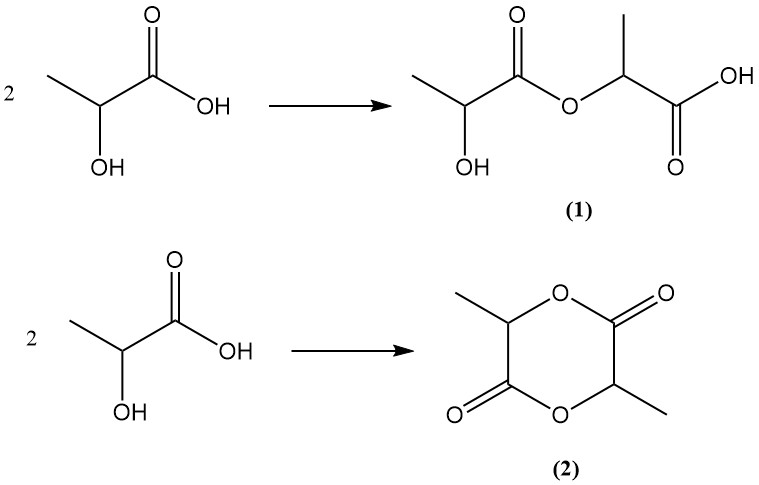
Le lactide existe sous trois formes stéréoisomères : L,L-lactide, D,D-lactide et D,L-lactide, en fonction de la chiralité des unités d’acide lactique constitutives.
Les acides polylactiques peuvent être produits par condensation supplémentaire de l’acide lactoyllactique. Ce sont des polyesters linéaires avec différentes longueurs de chaîne. , des structures chimiques identiques peuvent être obtenues via la polymérisation par ouverture de cycle du lactide, auquel cas le terme « polylactide » est généralement utilisé.
Les solutions aqueuses d’acide lactique disponibles dans le commerce contiennent des proportions variables d’acide lactoyllactique et d’acides polylactiques, influencées par la concentration et la durée de stockage.
Les solutions diluées (environ 6,5 % en poids peuvent contenir environ 0,2 % en poids d’acide lactoyllactique, tandis que les solutions concentrées (88 % en poids) peuvent contenir moins de 60 % d’acide lactique libre, et même les solutions à 100 % d’acide lactique ne peuvent contenir que 32 % de l’acide lactique libre. forme monomère.
2.2. Estérification avec des alcools
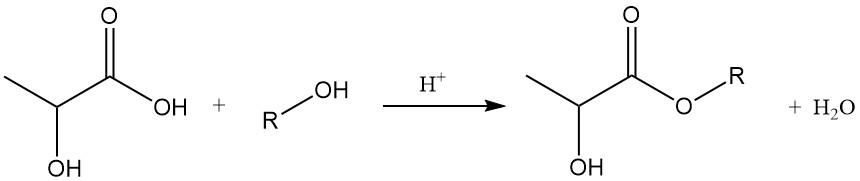
Les lactates d’alcools inférieurs peuvent être facilement synthétisés par réaction directe avec l’alcool correspondant. Le rendement de la réaction peut être amélioré en éliminant l’eau générée par distillation azéotropique. Alternativement, les esters de lactate peuvent être produits par des réactions minimes génératrices d’eau entre les alcools et l’acide polylactique.
2.3. Autres réactions
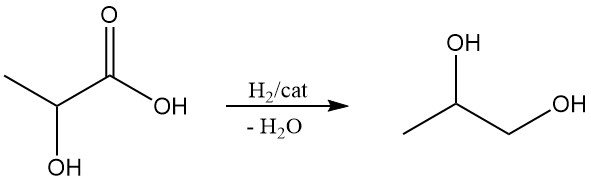
L’acide lactique a le potentiel d’être une matière première rentable pour le propylène glycol (1,2-propanediol) et l’acide acrylique, deux produits chimiques importants. Le propylène glycol peut être obtenu par réduction de l’acide lactique et la déshydratation de l’acide lactique produit de l’acide acrylique.
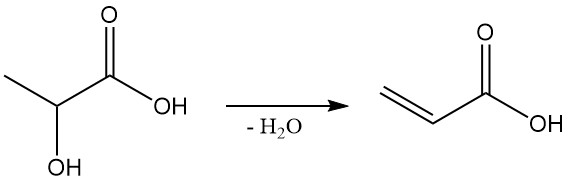
De plus, l’acide lactique joue un rôle important dans les processus biologiques.
3. Production d’acide lactique
L’acide lactique est produit commercialement par des méthodes de fermentation ou de synthèse. Cependant, depuis 1995 environ, le processus de fermentation a dominé les nouvelles capacités de production. Ce changement est dû à la capacité de la fermentation à générer de l’acide lactique d’une pureté chirale élevée, un facteur critique pour les applications dans les industries alimentaires et des polymères.
3.1. Production d’acide lactique par fermentation
La production d’acide lactique par fermentation utilise des glucides, des nutriments et des micro-organismes spécifiques.
Les glucides utilisés sont principalement constitués d’hexoses (glucose, fructose) ou de précurseurs d’hexoses facilement dégradables (sirops de maïs, mélasse, jus de betterave sucrière, lactosérum). Les amidons de riz, de blé, de maïs et de pomme de terre sont également utilisés.
À mesure que la technologie d’hydrolyse des matières lignocellulosiques progresse, ces matières premières, ainsi que les sucres pentoses (xylose, arabinose), pourraient devenir une source de glucides à faible coût.
Divers micro-organismes sont capables de produire un volume élevé d’acide lactique, notamment les souches Lactobacillus, Bacillus et Rhizopus. Les champignons Rhizopus offrent l’avantage de ne pas nécessiter de sources d’azote complexes, mais produisent généralement moins d’acide lactique que les souches bactériennes.
Les souches bactériennes effectuent généralement une fermentation anaérobie, tandis que Rhizopus utilise des processus aérobies. Les souches bactériennes homofermentaires qui minimisent la formation de sous-produits sont préférées.
Les micro-organismes utilisés dans la fermentation nécessitent des peptides solubles, des acides aminés, des phosphates, des sels d’ammonium et des vitamines. Les sources d’azote complexes comme l’extrait de levure, la liqueur de maïs ou les peptones (soja, viande) sont souvent utilisées en petites quantités pour une purification plus simple de l’acide lactique.
Le pH du bouillon doit être maintenu entre 5,0 et 6,5 pendant la fermentation. Des agents neutralisants comme l’hydroxyde de calcium, le carbonate ou l’hydroxyde de sodium/ammonium sont utilisés pour contrecarrer la production d’acide lactique, entraînant la formation de lactate de calcium, de lactate d’ammonium ou de sels de lactate de sodium dans le bouillon.
La production à l’échelle industrielle nécessite la culture de grandes quantités d’inoculum bactérien dans un train de semences dédié. Des mesures strictes sont nécessaires pour minimiser la contamination dans le train de semences et les cuves de production afin de garantir des rendements élevés et une pureté chirale.

Les rendements en acide lactique varient généralement de 85 % à 95 % sur la base des sucres fermentescibles. Les sous-produits de fermentation courants comme l’acide formique et l’acide acétique sont généralement présents à des concentrations inférieures à 0,5 % en poids.
Les progrès récents dans la technologie de fermentation impliquent des souches de levure génétiquement modifiées pour la production d’acide lactique dans des conditions neutres ou à faible pH. Ces micro-organismes modifiés offrent des avantages tels que des exigences définies en matière de milieux et la capacité de produire de l’acide lactique directement (et non des sels de lactate) dans le bouillon.
La fermentation à faible pH élimine potentiellement les coûts associés aux agents neutralisants, aux agents acidifiants et à l’élimination du sel sous-produit.
3.2. Purification de l’acide lactique
Après la fermentation, le bouillon contenant de l’acide lactique doit être purifié pour des utilisations finales spécifiques. Le degré de purification varie en fonction de l’application. Les applications alimentaires peuvent nécessiter une purification minimale, tandis que des applications telles que la production de monomères polylactides nécessitent une purification approfondie.
Le choix des nutriments et des micro-organismes pendant la fermentation a un impact significatif sur les étapes de purification en aval. Les sources complexes d’azote et les sous-produits issus de micro-organismes contribuent aux impuretés qui doivent être éliminées. Les opérations unitaires sont utilisées pour éliminer les protéines résiduelles, les acides aminés, les sucres, les cations, les anions et autres acides organiques.
L’élimination des micro-organismes du bouillon est essentielle dans tous les cas. La technique d’élimination dépend du micro-organisme spécifique utilisé lors de la fermentation.
- Les souches bactériennes peuvent être éliminées par floculation dans des conditions alcalines ou par ultrafiltration.
- Pour Rhizopus, un contrôle minutieux de la morphologie cellulaire au sein du fermenteur est crucial pour une séparation efficace sur filtres.
Les sels de lactate formés lors de la fermentation doivent être convertis en acide lactique. Une méthode courante à grande échelle consiste à ajouter de l’acide sulfurique au lactate de calcium. Cette méthode génère un sous-produit de sulfate de calcium (gypse) de faible valeur avec une solubilité dans l’eau limitée.
Des recherches considérables se sont concentrées sur des procédés alternatifs permettant d’éviter la formation de sous-produits salins, tels que l’électrodialyse par séparation de l’eau et l’extraction liquide-liquide assistée par dioxyde de carbone.
Pour certaines applications alimentaires, le bouillon passe à travers du charbon actif et des résines échangeuses d’ions pour être purifié. Suite à cette étape, le bouillon est concentré pour répondre aux spécifications du client.
Les applications pharmaceutiques, polymères et autres nécessitent une purification plus poussée de l’acide lactique. Plusieurs procédés à grande échelle sont utilisés, l’extraction liquide-liquide utilisant des amines tertiaires à longue chaîne dans la phase organique étant une méthode intéressante.
Ici, l’acide lactique est extrait sélectivement dans la phase organique à basse température, puis réextrait dans l’eau à haute température pour produire un flux d’acide lactique de haute qualité. La complexation acide-amine contribue à une sélectivité élevée de l’acide lactique par rapport aux sucres et protéines résiduels.
La distillation de l’acide lactique est réalisable dans des conditions opératoires spécifiques qui minimisent la formation d’oligomères d’acide lactique, ce qui peut limiter le rendement. La distillation d’un ester lactate, tel que le lactate d’éthyle, peut également produire de l’acide lactique de haute qualité, mais introduit la complexité supplémentaire des réactions d’estérification et d’hydrolyse.
Des recherches importantes ont exploré l’utilisation de membranes pour la purification de l’acide lactique, y compris l’électrodialyse et l’échange d’anions. Ces technologies pourraient jouer un rôle dans les futures installations de production d’acide lactique.
3.3. Synthèse de l’acide lactique
Si la fermentation domine la production d’acide lactique depuis le milieu des années 1990, des procédés de synthèse existent également depuis les années 1960. La méthode industrielle actuelle de fabrication de l’acide lactique implique la réaction de l’acétaldéhyde avec le cyanure d’hydrogène, suivie de l’hydrolyse du lactonitrile obtenu.
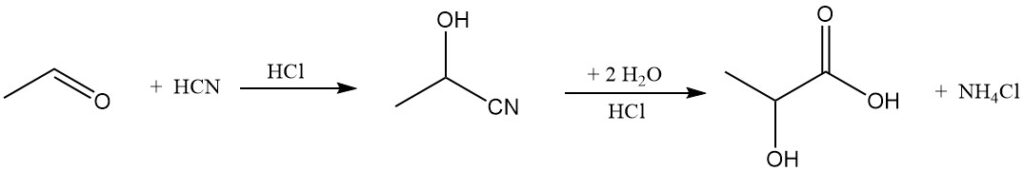
Musashino est actuellement le dernier grand producteur d’acide lactique synthétique. Cependant, le développement potentiel d’une voie de synthèse rentable utilisant un catalyseur énantiosélectif pour générer de l’acide lactique chiralement pur pourrait conduire à un remplacement partiel des méthodes de fermentation à l’avenir.
4. Utilisations de l’acide lactique
L’acide lactique et ses dérivés (sels et esters) sont utilisés dans trois secteurs principaux : l’alimentation, les polymères et l’industrie.
4.1. Utilisations dans l’alimentation
Traditionnellement, l’industrie alimentaire est la plus grande consommatrice d’acide lactique et de sels de lactate. L’acide lactique est principalement utilisé comme acidulant et conservateur. Son goût légèrement acide complète divers aliments sans dominer les autres saveurs.
De plus, étant une substance naturelle, l’acide lactique n’introduit pas d’éléments étrangers dans les aliments. Ses sels hautement solubles en font des substituts partiels appropriés aux acides dans les systèmes tampons.
L’acide lactique et ses sels sont largement utilisés dans divers produits alimentaires, notamment les boissons, les bonbons, la viande et les sauces. Le lactate de calcium peut être ajouté aux aliments pour fabriquer des produits enrichis en calcium. Le lactate de stéroyle et ses sels de sodium et de calcium sont utilisés dans le pain.
4.2. Utilisations dans les polymères
L’acide lactique est un monomère utilisé pour la production d’acide polylactique, ou polylactide. NatureWorks LLC est un producteur majeur d’acide polylactique, qui est synthétisé par polymérisation par ouverture de cycle du lactide. Le lactide lui-même est formé par la condensation de deux molécules d’acide lactique.
Les utilisations de l’acide polylactique comprennent les récipients pour aliments et boissons, les films et les récipients rigides pour l’emballage, ainsi que les ustensiles de service comme les tasses, les assiettes et les ustensiles. L’acide polylactique peut être transformé en fibres destinées à être utilisées dans les vêtements, les fibres (oreillers, couettes), les tapis et les applications non tissées telles que les lingettes.
4.3. Utilisations industrielles
L’acide lactique et ses dérivés sont utilisés dans l’industrie du placage de métaux, des cosmétiques, du textile et du cuir. Les esters de lactate sont utilisés dans la production de peintures et d’encres, de produits électroniques et de solutions de nettoyage des métaux. L’acide lactique est également utilisé en agriculture comme aliment pour animaux.
5. Toxicologie de l’acide lactique
L’acide lactique est un acide comestible naturel non toxique utilisé comme acidulant dans l’industrie alimentaire. Cependant, en raison de sa nature acide, il peut provoquer une irritation au contact des yeux ou de la peau éraflée. Dans de tels cas, un rinçage immédiat à l’eau est recommandé.
La toxicité orale n’est pas une préoccupation majeure dans des conditions normales d’utilisation. Cependant, l’ingestion de grandes quantités peut être nocive, avec une DL50 (dose létale 50 %) de 3 730 mg/kg chez le rat. Par mesure de sécurité générale, évitez tout contact avec les yeux et la peau et n’ingérez pas de grandes quantités.
Références
- Lactic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a15_097.pub3
- Technological and economic potential of poly(lactic acid) and lactic acid derivatives

