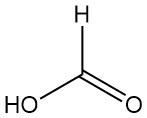
Qu’est-ce que l’acide formique ?
L’acide méthanoïque, plus connu sous le nom d’acide formique, est l’acide carboxylique le plus simple, de formule HCOOH. C’est un liquide incolore, corrosif, à l’odeur piquante, qui est complètement miscible à l’eau et à de nombreux solvants polaires, mais seulement partiellement miscible aux hydrocarbures.
L’acide formique tire son nom des fourmis (latin. Formica), dont il a été obtenu pour la première fois par distillation sèche. La première étude scientifique sur ses propriétés, « Concernant quelques observations et expériences peu communes faites avec un jus acide trouvé chez les fourmis », a été publiée dès 1670.
Table des matières
1. Propriétés physiques de l’acide formique
L’acide formique est un liquide incolore, clair et corrosif, à l’odeur piquante. C’est l’acide alkylcarboxylique non substitué le plus fort.
La dépendance de la densité de l’acide formique à la température est indiquée dans le tableau 1.
| Température, °C | Densité, g/cm3 |
|---|---|
| 0 | 1,244 |
| 10 | 1,232 |
| 15 | 1,226 |
| 20 | 1,220 |
| 25 | 1,214 |
| 30 | 1,207 |
| 40 | 1,195 |
| 50 | 1,182 |
| 60 | 1,169 |
| 70 | 1,156 |
| 80 | 1,143 |
| 90 | 1,130 |
| 100 | 1,117 |
L’acide formique n’augmente pas de volume lorsqu’il se solidifie et a tendance à subir une surfusion.
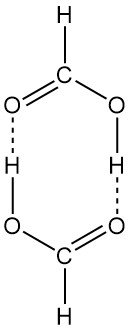
Le tableau 2 montre la courbe de pression de vapeur de l’acide formique pur. La vapeur d’acide formique s’écarte considérablement du comportement d’un gaz idéal car les molécules se dimérisent partiellement en phase vapeur. À température ambiante et pression normale, 95 % de la vapeur d’acide formique est constituée d’acide formique dimérisé.
| Liquide | Solide | ||
|---|---|---|---|
| Température, °C | Pression (kPa) | Température, °C | Pression (kPa) |
| -5,23 | 1,083 | -5,07 | 0,664 |
| 0,00 | 1,488 | 0,00 | 1,096 |
| 8,25 | 2,392 | 8,25 | 2,392 |
| 12,57 | 3,029 | - | - |
| 20,00 | 4,473 | - | - |
| 29,96 | 7,248 | - | - |
| 39,89 | 11,357 | - | - |
| 49,93 | 17,347 | - | - |
| 59,98 | 25,693 | - | - |
| 70,04 | 37,413 | - | - |
| 79,93 | 52,747 | - | - |
| 100,68 | 101,667 | - | - |
| 110,62 | 135,680 | - | - |
L’enthalpie de la dimérisation en phase gazeuse est de -63,8 kJ/mol.
La structure dimérique de type cyclique existe à la fois en phase vapeur et en solution. L’acide formique liquide est constitué de longues chaînes de molécules liées entre elles par des liaisons hydrogène. L’acide formique solide peut également être isolé sous deux formes polymorphes (α et β).
L’acide formique et l’eau forment un mélange azéotropique à point d’ébullition maximal dont le point d’ébullition est de 107,6 °C à 101,3 kPa ; il est constitué de 77,6 % en poids d’acide formique et de 22,4 % en poids d’eau.
La variation de la viscosité dynamique avec la température est illustrée dans le tableau 3. La viscosité dynamique des mélanges acide formique-eau diminue de manière approximativement linéaire à mesure que la teneur en eau de l’acide formique augmente. La conductivité thermique de l’acide formique est nettement supérieure à celle de liquides comparables en raison de sa polarité prononcée.
| Température, °C | Viscosité, mPa.s |
|---|---|
| 10 | 2,262 |
| 20 | 1,804 |
| 30 | 1,465 |
| 40 | 1,224 |
| 50 | 1,025 |
Les propriétés physiques de l’acide formique sont répertoriées dans le tableau ci-dessous :
| Propriété | Valeur |
|---|---|
| Numéro CAS | [64-18-6] |
| Formule | HCOOH |
| Poids moléculaire | 46,03 g/mol |
| Point de fusion | 8,3 °C |
| Point d'ébullition | 100,8 °C |
| pKa | 3,74 |
| Chaleur de fusion | 276 J/g |
| Chaleur de vaporisation (au point d'ébullition) | 483 J/g |
| Constante diélectrique |
Liquide (à 20 °C) : 57,9 Solide (à -10,1 °C) : 11,7 |
| Indice de réfraction | 1,37140 |
| Tension superficielle σ |
(à 20 °C) : 37,67×10-3 N/m (à 40 °C) : 35,48×10-3 N/m (à 60 °C) : 33,28×10-3 N/m (à 80 °C) : 31,09×10-3 N/m |
| Chaleur de formation |
Liquide (à 25 °C) : -425,0 kJ/mol Vapeur (à 25 °C, monomère) : -378,57 kJ/mol (à 25 °C, dimère) : -820,94 kJ/mol |
| Chaleur de combustion | Liquide (à 25 °C) : -254,8 kJ/mol |
| Entropie |
Liquide (à 25 °C) : 129,0 J K-1 mol-1 Vapeur (à 25 °C, monomère) : 248,88 J K-1 mol-1 (à 25 °C, dimère) : 332,67 J K-1 mol-1 |
| Chaleur de neutralisation | 56,9 kJ/mol |
2. Réactions de l’acide formique
Bien que l’acide formique soit relativement stable à température ambiante, il s’agit en fait d’un composé thermiquement instable qui présente deux voies principales de décomposition alternatives : les réactions de déshydratation et de déshydrogénation.
HCOOH → CO + H2O
HCOOH → CO2 + H2
La réaction de déshydratation, qui est prédominante dans la phase liquide, est favorisée en présence de catalyseurs oxydes ou d’acides forts, tandis que la réaction de déshydrogénation est favorisée par des catalyseurs métalliques.
L’acide formique devient particulièrement instable à des concentrations proches de 100 %, et cela doit être pris en compte lors du stockage d’acide formique hautement concentré. En général, la décomposition de l’acide formique est fonction à la fois de la concentration en acide et de la température.
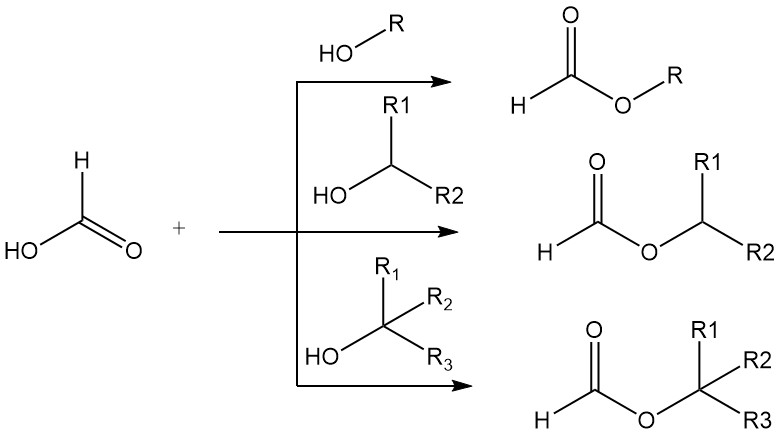
L’acide formique présente de nombreuses propriétés chimiques typiques des acides carboxyliques aliphatiques, par exemple l’estérification et l’amidation, mais, comme c’est souvent le cas pour le premier membre d’une série homologue, il existe des différences distinctives dans les propriétés de l’acide formique et de ses homologues supérieurs.
L’acide formique forme des esters avec les alcools primaires, secondaires et tertiaires. L’acidité élevée de l’acide formique rend inutile l’utilisation de catalyseurs acides minéraux dans les estérifications simples. Les alcools primaires et secondaires sont estérifiés dans l’acide formique pur 15 000 à 20 000 fois plus rapidement que dans l’acide acétique pur.
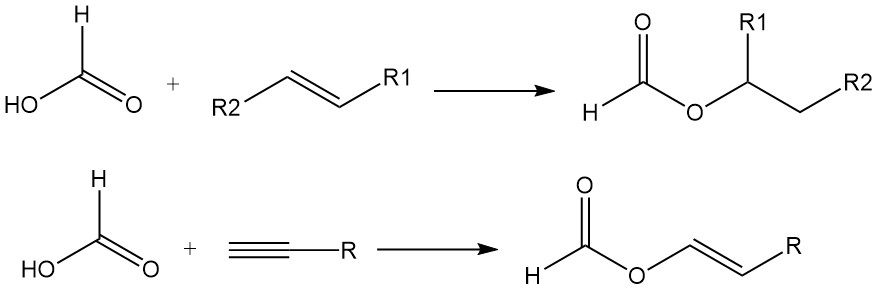
L’acide formique s’ajoute également aux doubles liaisons des oléfines pour former des esters. Les acétylènes réagissent avec l’acide formique en phase vapeur pour produire des formiates de vinyle.
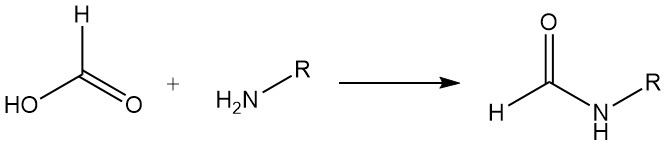
L’acide formique réagit avec la plupart des amines pour former des composés formylamino. Par exemple, dans la production de formamides, l’acide formique est utilisé pour réaliser la formylation par déshydratation. Avec certaines diamines, il se produit une formation d’imidazole. Les deux types de réaction ont une utilité synthétique.
L’acide formique et les bases organiques tertiaires forment des composés d’addition (rapports 3:1 et 2:1 de l’acide formique à la base). Les composés d’addition de l’acide formique et de la triméthylamine ou de la triéthylamine peuvent être utilisés comme agents réducteurs liquides dans de nombreuses réductions sélectives. La réduction du dioxyde de soufre en soufre est approximativement quantitative.
L’acide formique dissout le fer et le zinc et corrode la plupart des types d’acier. La réaction avec le fer produit du formiate de Fe(II) et de l’hydrogène gazeux. Parmi les métaux et alliages courants, l’aluminium, le cuivre et le nickel présentent une certaine résistance.
2 HCOOH + Fe → Fe(OOCH)2 + H2
L’acide formique est plus corrosif dans des solutions relativement diluées dans l’eau. Pour l’acier doux, le taux de corrosion le plus élevé est observé autour d’une concentration de solution de 20 %, à laquelle la conductivité de la solution est également la plus élevée. Certains inhibiteurs de corrosion peuvent offrir une très bonne protection.
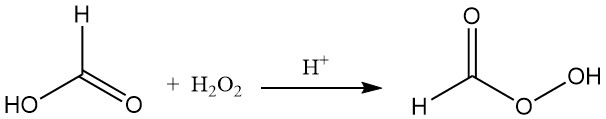
L’acide formique réagit avec le peroxyde d’hydrogène en présence d’un catalyseur acide pour former de l’acide performique instable (HCOOOH).
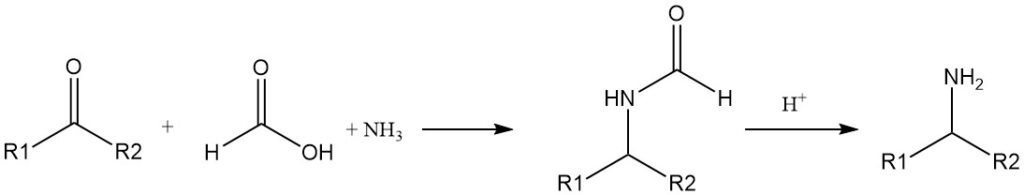
L’atome d’hydrogène formyle présente un caractère aldéhydique et l’acide formique réduit certains sels et oxydes en métaux. Il peut également être utilisé comme agent réducteur (donneur d’hydrure) dans de nombreuses réactions organiques, en remplacement de H2.
La réduction des imines (bases de Schiff) par l’acide formique est connue depuis longtemps. Les amines primaires peuvent être préparées à partir de cétones, d’ammoniac et d’acide formique (réaction de Leuckart).
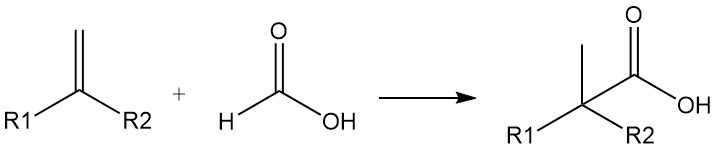
L’acide formique peut également être utilisé comme source de monoxyde de carbone. Des acides carboxyliques hautement ramifiés peuvent être préparés à partir d’oléfines et d’acide formique en présence d’acide sulfurique ou fluorhydrique (synthèse de l’acide carboxylique de Koch). La réaction se déroule par addition de CO.
3. Production d’acide formique
L’acide formique est aujourd’hui produit principalement par deux voies : l’hydrolyse du formiate de méthyle et la préparation d’acide formique libre à partir de sels de formiate.
Le procédé à base de formiate de méthyle est actuellement dominant. Environ 90 % de la capacité installée repose sur ce procédé. Les inconvénients économiques des méthodes pratiquées auparavant ont conduit au développement d’un procédé spécifiquement dédié à la production d’acide formique sans sous-produits indésirables.
Dans les années 1970, l’hydrolyse du formiate de méthyle en méthanol et en acide formique a été développée commercialement par diverses entreprises pour en faire une méthode économiquement viable.
Ce procédé implique la carbonylation du méthanol et l’hydrolyse ultérieure du formiate de méthyle produit. Le méthanol résultant de ce procédé est renvoyé à la première étape.
Des usines d’acide formique basées sur ce procédé ont été mises en service chez BASF (Allemagne) en 1981 et Kemira (Finlande) en 1982. Les plus récents producteurs à grande échelle utilisant cette voie sont les sociétés chinoises Feicheng Acid Chemicals et Luxi Chemical Group.
L’autre méthode de production actuelle implique la formation d’acide libre à partir de ses sels. On utilise principalement à cette fin le formiate de sodium et le formiate de calcium. L’acidolyse est normalement réalisée avec de l’acide sulfurique ou de l’acide phosphorique. Des sels de sulfate ou de phosphate sont produits comme sous-produits.
3.1. Production d’acide formique par hydrolyse du formiate de méthyle
La méthode la plus simple théoriquement possible pour produire de l’acide formique est la réaction du monoxyde de carbone avec de l’eau. En dessous de 150 °C, la réaction est très lente et bien que l’équilibre soit atteint rapidement à des températures plus élevées, la pression doit être augmentée pour obtenir des concentrations acceptables d’acide formique.
CO + H2O → HCOOH
Les obstacles thermodynamiques peuvent être contournés si le formiate de méthyle est formé comme intermédiaire.
La carbonylation en phase liquide du méthanol en formiate de méthyle en présence d’un catalyseur basique tel que le méthylate de sodium ou de potassium (NaOCH3 ou KOCH3) et l’hydrolyse ultérieure en acide formique sont pratiquées industriellement depuis le début des années 1980.
Le méthylate de potassium est plus soluble dans le formiate de méthyle que le méthylate de sodium et, par conséquent, a une vitesse de réaction plus élevée. Le méthanol libéré dans la deuxième étape est renvoyé dans la première étape.
CH3OH + CO → HCOOCH3
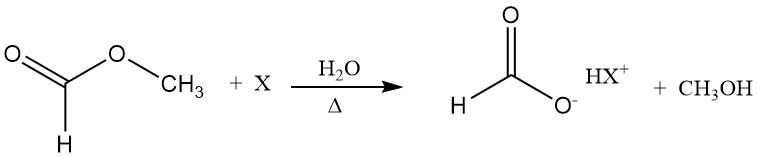
HCOOCH3 + H2O → HCOOH + CH3OH
Le procédé au formiate de méthyle est utilisé, par exemple, par Eastman Chemical Company, BASF, Kemira, Luxi Chemical Group et Feicheng Acid Chemicals.
Les conditions de réaction pour la première étape de carbonylation sont globalement similaires dans chacune d’elles, mais elles diffèrent dans leur approche de l’étape d’hydrolyse.
3.1.1. Carbonylation
Selon les données publiées, les conditions de réaction typiques semblent être 80 °C, une pression de 4,5 MPa et un catalyseur au méthylate de sodium à 2,5 % en poids. Dans ces conditions, la conversion du méthanol est d’environ 30 % et la conversion du monoxyde de carbone d’environ 95 %.
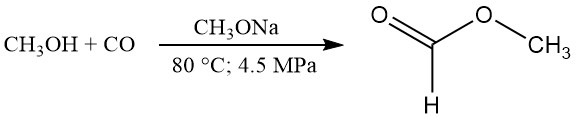
La conversion quasi quantitative du méthanol en formiate de méthyle peut être obtenue en recyclant le méthanol non converti. Le taux de carbonylation peut être augmenté en augmentant la température, la pression partielle de CO, la concentration du catalyseur ou l’interface entre les phases gazeuse et liquide.
En tant que réaction secondaire, le catalyseur produit des sels de formiate (Na et K). Les sels de formiate sont moins solubles dans le formiate de méthyle que dans le méthanol. Par conséquent, le risque d’incrustation et de blocage dû à la précipitation du catalyseur doit être géré.
Le monoxyde de carbone ne doit pas contenir une quantité significative de dioxyde de carbone ; sinon, le carbonate catalytiquement inactif précipite.
Le méthoxyde de métal alcalin non décomposé dans le formiate de méthyle doit être neutralisé pour éviter la réaction inverse, c’est-à-dire la décomposition du formiate de méthyle en méthanol et CO lorsqu’il est chauffé.
3.1.2. Hydrolyse
L’équilibre d’hydrolyse du formiate de méthyle est relativement défavorable mais dépend de la concentration en eau d’une manière qui favorise l’utilisation d’un excès stoechiométrique élevé d’eau, ce qui pose des problèmes pour trouver une méthode efficace sur le plan énergétique pour éliminer l’excès d’eau.
L’acide formique agit comme catalyseur d’hydrolyse (autocatalyse). Une façon de surmonter la position défavorable de l’équilibre d’hydrolyse est d’hydrolyser le formiate de méthyle en présence d’un additif, par exemple une amine tertiaire.
La base forme un adduit de type sel avec l’acide formique ; par conséquent, la concentration d’acide formique libre diminue et l’équilibre d’hydrolyse est déplacé dans le sens des produits. Dans une étape ultérieure, l’acide formique peut être distillé à partir de la base sans décomposition.
3.2. Production d’acide formique à partir de formiates
La réaction des sels de formiate avec des acides minéraux (généralement de l’acide sulfurique) est le plus ancien procédé commercial de production d’acide formique et il a toujours une importance industrielle. Perstorp est le plus grand producteur d’acide formique par acidolyse des sels de formiate.
Le formiate de sodium, le formiate de potassium et le formiate de calcium sont disponibles industriellement à partir de la production d’alcools polyhydriques.
L’acidolyse des sels de formiate est techniquement simple, mais la production inévitable de sels coproduits tels que le sulfate de sodium et de calcium constitue un inconvénient évident de cette voie.
2 HCOONa + H2SO4 → 2 HCOOH + Na2SO4
(HCOO)2Ca + H2SO4 → 2 HCOOH + CaSO4
Certains brevets chinois décrivent la préparation d’acide formique à partir de CO et d’hydroxydes de métaux alcalins ou alcalino-terreux, suivie d’une acidification avec de l’acide phosphorique. Le monoxyde de carbone peut provenir de la production de phosphore. Les sels de phosphate résultants sont utilisés comme engrais.
3.2.1. Formates comme sous-produits de polyol
Les sels de formate sont présents comme sous-produits dans la production de pentaérythritol, de triméthylolpropane et de 2,2-diméthyl-1,3-propanediol (néopentylglycol).
Par exemple, le pentaérythritol est produit par la réaction du formaldéhyde avec l’acétaldéhyde dans un milieu alcalin aqueux. L’aldéhyde intermédiaire réagit ensuite avec le formaldéhyde par la réaction de Cannizzaro pour donner du pentaérythritol et de l’acide formique.
L’acide formique formé réagit immédiatement avec l’alcali présent, donnant le sel de formate correspondant comme coproduit final.
3 HCHO + CH3CHO → (HOCH2)3CCHO
(HOCH2)3CCHO + HCHO + H2O → C(CH2OH)4 + HCOOH
HCOOH + NaOH → HCOONa + H2O
2 HCOOH + Ca(OH)2 → (HCOO)2Ca + 2 H2O
De plus, l’excès d’alcali dans le processus est neutralisé par l’acide formique. Le produit pentaérythritol est isolé par concentration progressive et cristallisation fractionnée.
3.2.2. Formates à partir de monoxyde de carbone
Les sels de formate peuvent être fabriqués par un procédé direct basé sur la réaction du CO avec une base telle que NaOH et KOH.
NaOH (aq) + CO → HCOONa (aq)
KOH (aq) + CO → HCOOK (aq)
3.3. Production d’acide formique à partir de dioxyde de carbone
L’hydrogénation du dioxyde de carbone dans l’alcool produit de l’acide formique dans un environnement presque exempt d’eau, ce qui constitue un avantage pour la récupération du produit. Les complexes de Ru solubles sont les catalyseurs préférés et un agent complexant est utilisé pour rendre la réaction thermodynamiquement favorable.
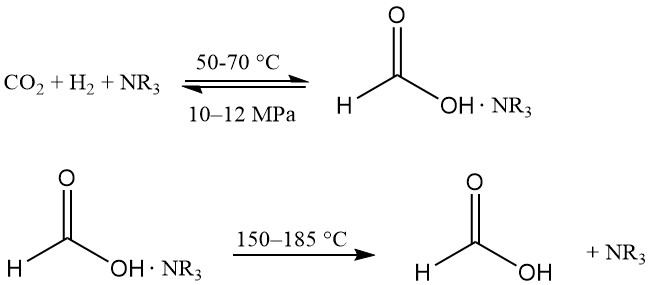
Cette technologie a été introduite pour la première fois par BP Chemicals dans les années 1980 et a été développée par BASF.
La réaction se déroule dans un mélange d’amine tertiaire (généralement de la n-trihexylamine) et d’alcool (par exemple du méthanol) à 50–70 °C et 10–12 MPa. On ajoute un peu d’eau pour faciliter la séparation des phases. Le complexe acide formique-amine est dissocié thermiquement à 150–185 °C.
Le procédé doit maintenir actif le catalyseur complexe de métal de transition coûteux, mais éviter qu’il ne soit présent sous forme active dans la distillation de l’acide formique, car il peut catalyser la décomposition de l’acide. Les résidus éventuels du catalyseur peuvent être inactivés de manière réversible avec du CO.
Plusieurs procédés électrochimiques de production d’acide formique ou de sel de formiate à partir de dioxyde de carbone sont en cours de développement. Le procédé d’électrolyse du CO2 consiste essentiellement à faire fonctionner une pile à combustible à l’envers. Dans un électrolyseur, le CO2 est réduit à la cathode, tandis que la réaction d’évolution de l’oxygène a lieu à l’anode.
Ces dernières années, de grandes améliorations dans les systèmes de catalyseurs et les électrodes ont permis d’obtenir des rendements, des rendements faradiques et des rendements de carburant bien plus élevés.
3.4. Production d’acide formique à partir de la biomasse
Presque n’importe quelle biomasse végétale peut être oxydée en acide formique, CO2 et eau avec une sélectivité élevée en acide formique en utilisant des polyoxométallates comme catalyseurs de distribution d’oxygène.
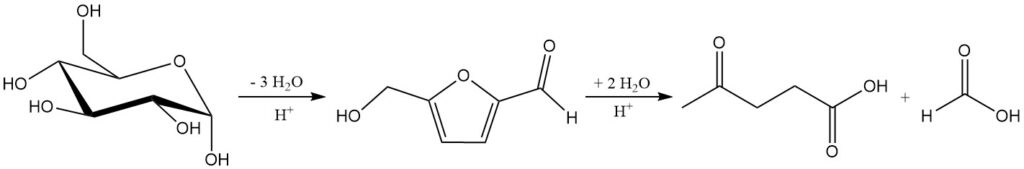
L’hydrolyse acide minérale de la cellulose et de l’hémicellulose à environ 200 °C produit un mélange d’acide lévulinique, d’acide formique et de furfural. La réaction totale des sucres C6 en acide lévulinique et en acide formique est présentée dans le schéma 1.
3.5. Récupération de l’acide formique
3.5.1. Distillation azéotropique
Les mélanges acide formique-eau ne peuvent pas être concentrés au-delà de la composition azéotropique par simple distillation. La concentration d’acide formique dans le mélange azéotropique augmente si la distillation est effectuée sous pression, mais le point d’ébullition plus élevé à haute pression augmente également le taux de décomposition de l’acide formique.
Une combinaison de distillation sous pression suivie d’une distillation sous vide peut produire pratiquement toutes les concentrations souhaitées.
3.5.2. Extraction
Plusieurs technologies ont été développées dans lesquelles l’extraction réactive est utilisée pour transférer l’acide formique vers une phase organique séparée ou l’acide formique est lié à un agent complexant faible en phase aqueuse. Dans les deux cas, l’azéotrope peut être évité.
Lorsque la séparation de phase est impliquée, il est possible de réduire la quantité totale d’eau qui doit être évaporée. Généralement, on utilise des amides secondaires ou des amines tertiaires.
Dans la distillation extractive, l’acide formique est extrait dans une colonne de distillation au moyen d’un agent d’extraction basique introduit à contre-courant et introduit dans le fond de la colonne. Si ce mélange est chauffé dans une colonne en aval, l’acide formique est libéré de l’adduit salin et distillé.
4. Utilisations de l’acide formique
En raison de son acidité, de sa nature aldéhydique et de ses propriétés réductrices, l’acide formique est utilisé dans de nombreux domaines. Contrairement aux acides minéraux, l’acide formique s’évapore sans laisser de résidus. En Europe, la majeure partie de l’acide formique est utilisée dans l’industrie de l’alimentation animale et comme auxiliaire d’ensilage.
4.1. Utilisations de l’acide formique dans la conservation de la biomasse
4.1.1. Ensilage
Le terme ensilage désigne traditionnellement l’ensilage de cultures fourragères (principalement des graminées) pour nourrir les bovins dans les fermes. La consommation dépend du climat ; l’ensilage à base d’acide formique est particulièrement adapté aux conditions humides. L’Europe du Nord est la principale zone de consommation.
L’ensilage est basé sur la fermentation dans des conditions anaérobies, où l’acide lactique produit par les bactéries lactiques préserve l’ensilage. L’acide lactique abaisse le pH et empêche ainsi la croissance microbienne indésirable.
L’ajout d’acide formique entraîne une baisse initiale rapide du pH, ce qui favorise la croissance des bactéries lactiques et supprime la croissance des bactéries qui produisent des composés indésirables tels que l’acide butyrique. Lorsque la baisse du pH est renforcée par l’acide formique, la fermentation spontanée est limitée.
Les avantages comprennent davantage de sucres résiduels et de protéines. On sait que la restriction de la fermentation a un effet positif sur l’ingestion volontaire dans l’alimentation des vaches laitières et améliore ainsi la production de lait.
Les cultures fourragères telles que l’herbe, le maïs, le trèfle et la luzerne sont coupées, hachées, puis fermentées dans des silos ou des balles recouvertes d’un film hermétique. L’acide formique est parfaitement adapté à l’ensilage de matières difficiles à ensiler, en particulier les plantes fourragères humides ou à faible teneur en sucre, qui peuvent également avoir une capacité tampon élevée.
L’acide formique est également utilisé pour limiter la fermentation lors de l’ensilage de grains à haute teneur en humidité.
Les sous-produits de l’industrie alimentaire et des boissons, tels que le moût usé des brasseries, peuvent être conservés avec des solutions d’acide formique pour fournir des aliments pour animaux à longue durée de conservation.
L’acide formique est utilisé dans différentes formulations, parfois dans des mélanges avec d’autres acides organiques à chaîne courte tels que l’acide propionique, et est souvent tamponné avec un sel de formiate pour la sécurité de manipulation et la corrosion réduite.
4.1.2. Biomasse animale
La biomasse animale peut également être préservée avec de l’acide formique. La plus grande utilisation est dans la transformation des sous-produits de l’industrie du poisson pour produire de l’ensilage de poisson. Un traitement approprié des abats de poisson est souvent exigé par les lois environnementales, et la production d’ensilage de poisson peut être une solution économiquement viable.
L’ensilage de poisson est un produit liquide riche en protéines fabriqué en abaissant le pH des parties de poisson broyées avec un conservateur acide. Dans ces conditions, les enzymes des internes du poisson produisent le produit final à longue durée de conservation en quelques jours.
L’acide formique permet également une séparation efficace de l’huile de poisson pendant le processus d’ensilage. L’acide agit également comme un auxiliaire de traitement en réduisant la formation de gaz microbien (« ébullition »). L’ensilage de poisson peut être utilisé comme aliment pour poissons et porcs ou comme matière première pour la farine et les huiles de poisson.
L’acide formique est l’acide préféré dans cette application, généralement associé à un antioxydant approprié. Cette méthode est couramment utilisée dans les principaux pays producteurs de saumon, comme la Norvège, et devrait gagner en importance à mesure que l’aquaculture s’intensifie, notamment en Asie de l’Est et du Sud-Est.
Les déchets d’abattoir peuvent être conservés de la même manière que les abats de poisson avec des acides, généralement des mélanges d’acide formique et d’acide lactique. Les produits conviennent aux animaux à fourrure et, dans certaines limites, aux aliments pour animaux de compagnie.
4.2. Utilisations de l’acide formique dans l’industrie du cuir
L’industrie du tannage est l’un des plus gros consommateurs d’acide formique à l’échelle mondiale. Comme l’industrie du tannage s’est déplacée vers des pays à moindre coût, les chiffres de croissance en Asie ont été très élevés, compensant le déclin en Europe et en Amérique du Nord.
La Chine est le plus grand producteur de cuir, représentant environ 30 % de la production mondiale.
Le prétraitement des peaux les laisse dans un état légèrement alcalin, mais le tannage nécessite des conditions acides. Par conséquent, les peaux sont traitées avec de l’acide (généralement de l’acide sulfurique et de l’acide formique) avant le tannage dans un processus appelé décapage.
Sans ce conditionnement, les agents de tannage se fixeraient rapidement à la surface de la peau, tandis que sa couche interne resterait brute.
L’acide sulfurique réduit le pH de la liqueur, tandis que l’acide formique est capable de pénétrer les fibres de collagène rapidement et de manière homogène. Il garantit que l’agent de tannage (généralement du sulfate de chrome basique) pénètre dans toute l’épaisseur de la peau.
Dans la teinture du cuir, l’acide formique est utilisé comme agent de nivellement pour aider à déplacer le colorant d’une zone du cuir à une autre, ce qui permet une distribution plus uniforme et plus lisse du colorant.
4.3. Utilisations de l’acide formique dans les textiles
Dans l’industrie textile, l’acide formique est utilisé comme agent régulateur du pH dans la teinture de la laine, du nylon et d’autres fibres naturelles et synthétiques avec des colorants acides et chromés. De plus, l’acide formique est utilisé pour neutraliser les solutions alcalines et faciliter le rinçage pendant le lavage.
L’amélioration du niveau de vie et l’augmentation de la production de fibres, en particulier pour les marchés d’exportation, devraient accroître la demande d’acide formique dans la teinture et la finition des textiles en Asie.
4.4. Utilisations de l’acide formique comme additif alimentaire
Les acides et sels organiques ont une longue histoire dans l’industrie de l’alimentation animale, qui les utilise couramment comme conservateurs et pour l’acidification des régimes alimentaires des porcelets. Depuis 2006, lorsque l’UE a interdit les antibiotiques promoteurs de croissance (AGP), l’utilisation d’acides organiques dans l’alimentation animale a augmenté.
L’acide formique a un fort effet acidifiant mais aussi des effets antimicrobiens, qui sont utilisés pour protéger les aliments et l’eau potable contre la contamination bactérienne. L’acide formique est très efficace contre Salmonella, Escherichia coli et Campylobacter à pH 4,0.
Il agit positivement sur la flore intestinale des animaux et peut améliorer à la fois la digestibilité apparente de l’énergie et des protéines, l’absorption et la rétention de certains minéraux. Il semble améliorer les performances de croissance des porcelets sevrés et des porcs d’engraissement à des doses plus faibles que les autres acides et sels organiques.
Dans l’industrie avicole, l’acide formique est utilisé depuis longtemps pour empêcher la croissance d’agents pathogènes dans les aliments et les matières premières. Les mélanges d’acide formique avec de l’acide propionique, de l’acide lactique ou des acides gras à chaîne moyenne ont des effets antimicrobiens plus larges que l’acide formique seul.
4.5. Utilisations de l’acide formique dans les produits pharmaceutiques et les additifs alimentaires
Les produits pharmaceutiques et les produits chimiques alimentaires sont considérés comme le plus grand secteur d’utilisation de l’acide formique en Asie (principalement en Chine).
L’acide formique est utilisé comme intermédiaire synthétique pour divers produits pharmaceutiques et produits chimiques alimentaires, notamment l’insuline synthétique (purification de l’insuline recombinante), la caféine, l’aspartame et la vitamine B1. Il est également largement utilisé pour l’ajustement du pH lors de la fabrication de divers produits chimiques.
Les autres applications dans les aliments comprennent la décontamination de Salmonella et son utilisation comme conservateur (E236, autorisé aux États-Unis mais pas dans l’UE, en Australie et en Nouvelle-Zélande) et comme agent aromatisant.
L’acide formique est utilisé dans la conservation des aliments, notamment pour la fumigation des fruits tels que les pommes et les cerises, afin de réduire la pourriture après la récolte. L’acide formique est particulièrement efficace pour détruire les spores fongiques sur les surfaces et les récipients dans lesquels les fruits sont stockés.
Dans certaines applications de conservation des aliments, l’acide formique est mélangé à de l’acide lactique et/ou propionique. Le mélange est peu corrosif, mais en raison de son faible pH, il aide à détruire les micro-organismes nocifs et empêche leur propagation, prolongeant ainsi la durée de conservation du produit.
4.6. Autres utilisations
4.6.1. Coagulation du caoutchouc
L’acide formique est le choix privilégié pour la coagulation du latex, qui est une suspension de particules microscopiques de caoutchouc naturel (polyisoprène) dans un milieu aqueux. Les surfaces des particules de latex sont chargées, ce qui crée une répulsion entre elles, empêchant la coagulation.
Lors du processus de coagulation, l’acide formique neutralise ces charges, éliminant la répulsion. Le processus permet d’obtenir un produit de caoutchouc naturel de qualité constante. L’utilisation d’acides plus forts entraîne une chute trop rapide et inhomogène du pH. En conséquence, le latex coagule de manière inégale, ce qui peut affecter ses propriétés mécaniques.
Les acides plus faibles, tels que l’acide acétique, sont moins efficaces que l’acide formique et entraînent une consommation d’acide beaucoup plus élevée.
4.6.2. Désulfuration des gaz
L’acide formique est utilisé comme catalyseur de désulfuration dans la désulfuration des gaz de combustion des centrales électriques au charbon. Le soufre, dont la teneur dans le charbon peut atteindre 5 %, est libéré sous forme de dioxyde de soufre lors du processus de cuisson.
La capture du dioxyde de soufre par le passage des gaz de combustion à travers une boue calcaire aqueuse produit du gypse (sulfate de calcium). L’ajout d’acide formique au cycle de désulfuration augmente l’efficacité de la séparation du soufre.
4.6.3. Acidifiants de puits
L’acide formique est utilisé dans la stimulation des puits à haute température dans les champs de pétrole et de gaz lorsque les systèmes conventionnels d’acide chlorhydrique (HCl) ne peuvent pas être inhibés de manière adéquate.
L’acidification des puits est obtenue en pompant de l’acide dans le puits pour dissoudre le calcaire, la dolomite et le ciment de calcite entre les grains de sédiments des roches du réservoir.
L’acide formique présente l’avantage d’une bonne inhibition contre la corrosion des tuyaux à des températures pouvant atteindre 200 °C (éventuellement causée par une couche protectrice de produits de décomposition).
Le mélange HCl-acide formique peut offrir d’autres avantages. L’acide formique ne se dissocie pas en présence de HCl, il n’y a donc pas de réaction avec le carbonate jusqu’à ce que le HCl soit pratiquement épuisé. Les mélanges HCl/formique peuvent ainsi atteindre une plus grande pénétration.
4.6.4. L’acide formique comme source d’hydrogène et de monoxyde de carbone
Dans des conditions d’hydrolyse, l’ion formiate peut former un ion bicarbonate et de l’hydrogène.
HCO2– + H2O → HCO3– + H2
Le palladium et le charbon de bois se sont révélés tous deux actifs comme catalyseurs.
La réaction de déshydrogénation est favorisée par des catalyseurs métalliques.
HCOOH → CO2 + H2
La production d’hydrogène à base d’acide formique ou de formiate de potassium dans les piles à combustible suscite un intérêt croissant. Les avantages d’une utilisation dans des appareils portables sont une autonomie prolongée et une recharge instantanée sans dépendance à la prise électrique.
La décomposition de l’acide formique en présence d’acides forts comme l’acide sulfurique est une source propre de CO pour la chimie à base de monoxyde de carbone.
L’acide formique ou ses sels peuvent être utilisés comme source d’hydrogène dans des réactions chimiques sans formation de H2 comme intermédiaire (mécanisme de réaction de Leuckart). La réaction, connue sous le nom d’hydrogénation par transfert, est sélective et est catalysée par de nombreux métaux, même la poudre de zinc.
Lorsque des complexes catalyseurs chiraux sont utilisés, l’acide formique peut servir de source d’hydrogène dans l’hydrogénation asymétrique, une étape de réaction courante dans la synthèse de nombreux produits chimiques fins et pharmaceutiques.
4.6.5. Agents nettoyants
L’acide formique est utilisé comme ingrédient actif dans les produits de nettoyage commerciaux tels que les détartrants, les antirouilles, les nettoyants et dégraissants multi-usages et les produits de lessive institutionnels. Lors du détartrage, le sel de calcium se forme lorsque le carbonate de calcium est dissous par un acide.
Plus ce sel est facilement soluble, moins le risque de dépôts de sel réduisant l’efficacité de l’acide est élevé. Dans les nettoyants pour salle de bains, il est censé combiner les propriétés d’un agent détartrant efficace avec celles d’un biocide biodégradable.
4.6.6. Utilisation comme solvants
L’acide formique peut être utilisé pour dissoudre les polyamides (par exemple, le nylon 66 et le nylon 46) ou la soie pour préparer des fibres et des membranes. C’est également un composant utile dans les solutions de nettoyage des semi-conducteurs.
5. Toxicologie de l’acide formique
L’acide formique présente une gamme d’effets toxiques en fonction de la voie d’exposition (inhalation, ingestion ou contact cutané) et de la concentration.
Toxicité aiguë :
- Peau et muqueuses : l’acide formique est corrosif et peut provoquer une nécrose (mort des tissus) au contact de la peau et une irritation/corrosion des muqueuses au point d’entrée (yeux, bouche, voies nasales).
- Ingestion : le métabolisme du méthanol peut générer des niveaux toxiques d’acide formique, entraînant une acidose métabolique. L’ingestion orale de solutions d’acide formique peut provoquer une irritation et une corrosion graves du tractus gastro-intestinal.
- Inhalation : l’inhalation de vapeurs d’acide formique irrite le système respiratoire, la gravité augmentant avec la concentration. Des concentrations élevées peuvent être mortelles.
- Absorption cutanée : l’acide formique peut être facilement absorbé par la peau, ce qui entraîne des effets systémiques.
La DL50 après administration orale est de 730 mg/kg chez le rat.
Chez le rat, la CL50 est de 7,85 mg/L après 4 heures d’inhalation de la vapeur. Les principaux symptômes de l’ingestion par inhalation sont l’irritation des yeux, l’irritation et la corrosion des muqueuses nasales et l’opacité cornéenne.
Chez le lapin, l’administration intraveineuse d’acide formique tamponné dans la plage de 0,46 à 1,25 g par kilogramme de poids corporel entraîne une dépression du SNC ; des doses plus élevées provoquent des convulsions.
Des doses administrées par voie sous-cutanée de 0,8 g/kg chez le chien et de plus de 0,4 g/kg chez le chat entraînent un essoufflement, tandis qu’une dose de 0,4 g/kg entraîne une somnolence chez le chat.
Chez le chien, des doses létales administrées par voie intraveineuse provoquent des convulsions toniques et cloniques.
L’exposition chronique à l’acide formique à de faibles concentrations dans les études animales n’a pas montré d’effets significatifs sur le poids corporel ou le poids des organes. Cependant, il peut diminuer les niveaux de glutathion dans le foie et les reins.
L’acide formique n’a pas montré de potentiel génotoxique dans divers essais in vitro et in vivo. Cependant, certaines études suggèrent un effet de confusion du pH bas à des concentrations élevées, nécessitant des recherches plus approfondies.
Référence
- Acide formique, Encyclopédie de chimie industrielle d’Ullmann. – https://onlinelibrary.wiley.com/doi/full/10.1002/14356007.a12_013.pub3

