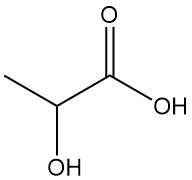
El ácido láctico, también conocido como ácido 2-hidroxipropiónico, es un ácido orgánico natural con la fórmula molecular CH3CH(OH)COOH. El ácido láctico puro es un sólido cristalino blanco con un punto de fusión bajo que se encuentra en muchos sistemas biológicos, incluido el cuerpo humano.
Desempeña un papel importante en la respiración celular.
El ácido láctico fue aislado por primera vez en 1780 por el químico sueco Carl Wilhelm Scheele a partir de leche agria. Inicialmente, apareció como un jarabe impuro de color marrón. Posteriormente, el químico francés Michel Braconnot demostró que el ácido láctico se podía producir mediante procesos de fermentación.
El año 1881 marcó el establecimiento de la producción de ácido láctico a escala industrial en Estados Unidos.
Tabla de contenido
1. Propiedades físicas del ácido láctico
El ácido láctico [50-21-5] es el ácido hidroxicarboxílico más simple que contiene un átomo de carbono asimétrico con una masa molar de 90,08 g/mol. Existe en tres formas:
- Mezcla racémica (DL): una forma no ópticamente activa que contiene cantidades iguales de los dos isómeros ópticamente activos.
- Ácido L-(+)-láctico (número CAS: 79-33-4): el isómero L ópticamente activo.
- Ácido D-(-)-láctico (número CAS: 10326-41-7): el isómero D ópticamente activo.
El ácido láctico racémico anhidro puro es un sólido cristalino blanco con un punto de fusión bajo, aunque el valor exacto es difícil de determinar debido a los desafíos para obtener una forma completamente anhidra. Los valores informados en la literatura oscilan entre 18°C y 33°C. El ácido láctico sufre esterificación interna para formar ácido lactoiláctico.
El aislamiento de isómeros ópticos individuales se puede lograr mediante cristalización fraccionada de ácido láctico recién destilado. El punto de fusión de los isómeros ópticos puros es de alrededor de 52,7 a 52,8 °C. El ácido láctico anhidro tiene un punto de ebullición de aproximadamente 125 a 140 °C a 27 kPa.
Debido a su propiedad higroscópica, el ácido láctico normalmente se obtiene como una solución acuosa concentrada (hasta 90% en peso) que es incolora, prácticamente inodora y contiene cantidades significativas de ácido lactoiláctico y otros oligómeros de ácido láctico.
Esta solución es completamente miscible con agua, etanol, éter dietílico y otros disolventes orgánicos miscibles con agua. Es prácticamente insoluble en benceno y cloroformo.
Históricamente, el ácido láctico sintético ha sido una mezcla racémica. Sin embargo, el ácido láctico producido por fermentación es ópticamente activo y el isómero específico producido depende del tipo de bacteria involucrada.
El ácido láctico tiene una constante de disociación (K) de 1,38 x 10-4 a 25°C, lo que corresponde a un pKa de 3,86. Una solución acuosa de ácido láctico al 10% en peso tiene un pH de aproximadamente 1,75.
En la Tabla 1 se proporcionan datos de densidad, viscosidad, índice de refracción y conductividad para soluciones acuosas de ácido láctico de diferentes concentraciones.
| Concentración, % en peso | Densidad, g/mL | Viscosidad, mPa·s | Índice de refracción | Conductividad, mS/cm |
|---|---|---|---|---|
| 6.29 | 1,0115 | 1.042 | 1,3390 | 3.670 |
| 25.02 | 1,0570 | 1,725 | 1,3586 | 3.823 |
| 54,94 | 1.1302 | 4,68 | 1.3909 | 1.530 |
| 88,60 | 1.2006 | 36,9 | 1,4244 | 0,0567 |
2. Reacciones químicas del ácido láctico
2.1. Esterificación interna y polimerización
El ácido láctico, que posee grupos funcionales hidroxilo y ácido carboxílico, se somete a esterificación interna para formar ácido lactoiláctico (ácido 2-(2-hidroxipropanoiloxi)propanoico) (1) o lactida (2), un éster cíclico, mediante esterificación bimolecular.
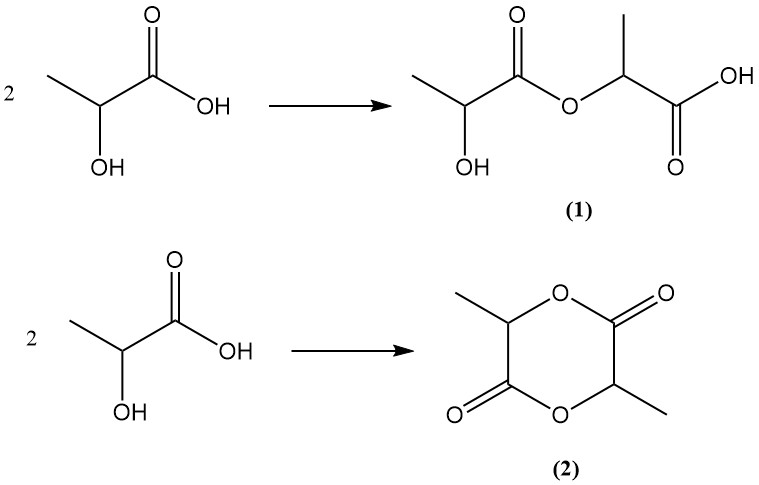
La lactida existe en tres formas estereoisoméricas: L,L-lactida, D,D-lactida y D,L-lactida, dependiendo de la quiralidad de las unidades de ácido láctico constituyentes.
Los ácidos polilácticos se pueden producir mediante una mayor condensación del ácido lactoiláctico. Se trata de poliésteres lineales con diferentes longitudes de cadena. , se pueden obtener estructuras químicas idénticas mediante la polimerización con apertura de anillo de lactida, en cuyo caso normalmente se utiliza el término «polilactida».
Las soluciones acuosas de ácido láctico disponibles comercialmente contienen proporciones variables de ácido lactoiláctico y ácidos polilácticos, influenciadas por la concentración y el tiempo de almacenamiento.
Las soluciones diluidas (alrededor del 6,5 % en peso) pueden contener aproximadamente un 0,2 % en peso de ácido lactoiláctico, mientras que las soluciones concentradas (88 % en peso) pueden tener menos del 60 % de ácido láctico libre, e incluso las soluciones al 100 % de ácido láctico pueden contener solo el 32 % del ácido lactoiláctico libre. forma monomérica.
2.2. Esterificación con alcoholes
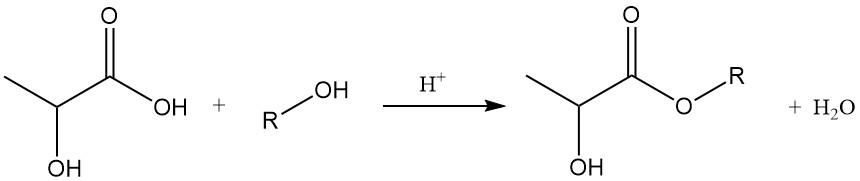
Los lactatos de alcoholes inferiores se pueden sintetizar fácilmente mediante reacción directa con el alcohol correspondiente. El rendimiento de la reacción se puede mejorar eliminando el agua generada mediante destilación azeotrópica. Alternativamente, los ésteres de lactato se pueden producir mediante reacciones mínimas de generación de agua entre alcoholes y ácido poliláctico.
2.3. Otras reacciones
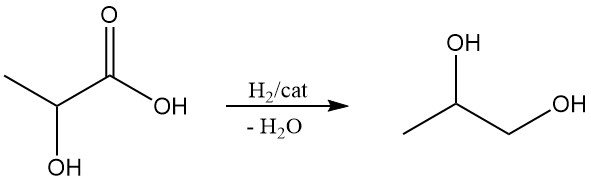
El ácido láctico tiene el potencial de ser un material de partida rentable para el propilenglicol (1,2-propanodiol) y el ácido acrílico, dos químicos importantes. El propilenglicol se puede obtener mediante la reducción del ácido láctico y la deshidratación del ácido láctico produce ácido acrílico.
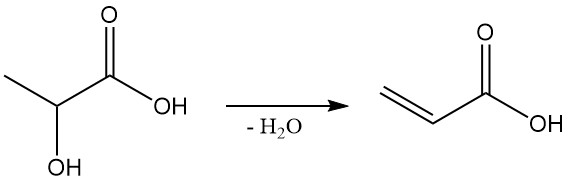
Además, el ácido láctico juega un papel importante en los procesos biológicos.
3. Producción de ácido láctico
El ácido láctico se produce comercialmente mediante fermentación o métodos sintéticos. Sin embargo, desde aproximadamente 1995, el proceso de fermentación ha dominado la nueva capacidad de producción. Este cambio está impulsado por la capacidad de la fermentación para generar ácido láctico con alta pureza quiral, un factor crítico para aplicaciones en las industrias de alimentos y polímeros.
3.1. Producción de ácido láctico por fermentación
La producción de ácido láctico por fermentación utiliza carbohidratos, nutrientes y microorganismos específicos.
Los carbohidratos utilizados se componen principalmente de hexosas (glucosa, fructosa) o precursores de hexosas fácilmente degradables (jarabes de maíz, melaza, jugo de remolacha azucarera, suero). También se emplean almidones de arroz, trigo, maíz y patata.
A medida que avanza la tecnología de hidrólisis de materiales lignocelulósicos, estas materias primas, junto con los azúcares pentosas (xilosa, arabinosa), pueden convertirse en una fuente de carbohidratos de bajo costo.
Varios microorganismos son capaces de producir ácido láctico en grandes volúmenes, incluidas las cepas de Lactobacillus, Bacillus y Rhizopus. Los hongos Rhizopus ofrecen la ventaja de no requerir fuentes complejas de nitrógeno, pero normalmente producen menos ácido láctico en comparación con las cepas bacterianas.
Las cepas bacterianas generalmente realizan fermentación anaeróbica, mientras que Rhizopus utiliza procesos aeróbicos. Se prefieren las cepas bacterianas homofermentativas que minimizan la formación de subproductos.
Los microorganismos utilizados en la fermentación requieren péptidos solubles, aminoácidos, fosfatos, sales de amonio y vitaminas. Las fuentes complejas de nitrógeno como el extracto de levadura, el licor de maíz macerado o las peptonas (soja, carne) se utilizan a menudo en pequeñas cantidades para una purificación más sencilla del ácido láctico.
El pH del caldo debe mantenerse entre 5,0 y 6,5 durante la fermentación. Se utilizan agentes neutralizantes como hidróxido de calcio, carbonato o hidróxido de sodio/amonio para contrarrestar la producción de ácido láctico, lo que da como resultado la formación de sales de lactato de calcio, lactato de amonio o lactato de sodio dentro del caldo.
La producción a escala industrial requiere grandes cantidades de inóculo bacteriano cultivado en un tren de semillas exclusivo. Se requieren medidas estrictas para minimizar la contaminación en el tren de semillas y los recipientes de producción para garantizar altos rendimientos y pureza quiral.

Los rendimientos de ácido láctico suelen oscilar entre el 85% y el 95% según los azúcares fermentables. Los subproductos de fermentación comunes, como el ácido fórmico y el ácido acético, suelen estar presentes en concentraciones inferiores al 0,5% en peso.
Los avances recientes en la tecnología de fermentación involucran cepas de levadura genéticamente modificadas para la producción de ácido láctico en condiciones neutras o de pH bajo. Estos microorganismos diseñados ofrecen beneficios como requisitos de medios definidos y la capacidad de producir ácido láctico directamente (no sales de lactato) dentro del caldo.
La fermentación con pH bajo elimina potencialmente los costos asociados con agentes neutralizantes, agentes acidificantes y eliminación de sales subproductos.
3.2. Purificación de ácido láctico
Después de la fermentación, el caldo que contiene ácido láctico requiere purificación para usos finales específicos. El grado de purificación varía según la aplicación. Las aplicaciones alimentarias pueden requerir una purificación mínima, mientras que aplicaciones como la producción de monómeros de polilactida requieren una purificación extensa.
La elección de nutrientes y microorganismos durante la fermentación afecta significativamente los pasos de purificación posteriores. Las fuentes complejas de nitrógeno y los subproductos de los microorganismos contribuyen a la formación de impurezas que deben eliminarse. Las operaciones unitarias se utilizan para eliminar proteínas residuales, aminoácidos, azúcares, cationes, aniones y otros ácidos orgánicos.
Eliminar los microorganismos del caldo es fundamental en todos los casos. La técnica de eliminación depende del microorganismo específico utilizado en la fermentación.
- Las cepas bacterianas se pueden eliminar mediante floculación en condiciones alcalinas o ultrafiltración.
- Para Rhizopus, el control cuidadoso de la morfología celular dentro del fermentador es crucial para una separación eficiente en los filtros.
Las sales de lactato formadas durante la fermentación deben convertirse en ácido láctico. Un método común a gran escala consiste en agregar ácido sulfúrico al lactato de calcio. Este método genera un subproducto de sulfato de calcio (yeso) de bajo valor con solubilidad en agua limitada.
Una considerable investigación se ha centrado en procesos alternativos para evitar la formación de sales como subproductos, como la electrodiálisis con división de agua y la extracción líquido-líquido asistida por dióxido de carbono.
Para determinadas aplicaciones alimentarias, el caldo pasa a través de carbón activado y resinas de intercambio iónico para su purificación. Tras este paso, el caldo se concentra según las especificaciones del cliente.
Las aplicaciones farmacéuticas, de polímeros y otras requieren una mayor purificación del ácido láctico. Se emplean varios procesos a gran escala, siendo un método de interés la extracción líquido-líquido utilizando aminas terciarias de cadena larga en la fase orgánica.
Aquí, el ácido láctico se extrae selectivamente en la fase orgánica a baja temperatura y luego se vuelve a extraer en agua a alta temperatura para producir una corriente de ácido láctico de alta calidad. La complejación ácido-amina contribuye a una alta selectividad por el ácido láctico sobre los azúcares y proteínas residuales.
La destilación del ácido láctico se puede lograr en condiciones operativas específicas que minimicen la formación de oligómeros de ácido láctico, lo que puede limitar el rendimiento. La destilación de un éster de lactato, como el lactato de etilo, también puede producir ácido láctico de alta calidad, pero introduce la complejidad adicional de las reacciones de esterificación e hidrólisis.
Importantes investigaciones han explorado el uso de membranas para la purificación del ácido láctico, incluida la electrodiálisis y el intercambio aniónico. Estas tecnologías pueden desempeñar un papel en futuras instalaciones de producción de ácido láctico.
3.3. Síntesis de ácido láctico
Si bien la fermentación ha dominado la producción de ácido láctico desde mediados de los años 1990, los procesos sintéticos también existen desde los años 1960. El método industrial actual para fabricar ácido láctico implica la reacción de acetaldehído con cianuro de hidrógeno, seguida de la hidrólisis del lactonitrilo resultante.
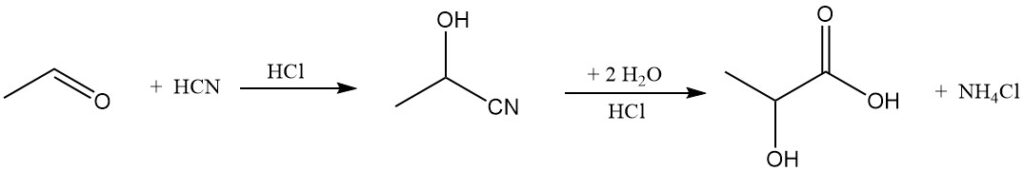
Musashino es actualmente el último gran productor de ácido láctico sintético. Sin embargo, el posible desarrollo de una ruta sintética rentable que utilice un catalizador enantioselectivo para generar ácido láctico quiralmente puro podría conducir a una sustitución parcial de los métodos de fermentación en el futuro.
4. Usos del ácido láctico
El ácido láctico y sus derivados (sales y ésteres) se utilizan en tres sectores principales: alimentación, polímeros e industria.
4.1. Usos en alimentos
Tradicionalmente, la industria alimentaria ha sido la mayor consumidora de ácido láctico y sales de lactato. El ácido láctico se utiliza principalmente como acidulante y conservante. Su suave sabor ácido complementa varios alimentos sin dominar otros sabores.
Además, al ser una sustancia natural, el ácido láctico no introduce elementos extraños en los alimentos. Sus sales altamente solubles los convierten en sustitutos parciales adecuados de los ácidos en los sistemas tampón.
El ácido láctico y sus sales se utilizan ampliamente en diversos productos alimenticios, incluidas bebidas, dulces, carnes y salsas. Se puede agregar lactato de calcio a los alimentos para elaborar productos enriquecidos con calcio. El esteroil lactato y sus sales de sodio y calcio se utilizan en el pan.
4.2. Usos en polímeros
El ácido láctico es un monómero utilizado para la producción de ácido poliláctico o polilactida. NatureWorks LLC es un importante productor de ácido poliláctico, que se sintetiza mediante polimerización de lactida con apertura de anillo. La propia lactida se forma por la condensación de dos moléculas de ácido láctico.
Los usos del ácido poliláctico incluyen recipientes para alimentos y bebidas, películas y recipientes rígidos para embalaje y artículos de servicio como tazas, platos y utensilios. El ácido poliláctico se puede hilar en fibras para usar en ropa, relleno de fibra (almohadas, edredones), alfombras y aplicaciones no tejidas, como toallitas.
4.3. Usos industriales
El ácido láctico y sus derivados se utilizan en la industria metalúrgica, cosmética, textil y del cuero. Los ésteres de lactato se utilizan en la producción de pinturas y tintas, productos electrónicos y soluciones de limpieza de metales. El ácido láctico también se utiliza en la agricultura como alimento para animales.
5. Toxicología del ácido láctico
El ácido láctico es un ácido comestible no tóxico de origen natural que se utiliza como acidulante en la industria alimentaria. Sin embargo, debido a su naturaleza ácida, puede causar irritación al entrar en contacto con los ojos o la piel lesionada. En tales casos, se recomienda enjuagar inmediatamente con agua.
La toxicidad oral no es una preocupación importante en condiciones normales de uso. Sin embargo, la ingestión de grandes cantidades puede ser perjudicial, con una DL50 (dosis letal del 50%) de 3730 mg/kg en ratas. Como precaución general de seguridad, evite el contacto con los ojos y la piel y no ingiera grandes cantidades.
Referencias
- Lactic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a15_097.pub3
- Technological and economic potential of poly(lactic acid) and lactic acid derivatives


