
1,3-Propandiol ist eine transparente, farblose und geruchlose Flüssigkeit, die mit Wasser, Alkoholen, Ethern und Formamid mischbar ist. Es ist in Benzol und Chloroform nur begrenzt löslich.
Diese Verbindung dient als wichtiges Monomer bei der Herstellung von Polyestern, Polyurethanen und Polyethern.
In den letzten Jahren ist die Nachfrage nach 1,3-Propandiol erheblich gestiegen, und die Entdeckung neuartiger Produktionsmethoden hat zu einer Senkung der Kosten geführt.
Inhaltsverzeichnis
1. Herstellung von 1,3-Propandiol
1.1. Hydrierung von 3-Hydroxypropanal
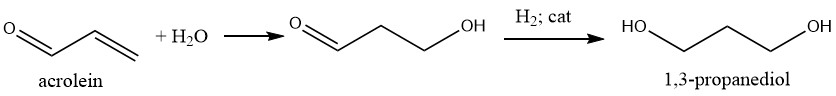
1,3-Propandiol kann durch einen zweistufigen Prozess synthetisiert werden, der die Hydrolyse von Acrolein zu 3-Hydroxypropanal und die anschließende Hydrierung umfasst.
Bei der Hydrolyse wird Wasser unter schwach sauren Bedingungen eingesetzt, wobei die anfängliche Acroleinkonzentration im Wasser etwa 20 % beträgt. Erhöhte Acroleinkonzentrationen neigen dazu, aufgrund der Reaktion zwischen Acrolein und Hydroxypropanal mehr unerwünschte Nebenprodukte zu erzeugen.
Eine direkte Hydrierung von 3-Hydroxypropanal in der wässrigen Phase ist möglich, obwohl die bevorzugte Methode darin besteht, den Aldehyd in ein organisches Lösungsmittel, hauptsächlich 2-Methylpropanol, zu extrahieren und ihn anschließend zu dem Diol zu hydrieren.
Die Hydrierung kann mit Raney-Nickel unter Druck in der wässrigen Phase oder mit Nickel-Trägerkatalysatoren bei 2–4 MPa und 110–150 °C in der organischen Phase durchgeführt werden.
Das Diol kann durch Destillation vom Lösungsmittel und Wasser getrennt werden. Allerdings ist die Ausbeute des gewünschten Produkts auf diesem Weg mit etwa 45 % relativ gering.
Der Umgang mit Acrolein im Produktionsprozess muss sorgfältig kontrolliert werden.
Degussa-DuPont nutzte dieses Verfahren bis Anfang der 2000er Jahre zur 1,3-Propandiol-Herstellung. Aufgrund der Gefahren bei der Handhabung und Bedenken hinsichtlich der Nachhaltigkeit wurde sie jedoch durch die biotechnologische Produktion ersetzt.
1.2. Hydroformylierung von Ethylenoxid
Eine von Shell eingehend untersuchte Methode zur Synthese von 1,3-Propandiol ist die Hydroformylierung von Ethylenoxid.
Im ersten Schritt reagieren Kohlenmonoxid und Ethylenoxid in Gegenwart eines metallorganischen Katalysators zu 3-Hydroxypropanal, das anschließend durch Hydrierung reduziert wird, um 1,3-Propandiol in hoher Ausbeute (92 %) zu erhalten.
Diese Methode bietet einen leichten Vorteil, da Ethylenoxid kostengünstiger ist als 3-Hydroxypropanal. Nachteilig bei beiden Verfahren ist jedoch die Herstellung bzw. Verwendung gefährlicher Stoffe sowie die Notwendigkeit hoher Drücke und Temperaturen.

1.3. Selektive Desoxygenierung von Glycerin
Glycerin kann durch heterogene oder homogene Katalyse in Propandiole umgewandelt werden.
Bei Verwendung eines metallorganischen Katalysators auf einem Zirkoniumdioxidträger bei erhöhtem Wasserstoffdruck und 170 °C führt die selektive Desoxygenierung von Glycerin zu einer Mischung aus 1,3-Propandiol (24 % Ausbeute) und 1,2-Propandiol (12 % Ausbeute). ) und 1-Propanol (28 % Ausbeute).
Unter Verwendung von p-Toluolsulfonsäure als Katalysator und Schutzgruppen kann ebenfalls eine Gesamtausbeute von 72 % für 1,3-Propandiol erreicht werden. Dieser Prozess umfasst Acetalisierung zum Schutz der ersten und dritten Hydroxylgruppe des Glycerins, Tosylierung der zentralen Hydroxygruppe, um sie zu einer besseren Abgangsgruppe zu machen, gefolgt von Detosylierung und Hydrogenolyse.

2. Chemische Reaktionen von 1,3-Propandiol
1,3-Propandiol weist die typischen Eigenschaften von Alkoholen auf. Bei erhöhten Temperaturen kann es mit Carbonsäuren zu Estern kondensieren, ähnlich wie 1,2-Propandiol.
Darüber hinaus kann es mit Säurechloriden und Isocyanaten unter Bildung von Estern bzw. Urethanen reagieren. Im Gegensatz zu 1,2-Propandiol besitzt 1,3-Propandiol zwei primäre Hydroxylgruppen, die eine gleichwertige Reaktivität aufweisen.
1,3-Propandiol neigt leicht zur Etherbildung. Insbesondere bei längerem Rückfluss kann 3,3´-Dihydroxydipropylether entstehen. 1,3-Propandiol kann bei Reaktion mit Aldehyden und Ketonen, häufig in Gegenwart saurer Katalysatoren, auch 1,3-Dioxane bilden.
Wenn 1,3-Propandiol bei Temperaturen über 250 °C Aluminiumoxid ausgesetzt wird, zerfällt es in Allylalkohol, Propanol und andere Nebenprodukte.
Es kann auch zur Bildung von Polyestern mit Disäuren verwendet werden, und der resultierende Polyester mit Terephthalsäure weist bekanntermaßen einen kristallinen Schmelzpunkt von 220 °C auf.
Polyurethane können auch aus 1,3-Propandiol synthetisiert werden.
Aufgrund seiner geringen Toxizität und seiner leichten biologischen Abbaubarkeit wird erwartet, dass 1,3-Propandiol nur geringe Auswirkungen auf die Umwelt hat.
3. Verwendung von 1,3-Propandiol
Als Diol hat 1,3-Propandiol zahlreiche gemeinsame Polymeranwendungen mit anderen niedermolekularen Diolen wie Ethylenglykol, 1,2-Propandiol und 1,4-Butandiol.
Allerdings war seine Nutzung aufgrund der relativ hohen Kosten über einen längeren Zeitraum auf Anwendungen beschränkt, die hochspezifische Leistungsmerkmale erforderten. Dennoch hat die Entwicklung kostengünstiger Produktionswege seinen Nutzen erweitert.
Eine der bedeutendsten Anwendungen ist die Verwendung als Ausgangsmaterial zur Herstellung von Polytrimethylenterephthalat (PTT).
Darüber hinaus wird 1,3-Propandiol als Frostschutzmittel und Kühlmittel eingesetzt und dient als Rohstoffquelle für 1,3-Dioxane.
1,3-Propandiol-bis(4-aminobenzoat) kann als Kettenverlängerer in Polyurethan-Elastomeren fungieren. Dieses Bisbenzoat, das ebenfalls aus 1,3-Dichlorpropan synthetisiert werden kann, findet weitere Anwendungen als Vernetzungsmittel in Epoxidformulierungen und als Kautschukadditiv.
Referenz
- Propanediols, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a22_163.pub2




