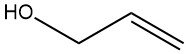
Allylalkohol ist eine organische Verbindung mit der chemischen Formel C3H6O. Es ist eine klare, farblose Flüssigkeit mit einem stechenden, knoblauchartigen Geruch und wird aufgrund des Vorhandenseins einer Doppelbindung in seiner Molekülstruktur sowohl als primärer als auch als ungesättigter Alkohol klassifiziert.
Die Doppelbindung befindet sich zwischen dem zweiten und dritten Kohlenstoffatom im Molekül und die Hydroxylgruppe (-OH) ist an das erste Kohlenstoffatom gebunden.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Allylalkohol
Allylalkohol (IUPAC-Bezeichnung: Prop-2-en-1-ol) ist eine farblose, bewegliche Flüssigkeit mit reizendem Geruch. Es hat die Summenformel C₃H₆O und eine Molmasse von 58,08 g/mol. Der Schmelzpunkt liegt bei -129 °C und der Siedepunkt bei 96,9 °C (101,3 kPa). Allylalkohol ist mit Wasser und organischen Lösungsmitteln mischbar.
| Eigenschaft | Wert |
|---|---|
| Relative Dichte |
|
| Brechungsindex |
|
| Kritische Temperatur | Tkrit = 271,9 °C |
| Verdampfungswärme bei 101,3 kPa | 39,98 kJ/mol |
| Spezifische Wärmekapazität von Dampf | Cp (g), (20 °C und 101,3 kPa) = 2,428 kJ/kg.K |
| Spezifische Wärmekapazität einer Flüssigkeit | Cp (l), (20,5 – 95,5 °C) = 2,784 kJ/kg.K |
| Verbrennungswärme bei konstantem p | 1853,8 kJ/mol |
| Viskosität |
|
| Oberflächenspannung |
|
| Dipolmoment | 1,63 D |
| Dielektrizitätskonstante | bei 16,2 °C, λ = 60 cm : 20,3 |
| Zündgrenzen in Luft | bei 100 °C, 101,3 kPa = 2,5 – 18,0 Vol.-% |
| Flammpunkt (geschlossener Tiegel) | 22,2 °C |
Allylalkohol ist mit Wasser und organischen Lösungsmitteln in allen Anteilen bei 20 °C mischbar. Er bildet binäre Azeotrope mit Wasser, Benzol, Diallylether, Allylchlorid, Trichlorethylen und ternäre Azeotrope mit (Wasser, Benzol) und (Wasser, Diallylether).
2. Chemische Reaktionen von Allylalkohol
Allylalkohol ist eine vielseitige Verbindung, die eine Vielzahl von Reaktionen eingehen kann, darunter Oxidations-, Reduktions-, Hydrierungs-, Kondensations- und Additionsreaktionen.
Bei Raumtemperatur ist Allylalkohol in Form einer flüssigen Substanz stabil. Beim Erhitzen von Allylalkohol auf Temperaturen über 100 °C entstehen jedoch wasserlösliche Polymere (Polyallylalkohole), die mit Alkensäuren zu trocknenden Ölen reagieren.
Es kann auch auf Polyimide gepfropft oder in Gegenwart von Sauerstoff mit Styrol copolymerisiert werden.
Schwer entflammbare Polyurethanschäume werden durch Kondensationsreaktion zwischen Allylalkohol und Methylglucosidpolyethern, gefolgt von Bromierung und anschließender Zugabe von Isocyanaten hergestellt.
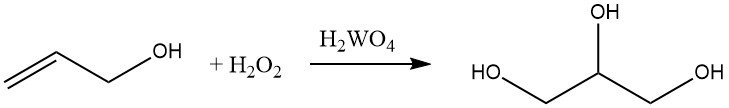
Allylalkohol kann mit Wasserstoffperoxid in Gegenwart von Wolframsäure zu Glycerin hydroxyliert werden. Diese Reaktion ist kommerziell wichtig für die Herstellung von Glycerin.
Die Hydroxylierung mit organischen Hydroperoxiden mit einem Vanadiumkatalysator ergibt Glycidol (Oxiranylmethanol), das auch durch die Reaktion von Allylalkohol mit Persäuren gewonnen werden kann.
Die Dehydrierung in der Gasphase mit Luft in Gegenwart von Katalysatoren wie Palladium, Silber oder Kupfer führt zur Bildung von Acrolein.
Durch die Flüssigphasenoxidation von Allylalkohol mit einem Palladiumkatalysator entstehen Acrylsäure und Acrolein mit einer Selektivität von 83 %.
Die katalytische Hydrierung von Allylalkohol ergibt 1-Propanol.
Durch Chlorierung von Allylalkohol in einer wässrigen Lösung entstehen Mono- und Dichlorhydrine von Glycerin, die weiter hydrolysiert werden können, um Glycerin zu ergeben.
Bromierung in einer mit Calciumchlorid gepufferten wässrigen Lösung führt zur Bildung von 2,3-Dibrom-1-propanol, einer Verbindung, die in flammfesten Materialien verwendet wird.
Die Reaktion von Allylalkohol mit Allylchlorid erzeugt Diallylether (Siedepunkt: 94 °C), während mit Methallylchlorid Allylmethallylether entsteht.
Allylalkohol kann sich durch radikalische Initiierung an Tetrachlorkohlenstoff addieren und 2,4,4,4-Tetrachlor-1-butanol bilden (Zwischenprodukt für Flammschutzmittel).
Es kann in Gegenwart von Kobaltcarbonyl hydroformyliert werden, um 4-Hydroxybutyraldehyd zu bilden. Mit Rhodium-Komplex-Katalysatoren wird die 4-Hydroxybutyraldehyd-Ausbeute auf 80 % verbessert. Der Aldehyd kann dann zu 1,4-Butandiol hydriert werden, einem wertvollen Monomer für die Synthese von Polyurethanen.
Wenn die Hydroformylierung von Allylalkohol in der Dampfphase unter Verwendung von Rhodiumtriphenylphosphinkomplexen auf porösen Trägern erfolgt, wird eine hohe Ausbeute an Tetrahydro-2-furanol erreicht (94 %).
Allylalkohol kann in Essigsäurelösung mit einem Palladiumchlorid-Katalysator zu 3-Butensäure carbonyliert werden.
3. Herstellung von Allylalkohol
Allylalkohol wird typischerweise aus Propen hergestellt, einem gasförmigen Kohlenwasserstoff. Es gibt verschiedene Möglichkeiten, Allylalkohol aus Propen herzustellen, die beiden gebräuchlichsten sind jedoch das Allylchloridverfahren und das Propylenoxidverfahren.
3.1. Hydrolyse von Allylchlorid
Die Hydrolyse von Allylchlorid ist ein kommerzielles Verfahren zur Herstellung von Allylalkohol. Allylchlorid wird mit einer verdünnten Natriumhydroxidlösung bei 150 °C und 1,3 – 1,4 MPa umgesetzt, was 85 – 95 % Allylalkohol ergibt.
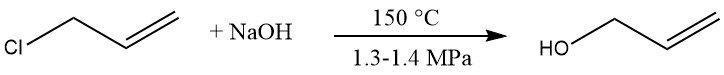
Nebenprodukte sind Diallylether (5 – 10 %), Chlorpropene, Propionaldehyd und hochsiedende Stoffe.
Das Allylchlorid und die wässrige alkalische Lösung müssen gründlich gemischt werden, um einen konstanten pH-Wert aufrechtzuerhalten. Das Allylchlorid muss nahezu quantitativ umgesetzt werden, da es korrosiv ist und nicht wirtschaftlich zurückgewonnen werden kann. Die Reaktion wird daher in einem Kreislaufreaktor durchgeführt, wobei Nickel das am besten geeignete Reaktormaterial ist.
Eine kommerzielle Anlage zur Herstellung von Allylalkohol durch kontinuierliche Allylchlorid-Hydrolyse ist in Abbildung 1 dargestellt. Wasser wird aus dem rohen Allylalkohol durch azeotrope Destillation mit Diallylether als Schleppmittel entfernt. Das rohe Allylalkohol-Wasser-Azeotrop (72 % Allylalkohol) kann für einige Reaktionen ohne weitere Reinigung verwendet werden.
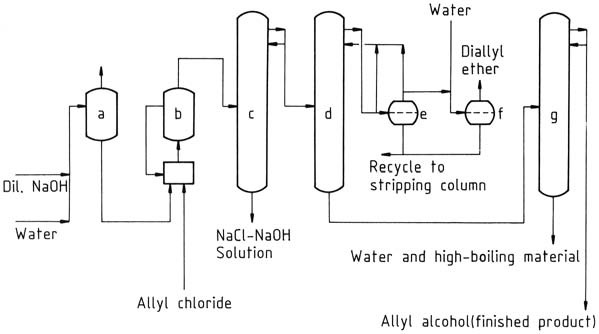
a) Vorwärmer; b) Hydrolysereaktor mit Rückführungssystem; c) Strippkolonne; d) Entwässerungskolonne; e) Trennzeichen; f) Diallylether-Waschtank; g) Allylalkohol-Reinigungssäule
Hier einige zusätzliche Details zur Hydrolyse von Allylchlorid:
- Die Reaktion ist exotherm, daher ist es wichtig, die Temperatur zu kontrollieren, um die Bildung von Nebenprodukten zu verhindern.
- Da die Reaktion auch korrosiv ist, ist es wichtig, korrosionsbeständige Materialien für den Reaktor und die Rohrleitungen zu verwenden.
- Die Nebenprodukte der Reaktion können recycelt oder als Nebenprodukte verkauft werden.
- Der azeotrope Destillationsschritt wird verwendet, um Wasser aus dem rohen Allylalkohol zu entfernen. Dieser Schritt ist notwendig, um ein hochreines Allylalkoholprodukt zu erhalten.
3.2. Isomerisierung von Propenoxid
Die katalytische Umlagerung von Propenoxid wird heute in der kommerziellen Produktion häufiger eingesetzt als die Hydrolyse von Allylchlorid. Der bevorzugte Katalysator für diese Reaktion ist Lithiumphosphat.
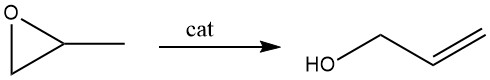
Beim Dampfphasenverfahren wird Propenoxiddampf über einen Lithiumphosphatkatalysator geleitet, wobei die Temperatur zwischen 250 und 350 °C liegt. Dieser Katalysator besteht aus bis zu 30 % Inertmaterial in Festbettstruktur. Die Umsätze liegen bei etwa 70–75 %, begleitet von einer Allylalkohol-Selektivität von 97 %.
Die resultierende Raum-Zeit-Ausbeute beträgt 0,5 kg Allylalkohol pro Liter Katalysator und Stunde. Olin Mathieson verwendet einen Lithiumphosphatkatalysator mit 1 % Alkalihydroxid; Allerdings muss dieser Katalysator nach 40 Stunden durch Waschen mit Aceton regeneriert werden.
Ein spezieller Katalysator, formuliert von den Chemischen Werken Hüls, enthält 73,6 % Lithiumphosphat und 17,5 % Siliziumdioxid und erfordert keine Regeneration. Bemerkenswerterweise bleibt auch nach 1200 Stunden eine Allylalkohol-Selektivität von 97,3 % erhalten.
Obwohl Lithiumarsenat als Isomerisierungskatalysator vorgeschlagen wurde, bietet es keinen wesentlichen Vorteil gegenüber Lithiumphosphat. Eine frühere Methode, katalysiert durch Chromoxid und entwickelt von Wyandotte Chemical Corp., zeigt deutlich geringere Umsätze und Selektivitäten.
Beim Flüssigphasenverfahren kommt beim Progil-Verfahren ein fein gemahlener Lithiumphosphat-Katalysator zum Einsatz, der in hochsiedenden Lösungsmitteln wie Terphenyl oder Alkylbenzolen suspendiert ist. Propenoxid wird bei 280°C in die Suspension eingeleitet.
Diese Variante erreicht eine Umsatzrate von 60 %, eine Allylalkohol-Selektivität von 92 % und eine Raum-Zeit-Ausbeute von 1 kg Allylalkohol pro Liter und Stunde. Die Lebensdauer von Katalysatoren beträgt 500 – 1000 Stunden.
Eine vergleichbare, von Jefferson Chemical Co. patentierte Technik nutzt ein Lösungsmittelgemisch aus Biphenyl und Diphenylether.
3.3. Hydrolyse von Allylacetat
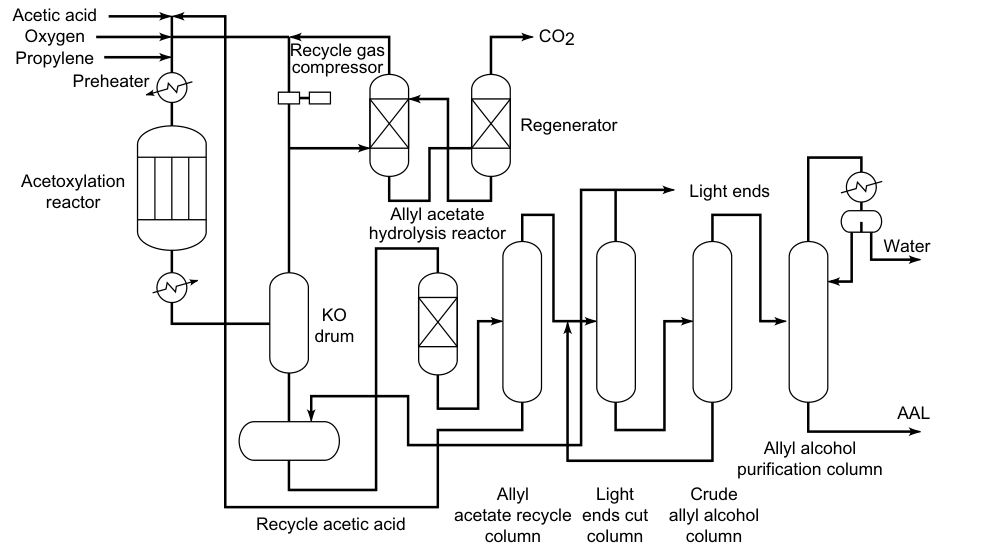
Propen, Essigsäure und Sauerstoff reagieren in der Gasphase an Palladiumkatalysatoren zu Allylacetat:
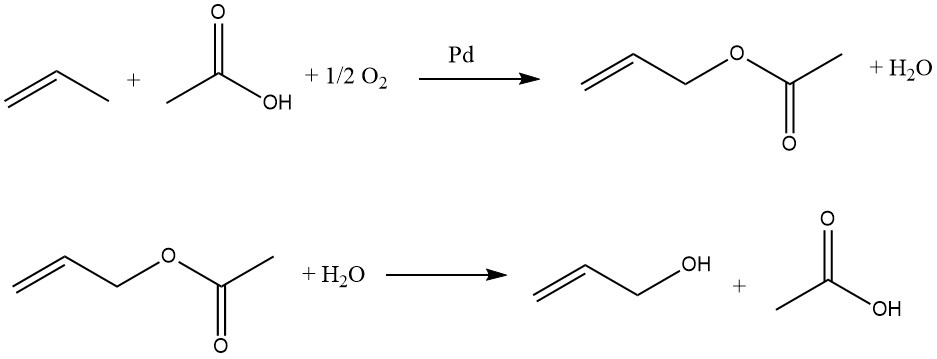
Diese Reaktion ist exotherm, daher muss die Temperatur des Reaktors kontrolliert werden. Das Allylacetat wird dann in einem separaten Reaktor zu Allylalkohol hydrolysiert. Die Essigsäure wird zurückgewonnen und bei der Oxidation von Propen wiederverwendet. Daher werden für die Herstellung von Allylalkohol lediglich Propen und Sauerstoff als Rohstoffe benötigt.
Dieses Verfahren erfordert kein Chlor und ist damit umweltfreundlicher als andere Methoden zur Herstellung von Allylalkohol. Allylacetat kann durch Erhitzen auf etwa 230 °C und 3 MPa hydrolysiert werden.
Beim Bayer-Verfahren erfolgt die Hydrolyse katalytisch an einem sauren Kationenaustauscher (sulfoniertes Polystyrol) bei 100 °C. Die Gesamtausbeute an Allylalkohol beträgt 90 %.
3.4. Hydrierung von Acrolein
Allylalkohol wird durch katalytische Hydrierung von Acrolein in der Dampfphase synthetisiert. Durch die Verwendung von Cadmium-Zink-Katalysatoren kann eine Ausbeute von bis zu 70 % erreicht werden, und ähnliche Ergebnisse können mit Silber-Cadmium-Legierungen auf inerten Trägern wie Aluminiumoxid oder Siliziumdioxid erzielt werden.
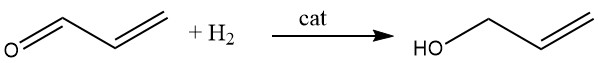
Alternativ kann Acrolein durch Ethanol oder Isopropylalkohol in Gegenwart einer Mischung aus Magnesiumoxid und Zinkoxid reduziert werden. Diese Reaktion findet in der Dampfphase bei 400 °C statt, was zu Allylalkoholausbeuten von bis zu 80 % führt.
4. Verwendung von Allylalkohol
Die Verwendungsmöglichkeiten von Allylalkohol sind wie folgt:
- Glycerinproduktion: Allylalkohol wurde ursprünglich von Unternehmen wie der Daicel Chemical Company als Rohstoff für die Herstellung von Glycerin eingesetzt.
- Monomer für Diethylenglykol-bis(allylcarbonat): Vor 1985 wurde Allylalkohol als Monomer bei der Herstellung von Diethylenglykol-bis(allylcarbonat) verwendet, das bei der Herstellung optischer Kunststofflinsen verwendet wird.
- Epichlorhydrin-Produktion: Showa Denko K.K. begann mit der Verwendung von Allylalkohol als Vorstufe bei der Herstellung von Epichlorhydrin, einer Verbindung, die in verschiedenen Anwendungen verwendet wird. Auch andere Epichlorhydrin-Hersteller erwogen den Übergang zum Allylalkohol-Verfahren.
- 1,4-Butandiol-Produktion: Die ARCO Chemical Company errichtete eine bedeutende Allylalkohol-Produktionsanlage und verwendete Allylalkohol als Rohstoff für die Herstellung von 1,4-Butandiol. Dies ist eine bemerkenswerte Anwendung, die den ersten Schritt zur industriellen Herstellung von 1,4-Butandiol unter Verwendung von Allylalkohol darstellt.
- Herstellung von Allylestern: Allylalkohol dient als Hauptrohstoff für die Herstellung von Allylestern, insbesondere Diallylphthalaten und Allylmethacrylat.
- Herstellung von Allylether: Allylalkohol wird auch bei der Herstellung von Allylether, insbesondere Allylglycidylether, verwendet.
- Styrol-Allylalkohol-Copolymer: Ein Styrol-Allylalkohol-Copolymer wird von Monsanto Chemical Company hergestellt. Dieses Copolymer findet Anwendung in wasserlöslichen Farben, Alkydharzen und Urethanen als Polyole.
- Allylalkohol geht Copolymerisationsreaktionen mit anderen Monomeren ein, um Zwischenprodukte zu erzeugen, die bei der Herstellung flammfester Materialien oder als Nematozid, Fungizid oder Konservierungsmittel verwendet werden.
5. Toxikologie und Arbeitsmedizin
Allylalkohol wurde eingehend auf seine reizende und toxische Wirkung untersucht. Sein Geruch kann bei etwa 0,8 ppm wahrgenommen werden.
Konzentrationen zwischen 6 und 12 ppm verursachen Nasenreizungen, während 25 ppm schwere Augenreizungen mit Symptomen wie Tränenfluss, Lichtempfindlichkeit, verschwommenem Sehen und Augenschmerzen hervorrufen.
Höhere Konzentrationen können zu Hornhautnekrose und vorübergehender Blindheit führen. Bei empfindlichen Personen kann es bereits bei Konzentrationen von 2 bis 5 ppm zu Augenreizungen kommen.
In Tierversuchen wurde die tägliche Inhalation von Allylalkoholdampf in Konzentrationen von 2 bis 7 ppm über 7 Stunden pro Tag über einen Zeitraum von 6 Monaten von Hunden, Kaninchen, Meerschweinchen und Ratten toleriert.
Der Grenzwert (TLV) und die maximal zulässige Konzentration (MAK) für Allylalkohol sind beide auf 2 ppm festgelegt. Der kurzfristige Expositionsgrenzwert liegt höher und liegt bei 4 ppm.
Allylalkohol zeigte hepatotoxische Wirkungen, wobei bei Ratten nach oraler und intraperitonealer Verabreichung Leberzellnekrose beobachtet wurde. Einmalige orale Verabreichung verursachte bei Ratten eine Lebernekrose, die zum Tode führte. Die LD50 liegt bei Kaninchen zwischen 50 und 80 mg/kg, bei Ratten bei 64 mg/kg.
Bei Hautkontakt mit Allylalkohol besteht aufgrund seiner hohen Resorptionsgeschwindigkeit die Gefahr einer systemischen Vergiftung. Selbst kleine Mengen, wie ein einzelner Tropfen (ca. 50 mg), können neben lokalen Reizungen auch systemische Wirkungen hervorrufen.
Ratten, die 15 Wochen lang 50 ppm Allylalkohol in ihrem Trinkwasser ausgesetzt waren, zeigten eine Toleranz ohne spürbare Nebenwirkungen.
Diese Ergebnisse verdeutlichen die toxische und reizende Natur von Allylalkohol mit unterschiedlichen Konzentrationsschwellen und möglichen Auswirkungen auf verschiedene Expositionswege. Beim Umgang mit dieser Verbindung sind die Richtlinien zur Arbeitssicherheit und die potenziellen Risiken, die mit der Hautexposition einhergehen, von entscheidender Bedeutung.
Verweise
- Allyl Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_425
Allyl Alcohol and Monoallyl Derivatives; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0112122514010701.a01.pub2
FAQ
Allylalkohol ist eine organische Verbindung mit der chemischen Formel C3H6O. Es gehört zur Klasse der Alkohole und enthält sowohl eine Hydroxylgruppe (-OH) als auch eine Allylgruppe (-CH2CH=CH2). Es ist ein wichtiges chemisches Zwischenprodukt, das in verschiedenen Industrien eingesetzt wird.
Der gebräuchliche Name für Allylalkohol ist „Propenol“.
Allylalkohol wird als Vorstufe für die Herstellung von Glycerin, Allylestern und anderen Chemikalien verwendet. Es wird auch bei der Synthese von Polymeren, flammfesten Materialien und Pharmazeutika verwendet.
Ja, Allylalkohol ist giftig und kann schädlich sein, wenn er eingenommen, eingeatmet oder über die Haut aufgenommen wird. Es kann zu Reizungen der Augen, der Haut und der Atemwege führen.
Allylalkohol ist in erster Linie eine industriell synthetisierte Verbindung und kommt in natürlichen Quellen nicht häufig vor. Es wird typischerweise durch chemische Prozesse in kontrollierten Umgebungen hergestellt.
Allylalkohol entsteht durch Hydrolyse von Allylchlorid oder Allylacetat und Umlagerung von Propenoxid. Bei diesen Prozessen handelt es sich um chemische Reaktionen, die Vorläuferverbindungen in Allylalkohol umwandeln.
Ja, Allylalkohol ist aufgrund seiner hydrophilen Hydroxylgruppe bis zu einem gewissen Grad mit Wasser mischbar.




