
Allylchlorid (cas 107-05-1) ist ein Chlorpropen, das erstmals 1857 von Auguste Cahours und August Wilhelm Hofmann durch Reaktion von Phosphorchlorid mit Allylalkohol hergestellt wurde. Der Name „Allyl“ leitet sich vom lateinischen Wort „allium“ ab, was „Knoblauch“ bedeutet. Allylchlorid hat einen charakteristischen Knoblauchgeruch, der bereits in geringen Mengen wahrnehmbar ist.
Ende der 1930er Jahre entwickelten die IG Farbenindustrie und die Shell Development Company ein Verfahren zur großtechnischen Herstellung von Allylchlorid durch Chlorierung von Propen bei hohen Temperaturen. Dieses Verfahren ermöglichte hohe Ausbeuten an Allylchlorid und wurde schnell von anderen Unternehmen übernommen, darunter Dow, Solvay und Asahi-Kashima.
Allylchlorid wird in einer Vielzahl von Anwendungen eingesetzt, unter anderem bei der Herstellung von Epichlorhydrin, Glycerin und Pestiziden. Es wird auch als Monomer bei der Herstellung von Kunststoffen und Harzen verwendet.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Allylchlorid
Allylchlorid ist eine farblose, bewegliche Flüssigkeit mit einem durchdringenden, stechenden Geruch. Es hat ein Molekulargewicht von 76,53 und einen Schmelzpunkt von -134 Grad Celsius. Sein Siedepunkt bei 101,3 kPa beträgt 44,4 Grad Celsius. Sein Brechungsindex bei 25 Grad Celsius beträgt 1,413.
Die folgende Tabelle zeigt die Temperaturabhängigkeit der physikalischen Eigenschaften von Allylchlorid
| Temperatur (°C) | Dichte (g/cm³) | Spezifische Wärmekapazität (kJ kg⁻¹ K⁻¹) | Viskosität (mPa·s) | Oberflächenspannung (mN/m) |
|---|---|---|---|---|
| 10 | 0,950 | 1,633 | 368 | 28,2 |
| 15 | 0,944 | 1,666 | 347 | 27,4 |
| 20 | 0,938 | 1.700 | 336 | 26,7 |
| 25 | 0,931 | 1,733 | 315 | 25,9 |
| 30 | 0,925 | 1,771 | 307 | 25,2 |
| 40 | 0,911 | 1,816 | 282 | 24,4 |
| 50 | 0,898 | 1,868 | 257 | 23,7 |
Der Dampfdruck von Allylchlorid kann mit der folgenden Gleichung berechnet werden:
log(p) = 19,1403 – 2098 / T – 4,2114×log(T)
Dabei ist p der Dampfdruck in kPa und T die Temperatur in Kelvin.
Allylchlorid ist mit den meisten allgemein verwendeten Lösungsmitteln mischbar, beispielsweise Octan, Toluol und Aceton. Die Löslichkeit von Allylchlorid in Wasser bei 20 Grad Celsius beträgt 0,36 % und die Löslichkeit von Wasser in Allylchlorid beträgt 0,08 %.
Die azeotropen Daten für Allylchlorid sind in Tabelle 2 aufgeführt.
| Komponente | BP bei 101,3 kPa, °C | Allylchlorid, Massenanteil, % |
|---|---|---|
| Wasser | 43 | 97,8 |
| Methanol | 40 | 90 |
| Ethanol | 44 | 95 |
| 2-Propanol | 45 | 98 |
| Ameisensäure | 45 | 92,5 |
2. Chemische Reaktionen von Allylchlorid
Allylchlorid ist eine sehr reaktive Verbindung, die eine Vielzahl von Additions-, Polymerisations- und Substitutionsreaktionen eingeht. Das Chloratom im Allylchlorid kann auch leicht durch andere Gruppen ersetzt werden. Dies macht Allylchlorid zu einem vielseitigen Ausgangsstoff für die Synthese verschiedenster Verbindungen.
2.1. Additionsreaktionen
Allylchlorid kann zu einer Vielzahl von Verbindungen beitragen, darunter Sauerstoff, Halogene, Halogenwasserstoffe, Silane, Borane, Carborane und Phosphortrichlorid. Diese Reaktionen können zur Herstellung einer Vielzahl von Allylderivaten verwendet werden.
Wenn beispielsweise Allylchlorid mit Sauerstoff in der flüssigen Phase bei ca. reagiert. Bei einer Temperatur von ca. 120 °C und in Gegenwart von Metallacetaten oder Wasserstoffperoxid entsteht Glycerinmonochlorhydrin.
Wenn Allylchlorid mit Halogenen reagiert, entstehen die entsprechenden Trihalogenverbindungen. Von großer industrieller Bedeutung ist die Reaktion mit hypochloriger Säure, bei der 2,3- und 1,3-Glycerindichlorhydrine entstehen (die anschließend mit Alkali zu Epichlorhydrin dehydrochloriert werden).
Allylchlorid reagiert mit Halogenwasserstoffen unter Bildung von 1,2-Dihalogenverbindungen. In Gegenwart von Peroxiden ergibt die Reaktion mit Bromwasserstoffsäure 1-Brom-3-chlorpropan (Kharasch-Effekt), in hochkonzentrierter Wasserstoffperoxidlösung entsteht jedoch 1,2-Dibrom-3-chlorpropan.
Bekannt sind auch Additionsreaktionen von Silanen, Boranen, Carboranen und Phosphortrichlorid sowie Cycloadditionen von Allylkationen mit Alkenen. Allylchlorid polymerisiert mit Schwefeldioxid zu Polysulfonen.
2.2. Polymerisation
Allylchlorid kann zu Poly(allylchlorid) polymerisieren, einem harten, farblosen Harz. Dieses Harz wird in einer Vielzahl von Anwendungen verwendet, darunter Farben, Klebstoffe und Dichtstoffe.
2.3. Substitutionsreaktionen
Das Chloratom in Allylchlorid kann leicht durch andere Gruppen wie Jodid, Cyanid, Isothiocyanat, Sulfid, Polysulfide und Alkylthiole ersetzt werden. Diese Reaktionen können zur Herstellung einer Vielzahl von Allylderivaten mit unterschiedlichen Eigenschaften verwendet werden.
Wenn beispielsweise Allylchlorid mit Natriumsulfit reagiert, entsteht Natriumallylsulfonat. Natriumallylsulfonat ist eine vielseitige Verbindung, die in einer Vielzahl von Anwendungen eingesetzt wird, darunter Kosmetika, Pharmazeutika und Lebensmittelzusatzstoffe.
Zusätzlich zu diesen üblichen Reaktionen kann Allylchlorid auch eine Vielzahl anderer Reaktionen eingehen, wie z. B. Carbonylierung, die Bildung organischer Polycarbonate und die Bildung von Allylethern.
Allylchlorid ist eine gefährliche Verbindung und sollte mit Vorsicht gehandhabt werden. Es handelt sich um eine brennbare Flüssigkeit, die Haut und Augen reizen kann. Es steht außerdem im Verdacht, krebserregend zu sein. Wenn Sie mit Allylchlorid arbeiten, ist es wichtig, Schutzausrüstung wie Handschuhe, Schutzbrille und Atemschutzmaske zu tragen.
3. Herstellung von Allylchlorid
3.1. Prozess der Propenchlorierung
Die umfangreiche Produktion von Allylchlorid erfolgt durch den Hochtemperatur-Chlorierungsprozess (300 – 600 °C) von Propen:
CH2 = CH–CH3 + Cl2 → CH2 = CH–CH2Cl + HCl ⇒ ΔH(298k) = -113 kJ/mol
Bei diesen erhöhten Temperaturen schreitet der Chlorierungsprozess über einen Radikalkettenmechanismus voran. Bei diesem Mechanismus wird überwiegend das in Allylposition befindliche Wasserstoffatom durch Chlor ersetzt, wodurch Allylchlorid entsteht.
3.1.1. Sekundärreaktionen und Nebenprodukte
Bei Temperaturen unter 200 °C erfolgt die Reaktion von Propen mit Chlor hauptsächlich über die Addition an die Doppelbindung, wodurch 1,2-Dichlorpropan entsteht. Wenn die Temperatur 300 °C übersteigt, kommt es zur Bildung von Allylchlorid, wodurch 1,2-Dichlorpropan als Nebenprodukt entsteht. In geringen Mengen entstehen auch weitere Chlorierungsprodukte:
- CH3–CH = CH2 + Cl2 → CH3–CHCl–CH2Cl ⇒ ΔH298 = -184 kJ/mol
- ClCH2–CH = CH2 + Cl2 → CH2Cl–CH = CHCl + HCl ⇒ ΔH298 = -101 kJ/mol
- CH3–CH = CH2 + Cl2 → CH3–C(Cl) = CH2 + HCl ⇒ ΔH298 = -121 kJ/mol
- CH3–CH = CH2 + Cl2 → CH3–CH = CHCl + HCl
3.1.2. Kritische Prozessparameter
Bei der großtechnischen Chlorierung von Propen zu Allylchlorid sind die Temperatur und das Verhältnis von Propen zu Chlor die einflussreichsten Faktoren. Druck und Verweilzeit haben minimalen Einfluss auf die Ausbeute an Allylchlorid.
Um die Bildung von 1,2-Dichlorpropan unter 200 °C zu verhindern, muss die Mischtemperatur von Propen und Chlor über 250 – 300 °C gehalten werden. Die höchsten Ausbeuten an Allylchlorid werden in Industriereaktoren erzielt, die bei einer Spitzentemperatur von 500 – 510 °C betrieben werden.
Überschreitet die Temperatur diesen Bereich, kommt es zur spontanen Pyrolyse, die zu Ruß und hochsiedenden Teeren führt. Unter experimentellen Bedingungen bei etwa 600 °C bildet sich Benzol, was zu einer Verringerung der Allylchloridausbeute führt.
3.1.3. Propen-Chlor-Verhältnis
Eine Erhöhung des Propenüberschusses führt zu einer verringerten Bildung von Nebenprodukten. Es erhöht jedoch die Kosten für die Propenverarbeitung. Folglich werden optimale Reaktionsbedingungen von wirtschaftlichen Faktoren beeinflusst, einschließlich des Bedarfs an Dichlorid-Nebenprodukten für die Verwendung als Nematizide. Diese Nebenprodukte können auch als Ausgangsstoffe für die Synthese von Lösungsmitteln vom Typ C1 oder C2 dienen.
3.1.4. Reaktordruck und Verweilzeit
Der Druck des Reaktors hat nur minimale Auswirkungen auf die Produktausbeute und -verteilung. Sie wird ausschließlich durch den Druckabfall im Propen-Kreislaufsystem bestimmt. Ebenso hat die Verweilzeit einen begrenzten Einfluss auf die Allylchloridausbeute.
Chlor reagiert bei hohen Temperaturen von 300 bis 600 °C innerhalb von 1–3 Sekunden vollständig und eine zu lange Verweilzeit führt zur thermischen Zersetzung von Allylchlorid.
3.1.5. Reaktordesign und Materialauswahl
Reaktoren im industriellen Maßstab arbeiten überwiegend adiabatisch, optimale Ausbeuten könnten jedoch auch bei isothermem Betrieb erzielt werden. Aufgrund der schnellen und exothermen Natur der Reaktion ist der Wärmeverlust durch die Reaktorwände vernachlässigbar gering.
Der einfachste und traditionellste Reaktortyp ist der Rohrreaktor, der häufig mit Gasverteilungs- und Rußentfernungsfunktionen ausgestattet ist. Es sind zahlreiche andere Reaktorkonfigurationen bekannt, die jeweils darauf abzielen, ein schnelles und gründliches Mischen der Reaktanten zu ermöglichen, um die Bildung von 1,3-Dichlorpropen zu vermindern.
Unter hochturbulenten Strömungsbedingungen werden Propen und Chlor mit Geschwindigkeiten von bis zu 300 m/s in die Reaktionszone eingeleitet. Die Bedeutung präziser Mischbedingungen wird durch einen Zyklonreaktor unterstrichen, bei dem ähnliche Ausbeuten bei einem Molverhältnis von 3:1 erzielt werden, verglichen mit einem Verhältnis von 5:1 bei alternativen Konstruktionen. Mehrere Reaktoren verfügen über Kühlmäntel.
Durch den Einsatz einer Reaktorkaskade mit verteiltem Chlor können Chlorumwandlungsraten von bis zu 86 % erreicht werden. Eine solche Anordnung ermöglicht höhere Vorheiztemperaturen aufgrund höherer Propen:Chlor-Verhältnisse im Anfangsreaktor.
3.1.6. Rohstoffvorbereitung
Die Reinheit von Propen und Chlor ist sehr wichtig. Verunreinigungen im Propen lösen die Bildung von Nebenprodukten und Chlorverlust aus. Insbesondere fördert Propan die Entwicklung von Chlorderivaten (1-Chlorpropan, 2-Chlorpropan), deren Trennung schwierig ist.
Als Ausgangsmaterial wird häufig Propen mit einer Reinheit von etwa 99,5 % in Polymerqualität eingesetzt. Um eine ausreichende Reinheit zu gewährleisten, wird Chlor erneut verdampft. Dabei werden jedoch Spuren von Inertgasen eingetragen, die beim Ablassen zu Propenverlusten führen. Sowohl Propen als auch Chlor müssen möglichst wasserfrei sein.
3.1.7. Prozessübersicht
Ein ähnliches Verfahren wie Shell ist in Abbildung 1 dargestellt.
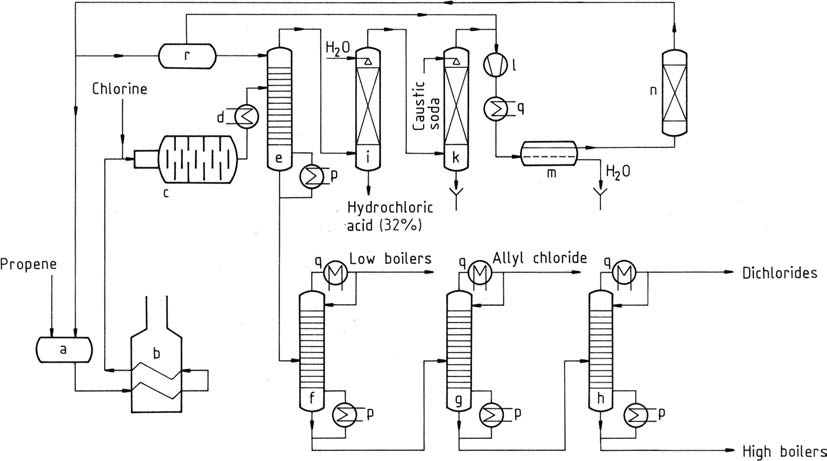
a) Lagerbehälter für flüssiges Propen; b) Verdampfer und Überhitzer für Propen; c) Reaktor; d) Kühler; e) Vorfraktionator; f) Lichtsäule; g) Allylchlorid-Reinigungssäule; h) Dichlorpropensäule; i) Chlorwasserstoffabsorber; k) Gaswäscher; l) Kompressor; m) Dekanter zum Entfernen von Wasser; n) Propen-Trockner; p) Verdampfer; q) Kondensator; r) Lagerbehälter für kaltes Propen
Flüssiges Propen wird verdampft und anschließend auf Temperaturen von 350 – 400 °C vorgeheizt (b). Dieses Gemisch wird zusammen mit gasförmigem Chlor über einen Mischstrahl in den Reaktor (c) eingeleitet.
Durch die vollständige Chlorreaktion steigt die Temperatur auf 500 – 510 °C (unter optimalen Bedingungen). Selbst unter den besten Bedingungen kommt es zu einer minimalen Kohlenstoffbildung, die die Chlorierung katalysiert. An den Reaktorwänden bildet sich ein glasartiger Kohlenstoff-Schutzfilm.
Dieses Material besteht aus stark chlorierten Substanzen und Teer und erfordert eine regelmäßige Reinigung alle 4 – 8 Wochen. Zur Aufrechterhaltung einer Teilproduktion während der Reinigung werden häufig parallele Reaktorketten eingesetzt oder es kann ein alternierender Betrieb der beiden Ketten angestrebt werden.
Der aus dem Chlorierungsreaktor austretende Gasstrom wird einer Vorkühlung (d) unterzogen und einem Vorfraktionator (e) zugeführt. Die Überkopftemperatur dieses Vorfraktionators, die bei etwa -40 °C gehalten wird, wird durch die Zufuhr von flüssigem Propen gesteuert. Dadurch werden chlorierte Kohlenwasserstoffe abgetrennt, wobei das Sumpfprodukt frei von Propen und Chlorwasserstoff ist.
Das Kopfgasgemisch wird durch Wasserabsorption (i) getrennt und ergibt wässrigen Chlorwasserstoff und Propen in kommerzieller Qualität. Anschließend wird Propen in einem Wäscher (k) mit Natronlauge gewaschen, um Spuren von Chlorwasserstoff zu entfernen.
Nach der Kompression auf 1,2 MPa (12 bar) wird Propen in einem Kondensator (l, q) kondensiert. Flüssiges Propen wird durch Adsorption getrocknet (n) und Wasser entfernt (m) und dann in die Lagerung zurückgeführt (a).
Das Sumpfprodukt des Vorfraktionators enthält 80 % Allylchlorid, 3 % 2-Chlor-1-propen und andere niedrigsiedende Komponenten sowie 16 % Dichloride (hauptsächlich 1,2-Dichlorpropan sowie cis- und trans-1,3-Dichlor). -1-Propen) und 1 % 1,2,3-Trichlorpropan und andere hochsiedende Fraktionen. Diese Fraktionen können durch Destillation weiter getrennt werden (f, g, h).
3.1.8. Materialauswahl für den Bau
Die Wahl der Materialien für die Allylchloridsynthese (Propenkreislauf) hängt von den Prozessspezifika, der Temperatur und dem Druck ab. Standard-Kohlenstoffstahl kann verwendet werden, wenn die Produktströme einen niedrigen Wassergehalt aufweisen.
Wenn Chlor nicht vorgewärmt wird, kann im Reaktorbereich auch Kohlenstoffstahl eingesetzt werden. Im Reaktorbereich erfordert die Chlorbeständigkeit bei hohen Temperaturen jedoch Materialien wie Chrom-Nickel-Stähle, Nickel und Kupfernickellegierungen.
Graphit- und PTFE-Beschichtungen sind ideal für die Chlorwasserstoffabsorption, während gummierter Stahl für den Natronlaugewäscher geeignet ist. Kohlenstoffstahl reicht für die gesamte Anlage zur Fraktionierung chlorierter Kohlenwasserstoffe aus, obwohl Umgebungen mit großen Wassermengen teure Materialien wie Nickel und Kupfernickel erfordern. Trockenes Allylchlorid kann ohne Korrosionsbedenken in Stahlbehältern gelagert werden.
3.2. Andere Produktionsprozesse
Für die Synthese von Allylchlorid wurden alternative Verfahren vorgeschlagen, aber keine dieser Methoden wurde im kommerziellen Maßstab umgesetzt.
3.2.1. Katalytische Chlorierung von Propen
Bei der Chlorierung von Propen kommen bei dieser Methode Tellur enthaltende Katalysatoren zum Einsatz, was zu Allylchlorid-Ausbeuten von bis zu 82 % führt. Das primäre Nebenprodukt ist 17 % 2-Chlorpropan (Isopropylchlorid).
Nicht umgesetztes Propen und der während der Reaktion entstehende Chlorwasserstoff können in einem nachfolgenden Schritt mittels Oxychlorierung in Allylchlorid umgewandelt werden.
3.2.2. Dehydrochlorierung von 1,2-Dichlorpropan
Der Dehydrochlorierungsprozess von 1,2-Dichlorpropan führt zu einer bescheidenen Ausbeute von nur 55 % Allylchlorid, begleitet von einer erheblichen Menge an Monochlorpropenen. Obwohl bei der Herstellung von Propenoxid reichlich Dichlorpropan anfällt, hat dieses Verfahren keine kommerzielle Nutzung.
3.2.3. Oxychlorierung
Die Oxychlorierung wurde als Ansatz zur Herstellung von Allylchlorid entwickelt, bei dem leicht verfügbarer Chlorwasserstoff anstelle von Chlor als primärer Rohstoff verwendet wird. Es wurden verschiedene Katalysatorsysteme vorgeschlagen, darunter Palladium, Vanadium, Tellur, Kupfer, Lithium, Mangan sowie deren jeweilige Chloride, Oxide und Kombinationen davon.
Während viele dieser Oxychlorierungsprozesse von Propen ausgehen, gehen einige von Propan aus.
Ein Prozess, der in einer Pilotanlage von Hoechst evaluiert wurde, umfasst die Reaktion von Propen, Chlorwasserstoff, Sauerstoff und 2-Chlorpropan (das in einem Nebenreaktor hergestellt oder von außen eingeführt werden kann) in einem primären Wirbelschichtreaktor, der bei Temperaturen von arbeitet 200 – 260 °C und 0,1 MPa (1 bar) Überdruck (ΔH = -218 kJ/mol).
Die Katalysatormischung umfasst Tellur, Vanadiumpentoxid, Phosphorsäure und eine Stickstoffverbindung als Promotor. Ein Teil des Katalysatorstroms wird in einem Seitenstrom mit Luft und Salpetersäure behandelt, um die Koksbildung zu verhindern und eine gleichbleibende Reaktivität aufrechtzuerhalten.
In einem separaten Reaktor wird 2-Chlorpropan aus Propen, Chlorwasserstoff und einer Eisenchloridlösung hergestellt. Das nicht umgesetzte Propen, 2-Chlorpropan und Chlorwasserstoff werden abgetrennt und recycelt.
Die Allylchloridausbeute liegt zwischen 88 % und 94 %, basierend auf der Propenzufuhr. Die Reinheit des Propens ist in diesem Fall nicht besonders kritisch.
Bestimmte Oxychlorierungsansätze haben inhärente Nachteile. Beispielsweise nehmen die Katalysatoraktivitäten aufgrund der Flüchtigkeit der verwendeten Metallsalze schnell ab, was aufgrund der geringen Umwandlung pro Durchgang große Reaktorvolumina erfordert.
Auch die Extraktion stark verdünnten Allylchlorids aus der Reaktionsmischung ohne übermäßigen Propenverlust durch Oxidation stellt Herausforderungen dar. Eine Lösung hierfür ist die Verwendung von Mangandioxid sowohl als Katalysator als auch als Sauerstoffträger. Die Hauptreaktionen im Primärreaktor sind folgende:
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
C3H6 + Cl2 → C3H5Cl + HCl
Anschließend wird der Katalysator mit Sauerstoff reoxidiert und aktiviert:
MnCl2 + O2 → MnO2 + Cl2
Dieses Verfahren erzielt Allylchlorid-Ausbeuten im Bereich von 71 % bis 81 %, basierend auf dem Propenverbrauch.
4. Verwendung von Allylchlorid
Allylchlorid ist ein wichtiges Zwischenprodukt in der petrochemischen Industrie. Es wird hauptsächlich zur Herstellung von Epichlorhydrin verwendet, das zur Herstellung von Epoxidharzen verwendet wird. Allylchlorid ist auch ein Ausgangsmaterial für die Synthese verschiedener anderer Chemikalien wie Glycerin, Ester, Allylether und Allylamine.
Andere Verbindungen, die aus Allylchlorid hergestellt werden können, umfassen Allylisothiocyanat (synthetisches Senföl), Allylsulfonat, Allylsilan und Cyclopropan.
Hier ist eine detailliertere Aufschlüsselung der Verwendungsmöglichkeiten von Allylchlorid:
- Epichlorhydrin: Allylchlorid wird zur Herstellung von Epichlorhydrin verwendet, einer vielseitigen Verbindung mit einem breiten Anwendungsspektrum. Epichlorhydrin wird zur Herstellung von Epoxidharzen verwendet, die in einer Vielzahl von Produkten verwendet werden, darunter Klebstoffe, Beschichtungen und Verbundwerkstoffe. Epichlorhydrin wird auch zur Herstellung von Glycerin verwendet, einer süßen, farblosen Flüssigkeit, die in einer Vielzahl von Produkten verwendet wird, darunter Lebensmittel, Kosmetika und Arzneimittel.
- Veresterung: Allylchlorid wird bei der Veresterung von Phthal-, Phosphor- und Carbonsäuren verwendet. Bei diesem Verfahren entstehen Ester, Verbindungen mit einem breiten Anwendungsspektrum. Ester werden in Parfüms, Aromen und Kunststoffen verwendet. Sie werden auch als Lösungsmittel und als Zwischenprodukte bei der Herstellung anderer Chemikalien verwendet.
- Allylether und Allylamine: Allylchlorid wird zur Herstellung von Allylethern und Allylaminen verwendet. Allylether sind Verbindungen mit charakteristischem Geruch, die in Parfüms und Aromastoffen verwendet werden. Allylamine sind Verbindungen mit einem breiten Anwendungsspektrum. Sie werden in Pharmazeutika, Agrarchemikalien und Kunststoffen verwendet.
- Andere Verbindungen: Allylchlorid kann auch zur Herstellung anderer Verbindungen wie Allylisothiocyanat, Allylsulfonat, Allylsilan und Cyclopropan verwendet werden. Allylisothiocyanat ist eine stark riechende Verbindung, die in Pflanzenschutzmitteln und pharmazeutischen Präparaten verwendet wird. Allylsulfonat wird als Galvanikbadzusatz und bei der Herstellung von Kohlenstofffasern verwendet. Allylsilan wird zur Herstellung von Additiven für die Gummiindustrie verwendet. Cyclopropan ist ein Anästhetikum, das in der Chirurgie eingesetzt wird.
5. Handhabung und Umweltschutz von Allylchlorid
Allylchlorid ist eine hochreaktive, giftige und brennbare Substanz. Daher unterliegt es in vielen Ländern strengen Vorschriften hinsichtlich seiner Emissionen in die Atmosphäre. Um diese Vorschriften einzuhalten, sollte Allylchlorid in geschlossenen Systemen gehandhabt werden.
Gasförmige Gemische, die Allylchlorid oder Nebenprodukte aus dem Produktionsprozess enthalten, müssen vor der Entlüftung durch Kondensation, Absorption, Adsorption oder Verbrennung gereinigt werden. Eine wirksame Technik zum Umfüllen von Allylchlorid von einem Behälter in einen anderen ist die Kompensationstechnik.
Eine Kontamination von Boden, Grundwasser, Gewässern oder Abwasser muss unbedingt vermieden werden. Jede mögliche Kontamination ist unverzüglich den Behörden zu melden.
Die Entsorgung Allylchlorid-haltiger Abfälle stellt keine große Gefahr dar, wenn spezielle Verbrennungsanlagen, wie sie für die Lösungsmittelentsorgung verwendet werden, eingesetzt werden. Die Verbrennungsgase dieser Verbrennungsanlagen müssen in Absorbern oder Wäschern behandelt werden, um den entstehenden Chlorwasserstoff zu entfernen.
Aufgrund der hohen Flüchtigkeit und des niedrigen Flammpunkts müssen Anlagen zur Herstellung und Verarbeitung von Allylchlorid strenge Brand- und Explosionsschutzvorschriften einhalten.
Bei der Verbrennung von chlorierten Kohlenwasserstoffen entsteht Chlorwasserstoff. Daher müssen Feuerwehrleute, die auf Brände mit Allylchlorid reagieren, mit Schutzanzügen und Atemschutzgeräten ausgestattet sein. Eine unzureichende Luftzufuhr während der Verbrennung kann zur Bildung von Kohlenmonoxid führen.
Allylchlorid ist hochreaktiv und kann mit anderen Stoffen heftig, exotherm und sogar explosionsartig reagieren. Dies gilt insbesondere für Alkali- und Erdalkalimetalle, aber auch für Aluminium und Zink sowie starke Oxidationsmittel wie konzentrierte Schwefelsäure.
Die wasserfreien Halogenide (z. B. Chloride) der oben genannten Metalle reagieren ebenfalls heftig mit Allylchlorid. Die Sicherheitsaspekte dieser exothermen Reaktionen in Anlagen, die Allylchlorid herstellen oder verarbeiten, müssen sorgfältig berücksichtigt werden.
1996 stufte die Europäische Union Allylchlorid als „gefährlich für die Umwelt“ und „sehr giftig für Wasserorganismen“ ein.
6. Toxikologie und Arbeitsmedizin
In Laborstudien an Ratten und Kaninchen deuten die LD50-Werte darauf hin, dass die orale Aufnahme von 460 mg/kg Allylchlorid bei Ratten tödlich war, während die perkutane Applikation von 3,7 mg/kg bei Kaninchen zur Mortalität führte. Darüber hinaus führte die Inhalation von Allylchlorid in einer Konzentration von 11 mg/L über 2 Stunden zu einem tödlichen Ausgang für Ratten.
- Allylchlorid ist eine giftige Chemikalie, die durch Einatmen, Verschlucken und über die Haut aufgenommen werden kann.
- Es reizt stark die Haut und die Schleimhäute und kann Symptome wie Augenreizungen, Husten, Kurzatmigkeit und Taubheitsgefühl verursachen.
- In hohen Konzentrationen kann Allylchlorid Lungenödeme (Flüssigkeit in der Lunge), Herzschäden, Leberschäden und Nierenschäden verursachen.
- Es steht außerdem im Verdacht, krebserregend und mutagen zu sein.
- Der Schwellenwert (TLV) für Allylchlorid beträgt 1 ppm (8 Stunden gewichteter Durchschnitt). Dies bedeutet, dass die durchschnittliche Konzentration von Allylchlorid in der Luft an einem 8-Stunden-Arbeitstag 1 ppm nicht überschreiten sollte.
- Der kurzfristige Expositionsgrenzwert für Allylchlorid liegt bei 2 ppm. Dies bedeutet, dass die Konzentration von Allylchlorid in der Luft für einen Zeitraum von 15 Minuten 2 ppm nicht überschreiten sollte.
- Allylchlorid hat einen stechenden Geruch, dieser Geruch ist jedoch kein zuverlässiges Warnsignal. Die Geruchswahrnehmungsschwelle für Allylchlorid liegt bei 3 bis 6 ppm und liegt damit deutlich über den zulässigen Arbeitskonzentrationen.
- Es gibt nur begrenzte Forschungsergebnisse zu den Auswirkungen von Allylchlorid auf die menschliche Gesundheit. Die verfügbaren Beweise deuten jedoch darauf hin, dass es sich um eine giftige Chemikalie handelt, die möglicherweise eine Vielzahl von Gesundheitsproblemen verursachen kann, darunter Krebs und Fortpflanzungsschäden.
Es ist wichtig zu beachten, dass die Informationen im Text nur eine Zusammenfassung der bekannten Toxizität von Allylchlorid sind. Die tatsächlichen Auswirkungen einer Allylchlorid-Exposition können je nach Expositionsniveau, Dauer der Exposition und anderen Faktoren variieren.
Verweise
- Allyl Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_425
- https://www.solvay.com/sites/g/files/srpend221/files/2021-01/PSS-Allyl-Chloride-Epichlorohydrin.pdf
FAQ
Allylchlorid, auch bekannt als 3-Chlorpropen, ist eine organische Verbindung mit der chemischen Formel C3H5Cl. Es handelt sich um eine farblose bis blassgelbe Flüssigkeit, die aufgrund ihrer Reaktivität und industriellen Anwendungen im Bereich der organischen Chemie von Bedeutung ist.
Ein anderer Name für Allylchlorid ist 3-Chlorpropen. Dieser alternative Name spiegelt seine Molekülstruktur wider, bei der ein Chloratom an das dritte Kohlenstoffatom in einem Propenmolekül gebunden ist.
Die Allylchloriddichte beträgt 0,939 g/ml bei 25 °C.
Allylchlorid wird hauptsächlich zur Herstellung von Epichlorhydrin verwendet, das zur Herstellung von Epoxidharzen verwendet wird. Allylchlorid ist auch ein Ausgangsmaterial für die Synthese verschiedener anderer Chemikalien wie Glycerin, Ester, Allylether und Allylamine.
Allylchlorid wird durch Hochtemperaturchlorierung von Propen hergestellt, ein Prozess, der als Propenchlorierung bekannt ist. Dabei wird ein Wasserstoffatom am allylischen Kohlenstoff durch ein Chloratom ersetzt. Zu seiner Herstellung werden auch mehrere andere Methoden wie die katalytische Chlorierung und Oxichlorierung eingesetzt.
Ja, Allylchlorid ist giftig und kann beim Einatmen, Hautkontakt oder Verschlucken ein Gesundheitsrisiko darstellen. Es kann zu Reizungen der Atemwege, der Haut und der Augen führen. Eine längere Exposition oder hohe Konzentrationen können zu schwerwiegenderen gesundheitlichen Auswirkungen führen. Beim Umgang mit Allylchlorid sind geeignete Schutzmaßnahmen zu ergreifen.
Allylchlorid hat einen stechenden, knoblauchartigen Geruch. Der Geruch ist bereits in sehr geringen Konzentrationen wahrnehmbar.
Allylchlorid ist hochreaktiv und kann verschiedene chemische Reaktionen eingehen. Es kann mit einer Reihe von Substanzen reagieren, darunter Wasser, Alkohole, Amine und andere Nukleophile. Es ist besonders reaktiv gegenüber Metallen, Alkali- und Erdalkalimetallen sowie starken Oxidationsmitteln wie konzentrierter Schwefelsäure. Bei diesen Reaktionen handelt es sich häufig um Substitutions- oder Additionsreaktionen am Allylkohlenstoff.


