
La acetona, también conocida como 2-propanona, es un líquido incoloro e inflamable con un olor acre y baja viscosidad. Es la cetona más simple, con la fórmula C3H6O. La acetona es miscible con agua, lo que significa que se mezcla fácilmente con agua en cualquier proporción.
Se utiliza principalmente como disolvente e intermediario en la síntesis de diversas sustancias químicas, como bisfenol A, metacrilato de metilo, sustancias químicas aldólicas (alcohol diacetona, óxido de mesitilo y metil isobutil cetona) y otros productos.
Históricamente, la acetona se producía comercialmente mediante la destilación seca de acetato de calcio hasta principios del siglo XX.
La acetona también está presente en la naturaleza, como en árboles y plantas, y también se produce metabólicamente en el cuerpo humano, principalmente a partir de la descomposición de grasas. Además, la acetona es fácilmente biodegradable.
Tabla de contenido
1. Producción de acetona
En la actualidad, el proceso de cumeno es el medio más importante para la fabricación de acetona, y representa más de 6 millones de toneladas de producción a nivel mundial cada año.
Otros métodos de producción contribuyen menos del 5% de la capacidad mundial.
1.1. Producción de acetona mediante proceso de cumeno
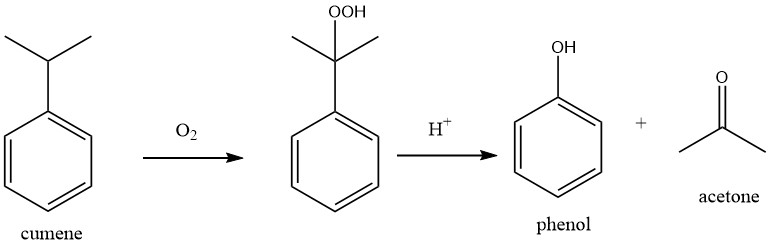
La producción de acetona a partir de benceno y propeno implica un proceso de dos pasos.
En el primer paso, la alquilación de Friedel-Crafts se utiliza para producir cumeno a partir de benceno y propeno en el proceso de cumeno.
Durante este proceso, los hidrocarburos de bajo punto de ebullición, como el propano, se separan de la materia prima de propeno en la unidad de destilación de cumeno. Los componentes de alto punto de ebullición, principalmente poliisopropilbencenos, se separan y se recogen como residuo.
Las materias primas de benceno y propeno generan una pequeña cantidad de agua como impureza.
En el segundo paso del proceso, conocido como proceso Hock, el cumeno se oxida con oxígeno atmosférico para producir hidroperóxido de cumeno (CHP). Utilizando un ácido mineral fuerte como catalizador, el CHP se escinde para producir fenol y acetona.
Durante el proceso de destilación se separan los componentes de bajo punto de ebullición, principalmente cetonas de la acetona, mientras que los componentes de alto punto de ebullición formados en la unidad de oxidación y disociación se recogen como residuo.
En el proceso fenol-acetona se genera una determinada cantidad de agua de proceso que debe ser tratada en una depuradora biológica de aguas residuales.
La reacción general del proceso se puede describir como una oxidación dual, en la que el benceno se oxida a fenol y el propeno se oxida a acetona.
1.2. Producción de acetona por deshidrogenación de 2-propanol

La deshidrogenación del 2-propanol (IPA), que se forma mediante la hidratación del propeno, representa una ruta alternativa para producir acetona. Se sabe que la reacción de deshidrogenación es endotérmica.
Este proceso fue responsable de aproximadamente el 50-60% de la producción total de acetona en los EE.UU. durante la década de 1970.
Sin embargo, actualmente, el proceso de oxidación de cumeno con acetona como coproducto se ha convertido en la principal fuente de producción de acetona en todo el mundo.
En la literatura se han descrito varios catalizadores para la deshidrogenación de 2-propanol.
El propeno es el subproducto primario que se forma por deshidratación del alcohol correspondiente. Además del propeno, también se forman aldehídos y óxido de mesitilo.
El producto de deshidrogenación, que contiene aldehídos, óxido de mesitilo, agua, 2-propanol y acetona, se somete a una etapa de lavado con sosa cáustica acuosa al 35% para eliminar los aldehídos. A esto le sigue una destilación en varios pasos para eliminar los productos de punto de ebullición ligero y la acetona del alcohol y el agua.
1.3. Producción de acetona por oxidación de propeno

El proceso Wacker-Hoechst ofrece un método elegante para la producción de acetona. Este proceso implica la oxidación del propeno utilizando aire u oxígeno como oxidante, en un rango de temperatura de 110-120°C y una presión de 10-14 bar.
En el proceso se utiliza un sistema catalizador compuesto por PdCl2 y CuCl2.
El PdCl2 actúa como catalizador, mientras que el CuCl2 reoxida el Pd° al estado bivalente. El cloruro de cobre (I) se puede oxidar fácilmente a cloruro de cobre (II) utilizando oxígeno.
La selectividad de este proceso para la acetona es aproximadamente del 92%, formándose propionaldehído como subproducto, junto con compuestos clorados como la monocloracetona y la 1,1-dicloroacetona.
Son posibles dos procesos diferentes para la oxidación directa, similares al proceso del acetaldehído.
En el primer proceso, el catalizador se trata con propeno y oxígeno en una sola etapa.
En el segundo proceso, el catalizador se trata con propeno en la primera etapa y luego se regenera en la segunda etapa usando oxígeno.
Se prefiere el proceso de dos etapas, ya que como alimentación se puede utilizar una mezcla de propeno-propano. El propano es inerte a la oxidación y no participa en la reacción.
2. Reacciones químicas de la acetona
La acetona pura es muy sensible a agentes oxidantes potentes, como el peróxido de hidrógeno y los peróxidos orgánicos.
Cuando se expone a ácido diluido y peróxido de hidrógeno, se forma trímero de peróxido de acetona.
Cuando la acetona reacciona con agentes reductores fuertes, genera calor y puede provocar explosiones.
Los álcalis fuertes también provocan la producción de calor al reaccionar con la acetona.
Además, la acetona mezclada con cloroformo en presencia de álcalis puede provocar una reacción violenta.
La reactividad de la acetona está gobernada por el enlace CO. El átomo de oxígeno tiende a atraer electrones del doble enlace, como se muestra en la estructura mesomérica del grupo carbonilo. Como resultado, el mecanismo de reacción carbonilo más común es el ataque nucleofílico al átomo de C del grupo carbonilo.
La protonación del átomo de oxígeno suele acompañar al ataque nucleofílico.
La reacción de acetona con HCN en presencia de una base como KOH conduce a la formación de cianhidrina de acetona, siendo el ion cianuro, derivado de HCN y KOH, responsable del ataque nucleofílico.
Los ácidos catalizan la adición de nucleófilos débiles.
La protonación del átomo de oxígeno del grupo carbonilo crea un carbocatión que puede ser atacado más fácilmente por el nucleófilo. Un ejemplo de tal reacción es la formación de un hemicetal o un cetal a partir de la reacción de un alcohol con acetona.
En la literatura se han informado varias reacciones nucleofílicas con acetona, como la formación de alcoholes terciarios al reaccionar con reactivos de Grignard (RmgX), 2-propanol con LiAlH4 o NaBH4 e iminas con aminas primarias, oxima con hidroxilamina y fenilhidrazona con hidracina. .
El átomo de α-hidrógeno del grupo carbonilo en la acetona es ácido. La presencia del grupo carbonilo mejora la polarización de los electrones, lo que da como resultado un átomo de hidrógeno más electropositivo. El anión resultante se estabiliza mediante dislocación mesomérica de la carga negativa entre el átomo de carbono y el átomo de oxígeno del carbonilo.
La reacción aldólica catalizada por bases de dos moléculas de acetona en presencia de un álcali produce diacetona alcohol.
3. Usos de la acetona
La acetona sirve como un importante intermediario químico en la producción de varias sustancias químicas, incluido el metacrilato de metilo (MMA), el bisfenol A y compuestos aldólicos como el alcohol diacetona (DAA), el óxido de mesitilo (MOX) y la metil isobutil cetona (MIBK).
Su uso principal en la industria química es producir cianohidrina de acetona.
Aparte de su uso como intermediario químico, la acetona es un disolvente versátil con numerosas aplicaciones. Se estima que la producción anual mundial de acetona supera los 6 millones de toneladas.
En 2010, las aplicaciones directas de disolventes representaron el 29% del uso de acetona, seguidas de acetonacianhidrina/MMA con un 24% y bisfenol A con un 22%.
Referencia
- Acetone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_079.pub4




