El fenol, también conocido como hidroxibenceno, es un compuesto orgánico con la fórmula química C6H5OH. Es un sólido cristalino de color blanco a temperatura ambiente, pero el fenol de grado técnico puede ser líquido debido a las impurezas. Tiene un olor distintivo, a menudo descrito como repugnantemente dulce y alquitranado.
Fenol fue descubierto inicialmente en 1834 por RUNGE, quien lo aisló con éxito del alquitrán de hulla y lo denominó ácido carbólico.
Posteriormente, LAURENT lo obtuvo en forma cristalina en 1841, determinó su composición y lo llamó inicialmente ácido fenólico, que luego se redujo a fenol.
En 1858, KEKULE propuso la estructura molecular del fenol. Antes de finales del siglo XIX, todo el fenol se recuperaba del carbón y se empleaba principalmente como desinfectante.
En 1897, HOFFMANN logró la primera síntesis de ácido acetilsalicílico a partir de fenol en forma pura y estable. En la década de 1900, la demanda de fenol aumentó con la comercialización de resinas fenólicas después de la Primera Guerra Mundial, bisfenoles después de la Segunda Guerra Mundial y policarbonatos en la década de 1960.
Tabla de contenido
1. Production of phenol
El proceso Hock, que implica la oxidación del cumeno, es la vía sintética más utilizada para la producción de fenol y representa una tasa de producción de más de 6,7 millones de t/a de fenol y aproximadamente 4,1 millones de t/a del coproducto acetona. Es un proceso económicamente competitivo, apoyado en la demanda de acetona.
Dado que se prevé que la demanda de fenol crecerá con mayor fuerza en el futuro, existe un interés comercial continuo en descubrir nuevas técnicas libres de coproductos para la síntesis de fenol, como la oxidación directa de benceno a fenol.
La oxidación de tolueno con ácido benzoico como producto intermedio se emplea actualmente para la producción de fenol.
A pesar de ello, todavía se obtienen unas 300.000 toneladas de fenol del alquitrán de hulla.
Solutia ha desarrollado la oxidación directa de benceno a fenol utilizando óxido nitroso desde aproximadamente 1995, aunque este enfoque aún no se ha comercializado.
Las rutas sintéticas convencionales, como el proceso de sulfonación del benceno y la hidrólisis del clorobenceno con sosa cáustica, ya no son económicamente importantes.
1.1. Producción de fenol mediante oxidación de cumeno (proceso Hock)
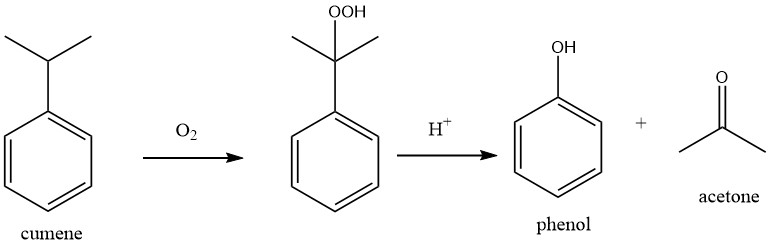
El proceso comprende dos reacciones químicas fundamentales: el cumeno se somete inicialmente a oxidación con oxígeno para producir hidroperóxido de cumeno (CHP), que posteriormente se escinde para formar fenol y acetona utilizando un ácido mineral fuerte como catalizador.
Ambas reacciones se caracterizan por una alta exotermia, con calores de reacción de -117 kJ/mol para la oxidación del cumeno y -252 kJ/mol para la escisión del peróxido.
H. HOCK y S. LANG describieron por primera vez estas reacciones en 1944. El proceso industrial de oxidación de cumeno fue desarrollado y comercializado posteriormente por The Distillers Co. en Gran Bretaña y Hercules Powder Company en EE. UU. después de la Segunda Guerra Mundial. En 1952, se estableció la primera planta con una capacidad de 8000 t/a en Shawinigan, Canadá.
1.2. Producción de fenol por oxidación de tolueno
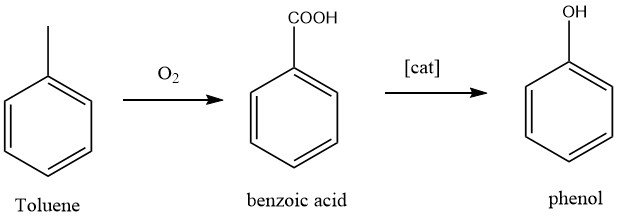
La California Research Corporation y Dow Chemical desarrollaron un proceso de dos pasos para la producción de fenol. En el primer paso, el tolueno se oxida a ácido benzoico, que es una reacción bien conocida. En el segundo paso, el ácido benzoico se oxida aún más a fenol.
La conversión de tolueno en fenol es una oxidación completa del grupo metilo, lo que da como resultado los subproductos dióxido de carbono y agua.
La oxidación del tolueno se lleva a cabo en fase líquida a un rango de temperatura de 100 – 150 °C y una presión manométrica de aproximadamente 2 bar, utilizando oxígeno atmosférico. El catalizador soluble utilizado es naftenato de cobalto en concentraciones entre 0,1 y 0,3 %.
El mecanismo de reacción de oxidación del tolueno a ácido benzoico es complejo, con alcohol bencílico y benzaldehído como intermediarios. Se forman subproductos como bencilbenzoato y bifenilo, así como ácido fórmico, ácido acético, dióxido de carbono y monóxido de carbono.
Para la oxidación del ácido benzoico en el segundo paso, se utiliza ácido benzoico fundido como medio reactivo y disolvente a una temperatura de alrededor de 230 –240 °C a presión atmosférica. Como catalizadores se utilizan oxígeno atmosférico, vapor y benzoato de cobre (II) soluble, y se añaden sales de magnesio como promotor.
El resultado neto de las reacciones simultáneas en el sistema es la formación de fenol.
El benzoato de cobre (II) se descompone térmicamente en benzoato de cobre (I) y ácido benzoilsalicílico, que posteriormente se hidroliza a ácido benzoico y ácido salicílico en presencia de agua o vapor. El ácido salicílico se descarboxila rápidamente para dar fenol y dióxido de carbono.
El proceso Dow se comercializó con la primera planta puesta en marcha a principios de la década de 1960 en Landar, Columbia Británica, seguida de una segunda planta en Kalama, Washington, y una tercera en Rosenburg, Países Bajos, operada por DSM. En 1991, Nippon Phenol puso en funcionamiento una nueva planta en Japón.
La Lummus Company introdujo un nuevo proceso para la oxidación del ácido benzoico en 1978, realizado en fase de vapor sobre un catalizador que contiene cobre en un reactor heterogéneo.
Según Lummus, la reacción no produce alquitranes ni residuos no volátiles, probablemente debido a la rápida eliminación de fenol de la zona de reacción.
1.3. Fenol del carbón
La recuperación de fenol «natural» del carbón ha sido un proceso comercial para producir fenol durante mucho tiempo y todavía se practica. Sin embargo, este proceso se ha vuelto insignificante como fuente de fenol hoy en día.
El fenol, así como muchos otros compuestos aromáticos, se recuperan de los vapores de la carbonización del carbón, donde el carbón se somete a temperaturas superiores a 900 °C en ausencia de aire en un horno de coque, dejando el coque como residuo sólido y los hidrocarburos y gases condensables. como vapores.
Los vapores se condensan para formar alquitrán de hulla, que puede lavarse con ácido sulfúrico acuoso o ácido fosfórico para recuperar amoníaco, o lavarse con un aceite de lavado para eliminar el benceno. El gas restante se utiliza como combustible in situ y está compuesto por hidrógeno y metano.
Para seguir procesando el alquitrán de hulla se utiliza la destilación continua. En la primera columna, se separa junto con agua el aceite ligero que contiene benceno, tolueno y xilenos. En la segunda columna, el aceite carbólico, que incluye fenol y compuestos fenólicos, se separa como cabeza, y el aceite de naftaleno se toma como corte lateral.
El producto del fondo de la segunda columna se fracciona aún más para producir aceite de lavado para la recuperación de benceno del gas residual, aceite de metilnaftaleno, aceite de antraceno y brea. Se utilizan altas relaciones de reflujo y un alto grado de integración térmica con columnas de placas o columnas con empaquetamientos aleatorios.
El aceite carbólico, que constituye alrededor del 2-3 % del alquitrán de hulla y contiene alrededor del 30-35 % de compuestos fenólicos como fenol y cresoles, se somete a un 8-9 % de sosa cáustica en una unidad de extracción. El fenol y los cresoles, conocidos como ácidos de alquitrán, se extraen en forma de sales en la fase acuosa. La lejía de fenolato cruda se destila al vapor para separar los hidrocarburos residuales y las bases de piridina.
Luego, la lejía de fenolato se trata con dióxido de carbono para liberar los alquitranes ácidos de sus sales en la columna. La fase acuosa que contiene carbonato de sodio se trata adicionalmente para eliminar el fenol disuelto.
La fase orgánica se fracciona en fenol puro (pb 181,8 °C), o-cresol (pb 191,0 °C), una mezcla de m- y p-cresoles (pb 202,0 – 203,0 °C) y una fracción de xilenol (pb hasta a 210 °C) mediante destilación discontinua.
2. Reacciones químicas del fenol
Las propiedades químicas del fenol se caracterizan por la influencia mutua del grupo hidroxilo y del anillo aromático entre sí.
2.1. Reacciones que involucran el vínculo O-H
A diferencia de los alcoholes alifáticos, el fenol es un ácido débil y forma sales solubles con bases fuertes, lo que resulta útil para su recuperación a partir de disolventes orgánicos como el alquitrán de hulla. Su valor de pKa en una solución acuosa es 10,0. El anión fenolato está estabilizado por el sistema de anillos aromáticos.
El fenol puede liberarse de sus sales incluso a temperatura ambiente mediante tratamiento con dióxido de carbono. Cerca de su punto de ebullición, el fenol puede desplazar a los ácidos carboxílicos de sus sales para formar fenolatos.
El grupo hidroxilo puede esterificarse fácilmente (por ejemplo, a acetato de fenilo) o eterificarse (por ejemplo, éter difenílico).
2.2. Reacciones del Anillo Aromático
El par de electrones del fenol se deslocaliza sobre el anillo aromático, provocando su acidez. El exceso de electrones en las posiciones orto y para hace que el fenol sea muy susceptible a la sustitución electrófila. Por ejemplo, el bromo en solución acuosa reacciona con el fenol para producir 2,4,6-tribromofenol con alto rendimiento.
La reacción de Kolbe es otra reacción importante que implica el acoplamiento de dióxido de carbono con fenóxido de sodio a 125 °C para dar salicilato de sodio. A 125 °C, el dióxido de carbono se sustituye en la posición orto, mientras que a temperaturas superiores a 250 °C, se favorece el isómero para.
Otras reacciones que siguen a la sustitución electrófila incluyen cloración, sulfonación y nitración.
2.3. Oxidación en fase líquida
La oxidación de sustancias orgánicas por el oxígeno molecular genera diversos productos intermedios, como el hidroperóxido de cumeno. Estos procesos siguen un complejo mecanismo radical.
El fenol puede inhibir tales reacciones al reaccionar con radicales libres para formar radicales fenoxi, que son relativamente estables y no propagan el mecanismo de cadena. Por lo tanto, se debe evitar cualquier entrada de fenol en los procesos de oxidación.
3. Usos del fenol
La capacidad de producción mundial de fenol supera los 9 millones de toneladas. El bisfenol A, un importante derivado del fenol, representa aproximadamente el 37% de la producción mundial.
El bisfenol A se utiliza comúnmente en la fabricación de policarbonatos de alta calidad para aplicaciones automotrices, discos compactos y acristalamientos, así como en la producción de resinas epoxi.
La segunda aplicación más importante del fenol es la producción de resinas fenólicas con formaldehído. Estas resinas se utilizan principalmente para aplicaciones de sellado inferior en la industria automotriz.
Además, el fenol se emplea para la síntesis de caprolactama mediante el uso de la ruta ciclohexanol–ciclohexanona.
Se producen varios otros derivados del fenol, incluidos alquilfenoles, difenoles, anilina y ácido salicílico.
Dado que el sector del automóvil es un importante consumidor de derivados del fenol, como policarbonatos y resinas fenólicas, la demanda de fenol sigue estando en gran medida ligada a este mercado, que tiende a ser cíclico.
Referecia
- Phenol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_299.pub3

