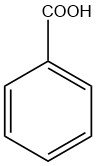
La denominación «ácido benzoico» se deriva de la goma de benjuí, una sustancia resinosa obtenida de la planta styrax autóctona del sur de Asia.
El ácido benzoico fue extraído por primera vez por SCHEELE en 1775, y su estructura química fue aclarada posteriormente por LIEBIG y W€OHLER en 1832.
Los enfoques iniciales para producir ácido benzoico se desarrollaron a finales del siglo XIX, utilizando la hidrólisis del benzotricloruro o la descarboxilación del anhídrido ftálico.
En la actualidad, el método más utilizado para fabricar ácido benzoico implica la oxidación de tolueno con aire, proceso que ha suplantado a las antiguas técnicas de oxidación con dicromato y ácido nítrico.
Tabla de contenido
1. Producción de ácido benzoico
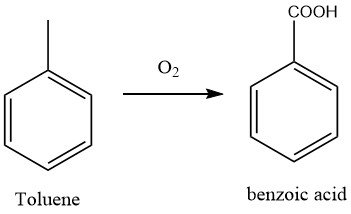
La oxidación en fase líquida de tolueno con oxígeno molecular fue desarrollada durante la Segunda Guerra Mundial por I.G. Farbenindustrie en Alemania. La planta utilizó un reactor de oxidación de columna de burbujas hecho de acero revestido de aluminio, con un tubo de entrada de aire, un separador y un absorbente para la recuperación de tolueno.
La reacción se catalizó con naftenato de cobalto (0,1 %) y el reactor estaba equipado con serpentines de intercambio de calor para eliminar el calor generado durante la reacción. La reacción se llevó a cabo a 140 °C y ca. 0,2 MPa durante 30 h, dando como resultado una conversión de tolueno del 50%, del cual el 80% se transformó en ácido benzoico.
La presencia de compuestos de azufre, compuestos de nitrógeno, fenoles y olefinas como impurezas fue crítica, ya que inhibían la reacción de oxidación. También se utilizaron como catalizadores otras sales de cobalto solubles en aceite.
Después de la reacción de oxidación, el producto bruto se neutralizó con carbonato de sodio para obtener benzoato de sodio y el tolueno sin reaccionar se recuperó mediante destilación. El proceso de oxidación era un proceso de cadena de radicales libres y los peróxidos eran intermediarios de reacción.
Mientras que el cobalto y el manganeso se comportaron de manera similar como catalizadores, el cobre afectó negativamente a la reacción. Las altas presiones también retardaron la reacción, especialmente a concentraciones más bajas de catalizador. A temperaturas superiores a 130 °C, la velocidad de reacción se determinó mediante difusión de oxígeno y los compuestos fenólicos se acumularon gradualmente durante la reacción, inhibiéndola eventualmente.
En los procesos modernos, la oxidación se lleva a cabo a 165 °C y 0,9 MPa, y el calor de la reacción se elimina mediante circulación externa del contenido del reactor.
La presión del líquido descargado del reactor se reduce a la atmosférica y se recupera el tolueno que no ha reaccionado.
El ácido benzoico se purifica mediante rectificación y el residuo del fondo se extrae para recuperar el catalizador de cobalto. Los gases de escape se enfrían para recuperar la mayor parte del tolueno, se purifican y se ventilan.
El reactor de oxidación puede ser una columna de burbujeo o un tanque agitador, siendo el acero inoxidable el material de construcción preferido.
El producto está contaminado por pequeñas cantidades de ácido ftálico, monóxido de carbono y dióxido de carbono en los gases de escape, y el rendimiento de ácido benzoico varía con la conversión de tolueno, con una selectividad por benzaldehído y alcohol bencílico superior al 10% en conversiones más bajas.
Para producir productos de mayor calidad, es necesario un procesamiento adicional como la sublimación, la recristalización y la neutralización.
Los metilbifenilos son los responsables del olor del producto, y para su eliminación se ha propuesto su extracción y tratamiento en una corriente de gas inerte.
La oxidación catalítica de hidrocarburos alquilaromáticos se puede mejorar añadiendo compuestos de bromo al catalizador de cobalto en ácido acético.
Este método ahora se usa ampliamente en la producción de ácido tereftálico y también es aplicable al proceso del ácido benzoico.
Otro tipo de activador de catalizador de cobalto es un compuesto carbonílico fácilmente oxidable tal como metiletilcetona o acetaldehído. Estos aditivos permiten una reducción considerable de la temperatura de reacción, pero debido a su elevado consumo, la tecnología no parece práctica.
La oxidación de tolueno en fase de vapor a temperaturas más altas es otro proceso potencial, que utiliza varios catalizadores como vanadio, tungsteno, uranio, molibdeno y plata. Sin embargo, los rendimientos no fueron comparables a los del proceso en fase líquida.
2. Reacciones químicas del ácido benzoico
La estabilidad del ácido benzoico frente a agentes oxidantes comunes como el aire, el permanganato, el ácido crómico, el hipoclorito y el ácido nítrico diluido ha sido bien documentada.
A temperaturas superiores a 220 °C, el ácido benzoico reacciona con sales de cobre (II) para producir fenol y sus derivados. Esta reacción, a la que sigue una regeneración de cobre (II) basada en oxígeno molecular, es la base para la producción industrial de fenol a partir de ácido benzoico.
En condiciones similares, el ácido benzoico reacciona con el amoníaco para producir anilina.
Al calentarlo a 150 °C, se produce deshidratación, lo que da como resultado la formación de anhídrido benzoico.
Cuando se calienta por encima de 370 °C o tan bajo como 245 °C en presencia de catalizadores, se produce la descarboxilación, lo que lleva a la formación de benceno y una pequeña cantidad de fenol. El uso de polvo de cobre y cadmio cataliza el proceso de descarboxilación.
Cuando el benzoato de potasio reacciona con dióxido de carbono, se desproporciona con respecto al tereftalato y al benceno, con la ayuda de sales de cadmio y zinc como catalizadores.
Se ha demostrado que el hidróxido de potasio fundido convierte el ácido benzoico en ácidos hidroxibenzoicos.
El ácido benzoico se puede hidrogenar directamente utilizando hidrógeno molecular, lo que da como resultado la producción de benzaldehído con un rendimiento cuantitativo. La reacción está catalizada por circonio y otros óxidos metálicos.
La hidrogenación sobre catalizadores de metales nobles conduce a la formación de ácido ciclohexanocarboxílico (ácido hexahidrobenzoico).
Además, la cloración produce ácido 3-clorobenzoico, la nitración forma ácido 3-nitrobenzoico y la sulfonación forma ácido 3-sulfobenzoico.
3. Usos del ácido benzoico
La gran mayoría del ácido benzoico se consume internamente para la producción de fenol, y sólo una pequeña cantidad ingresa al mercado abierto.
En el año 2006, el uso de benzoato de sodio y potasio como conservantes alimentarios representó el 41% del consumo mundial de ácido benzoico.
El ácido benzoico también se emplea en la fabricación de plastificantes de benzoato, resinas alquídicas y cloruro de bencilo.
Los ésteres de glicol derivados del ácido benzoico se utilizan como plastificantes en resinas vinílicas, con una mayor demanda en los EE. UU. debido a su sustitución del ftalato de butilbencilo en los adhesivos de emulsión de poli(acetato de vinilo).
El benzoato de sodio constituye un mercado importante para conservantes y anticorrosivos.
El ácido benzoico encuentra aplicación en resinas alquídicas modificadas para mejorar las propiedades superficiales de los esmaltes de acabado de automóviles.
Además, se utiliza como intermediario para la fabricación de perfumes, productos farmacéuticos y cosméticos.
Referencia
- «Benzoic Acid and Derivatives», Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_555


