El bromo es un líquido que posee alta densidad, coloración rojo oscuro y fuertes propiedades humeantes, además de ser altamente corrosivo y lacrimatorio. El olor del bromo es tan penetrante que se puede detectar en un volumen de 1 ppm en el aire.
El color del bromo depende de la temperatura, con tonos amarillo anaranjado a 20 K, que progresan a rojo anaranjado, marrón rojizo y, finalmente, casi negro en su punto de fusión. El bromo líquido mantiene un tono rojo oscuro, mientras que sus vapores son generalmente de color naranja a marrón rojizo.
A. J. Balard descubrió el bromo en 1824 mientras estudiaba la flora en una marisma cerca de Montpellier, Francia. Durante su investigación, observó un depósito de sulfato de sodio que había cristalizado en una cacerola de licor madre derivado de la sal común.
Mientras investigaba los usos potenciales de los licores residuales, BALARD descubrió que la saturación de cloro podría producir un nuevo líquido rojo que podría destilarse.
Tabla de contenido
1. Reacciones químicas del bromo
Las sólidas propiedades oxidantes del bromo son responsables de muchas de sus reacciones químicas. La afinidad electrónica del bromo es intermedia entre la del cloro y el yodo, al igual que la mayoría de sus otras propiedades químicas.
El bromo actúa como un agente oxidante moderadamente fuerte y se oxida con cloro para producir bromo elemental de acuerdo con su posición en la serie electromotriz.
El bromo se reduce a bromuro en agua, siendo el agente reductor el agua o el bromo restante. En el primer caso se forma oxígeno, como lo muestra la ecuación:
2 Br2 + 2 H2O → 4 H+ + 4 Br– + O2 E0298 = +0,25 V
El bromo reacciona con el cianuro de hidrógeno para formar bromuro de cianógeno:
Br2 + HCN → BrCN + HBr
Los carbonatos reaccionan con el bromo, produciendo como resultado sales de bromuro y bromato:
3 Br2 + 3 Na2CO3 → 5 NaBr + NaBrO3 + 3 CO2
El bromo puede oxidar el dióxido de azufre a ácido sulfúrico, como lo demuestra la ecuación:
Br2 + SO2 + 2 H2O → 2HBr + H2SO4
El bromo reacciona con el fósforo rojo y otros compuestos de fósforo para producir ácido fosfórico y bromuro de hidrógeno, de la siguiente manera:
3 Br2 + 2 P + 6 H2O → 6 HBr + 2 H3PO3
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
H3PO3 + Br2 + NaOH → NaH2PO4
Los compuestos que contienen nitrógeno, por ejemplo amoniaco, hidracina, nitritos y azidas, también sufren oxidación por el bromo, siendo el nitrógeno elemental el producto frecuente de estas reacciones.
A temperaturas más altas, el bromo reacciona directamente con el hidrógeno para producir bromuro de hidrógeno, que es la base para la producción comercial de HBr utilizando catalizadores como carbón calentado y platino metálico finamente dividido.
El bromo reacciona con muchos metales para producir bromuros, y el sodio reacciona vigorosamente en presencia de vapor de sodio. El potasio y el cesio reaccionan violentamente con el bromo.
El aluminio y el titanio también son altamente reactivos con el bromo; el aluminio emite luz al reaccionar, mientras que el magnesio, la plata, el níquel y el plomo quedan recubiertos con sus bromuros, lo que impide una mayor reacción.
La capa protectora del plomo lo convierte en un material útil para contenedores que contienen bromo, al igual que el níquel, el tantalio, el Hastelloy C, el Monel y otras aleaciones de cobre.
La humedad es un factor clave en la corrosión de los metales por el bromo, probablemente debido a los productos de la hidrólisis, los ácidos bromhídrico e hipobromoso.
Con contenidos de humedad inferiores a 40 ppm, se pueden utilizar contenedores de níquel para transportar bromo, pero no se debe utilizar mercurio en instrumentos y medidores expuestos al vapor de bromo.
El bromo seco reacciona lentamente con el hierro para formar una capa protectora de bromuro férrico, pero cuando está húmedo se produce una mezcla de bromuros de hierro hidratados, que no se adhiere a la superficie del hierro.
Varios otros metales pesados, como cobre, manganeso, cromo, antimonio, cobalto, cadmio y bismuto, reaccionan con el bromo, y algunos metales requieren temperaturas más altas para que se produzca la reacción.
1.1. Brominación de alquenos y alquinos
El bromo es capaz de agregarse fácilmente a compuestos insaturados. Estas reacciones normalmente se llevan a cabo a bajas temperaturas para evitar reacciones secundarias de sustitución. Si bien normalmente no se requiere un catalizador, las altas temperaturas o la radiación ultravioleta pueden acelerar la reacción.
Se pueden obtener varios productos comerciales importantes mediante la bromación de compuestos insaturados, incluidos bromuro de etileno, tetrabromuro de acetileno, 2,3-dibromopropanol, hexabromociclodecano y tetrabromobisfenol A bis(2,3-dibromopropiléter).
1.2. Brominación de compuestos aromáticos
La bromación de compuestos aromáticos puede tener lugar mediante tres tipos de reacciones: (1) adición, (2) sustitución en las cadenas laterales y (3) sustitución en el anillo aromático.
La adición de bromo a través de dobles enlaces aromáticos suele ser una reacción lenta cuando está catalizada por la luz, pero el cloro puede aumentar la velocidad de reacción. La bromación de cadenas laterales aromáticas suele realizarse mediante una reacción de radicales libres.
La sustitución electrófila en el anillo aromático es el tipo más importante de bromación aromática. En presencia de un catalizador, el bromo puede reaccionar con compuestos aromáticos para producir bromuros de arilo y bromuro de hidrógeno mediante la siguiente reacción:
ArH + Br2 → ArBr + HBr
Los catalizadores adecuados para la bromación aromática incluyen ácidos de Lewis como haluros de aluminio, hierro, zinc o antimonio. Los compuestos aromáticos activados, como el fenol, la anilina y los éteres aromáticos, se pueden bromar sin el uso de un catalizador.
Por el contrario, los compuestos aromáticos muy fuertemente desactivados que contienen grupos aceptores de electrones pueden sufrir bromación en presencia de ácido sulfúrico con ácido nítrico.
El bromo generado a partir de bromuro de hidrógeno in situ se utiliza de manera más eficiente en reacciones de sustitución aromática:
ArH + HBr + Cl2 → ArBr + 2 HCl
Para este fin también se puede utilizar cloruro de bromo preformado. Las reacciones de sustitución que utilizan BrCl son generalmente mucho más rápidas que aquellas que utilizan bromo solo.
1.3. Brominación de radicales libres
El bromo reacciona fácilmente con hidrocarburos saturados y cadenas laterales alquílicas de compuestos aromáticos mediante un mecanismo de reacción en cadena que involucra radicales libres. La reacción se desarrolla a través de los siguientes pasos:
Br2 → 2 Br•
RH + Br• → R• + HBr
R• + Br2 → RBr + Br•
El inicio de la reacción requiere la disociación de las moléculas de bromo, lo que puede lograrse mediante iniciadores térmicos, fotolíticos o peróxido. En comparación con el cloro, el átomo de bromo es menos reactivo y el paso de extracción de hidrógeno es endotérmico, lo que da como resultado velocidades de reacción relativamente lentas.
Sin embargo, el átomo de bromo exhibe una alta selectividad de posición. Por ejemplo, en la bromación de n-butano, los átomos de hidrógeno secundarios se reemplazan 82 veces más rápido que los primarios. La bromación de las cadenas laterales aromáticas es mucho más rápida que la de los alcanos.
1.4. Producción de bromuro de hidrógeno
El bromuro de hidrógeno es un intermediario importante en la fabricación de una variedad de bromuros orgánicos e inorgánicos, incluidos productos medicinales, tintes, perfumes, productos químicos fotográficos y muchos otros compuestos químicos.
El método comercial común para preparar bromuro de hidrógeno implica la reacción directa en fase gaseosa de hidrógeno y bromo, que se puede lograr sin un catalizador manteniendo una llama autosostenida dentro de un quemador cerrado.
Br2 + H2 → 2 HBr + Calor
En el laboratorio, se puede generar bromuro de hidrógeno destilando una solución de bromuro de sodio o potasio con ácido fosfórico o sulfúrico diluido (5,8 M), pero ácido sulfúrico más concentrado o permitir que la temperatura de reacción supere los 75 °C no es eficaz ya que El HBr formado inicialmente se oxidará formando bromo gaseoso (Br2).
Alternativamente, se puede generar bromuro de hidrógeno mediante la reducción de bromo con ácido fosforoso:
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
1.5. Brominación utilizando portadores de bromo
Los complejos de bromo y las bromoimidas se utilizan en reacciones de bromación que requieren selectividad. La N-bromosuccinimida (NBS) es el portador de bromo más utilizado en las bromaciones de laboratorio.
NBS tiene una aplicación única en bromaciones alílicas de radicales libres:

Otros portadores eficaces de bromo para reacciones químicas incluyen dibromodimetilhidantoína, dibromuro de dioxano, dibromuro de hidrobromuro de piridina y varios tipos de polibromuros de amonio cuaternario.
2. Producción de bromo
El bromo se produce a partir de licores (salmueras) que contienen bromo de origen natural o de agua de mar, así como de la fabricación de sales de potasio.
Aislar bromo de estas fuentes es un desafío debido a la concentración molar significativamente mayor de iones cloruro en comparación con los iones bromuro en la mayoría de las salmueras y el agua del océano.
Se requiere un método de separación de alta selectividad para extraer bromo. Afortunadamente, existe un método basado en la mayor facilidad de oxidación del bromuro en comparación con el cloruro y la volatilidad del producto de oxidación, el bromo.
El cloro se utiliza como el oxidante más económico y conveniente.
Las cuatro etapas principales en la producción de bromo incluyen la oxidación del bromuro a bromo, la extracción del bromo de la solución acuosa, la separación del bromo del vapor y la purificación del bromo.
Comúnmente se emplean dos procesos generales que utilizan cloración para la recuperación de bromo, basados en la siguiente reacción química:
2 Br– + Cl2 → Br2 + 2 Cl–
- El primer proceso, el proceso de vaporización, se utiliza para salmueras y licores residuales que contienen bromo cuando la concentración de bromuro en la salmuera es superior a 1000 ppm. En este proceso se emplea vapor para condensar el bromo directamente del vapor.
- El segundo proceso, el proceso de soplado, se utiliza para agua de mar e implica el uso de aire debido a los grandes volúmenes de gas de extracción necesarios. Para concentrar el bromo es necesario atraparlo en una solución alcalina o reductora.
2.1. Proceso de vaporización
La producción de bromo a partir de salmueras que contienen concentraciones de Br-in de 1 a 5 g/L sigue un proceso descrito por primera vez por KUBIERSCHKY en 1906.
La salmuera cruda se calienta en un intercambiador de calor (a) y luego se pasa a través de dos torres empaquetadas (b), (c) mediante flujo por gravedad (Figura 1). En la torre superior, la salmuera se encuentra con una corriente reciclada de gases que absorben cloro y bromo.
Cerca del fondo de la torre inferior (c), se introducen cloro y vapor. A medida que ascienden, el cloro reacciona con el bromuro de la salmuera, produciendo una mezcla de vapor de bromo y cloro (aproximadamente 85:15 en peso) con el vapor que se extrae de la parte superior.
El agua y la mayoría de los halógenos se condensan (d), y las fases líquidas entran en un separador por gravedad (e), mientras que el gas pasa a la torre superior.
Desde el separador, el agua que contiene halógenos disueltos se envía a la torre inferior (de vaporización) y la capa de bromo más pesada, que contiene algo de cloro, fluye a una columna de fraccionamiento (g).
Los vapores de cloro se unen a la corriente hacia la torre superior, mientras que el bromo líquido, con una pureza aproximada del 99%, se extrae para uso directo en la fabricación de compuestos de bromo o para una mayor purificación.
La salmuera desbromada caliente se trata para neutralizar la acidez (h) y reducir los halógenos libres, si es necesario, y luego se pasa a través del intercambiador de calor, donde calienta la salmuera entrante.
Las modificaciones recientes del proceso original de Kubierschky están relacionadas con la mayor escala de las operaciones modernas, los materiales de construcción resistentes a la corrosión y los procedimientos e instrumentación necesarios para el control.
Los procesos se controlan midiendo puntos críticos como pH, potenciales de oxidación-reducción, caudales, temperaturas y presiones.
La acidez se genera cuando el cloro reacciona con sustancias reductoras, como el sulfuro de hidrógeno, en la salmuera. Esta acidez mejora la eficiencia de la liberación de bromo al prevenir la hidrólisis a ácido hipobromoso.
Sin embargo, no se recomienda el uso de ácido sulfúrico si la salmuera contiene calcio o estroncio porque pueden precipitar como sulfatos y ensuciar el empaque de la torre, las superficies de intercambio de calor o los pozos de eliminación de salmuera. Se formarán sulfatos si la salmuera contiene sulfuros.
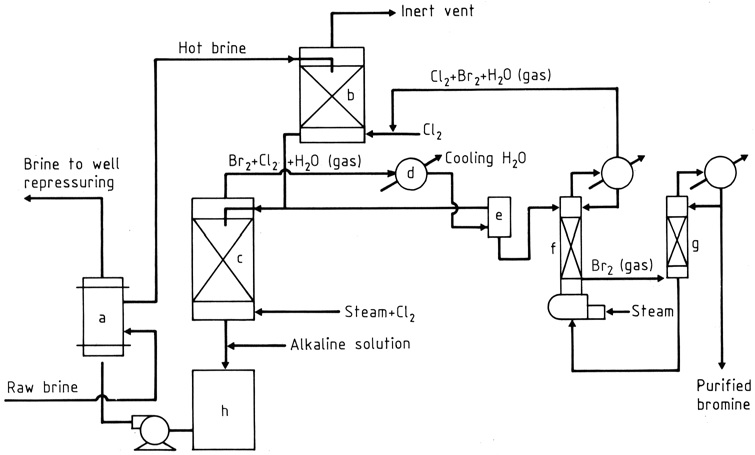
a) Intercambiador de calor cruzado de bromo; b) absorbente de cloro; c) Torre de vaporización; d) Condensador; e) Separador; f) Columna de decapado; g) columna de fraccionamiento; h) Neutralizador
2.2. Proceso de agua de mar
La extracción de bromo directamente del agua de mar, que condujo a su exitosa recuperación comercial, se logró por primera vez cerca de Wilmington, Carolina del Norte (EE.UU.). Esto se logró utilizando un método de soplado de aire que fue desarrollado inicialmente para el procesamiento de salmuera por H. H. DOW.
Se consideró necesario el uso de aire, en lugar de vapor, debido al alto costo del vapor, que sería necesario para calentar el agua del océano que contiene sólo alrededor de 65 mg/L de bromo. Cabe destacar que la planta de Wilmington ya no está operativa.
El agua de mar se bombea a la parte superior de las torres de soplado, y se agrega ácido sulfúrico y cloro justo encima de las bombas para garantizar una mezcla adecuada a medida que asciende.
Se necesita una cantidad de 1,3 kg de ácido sulfúrico al 10% por tonelada de agua para neutralizar los bicarbonatos naturales y llevar el pH a 3,5, y se utiliza un exceso de cloro del 15% sobre el requerimiento teórico.
El aire se aspira a través de las torres, lo que permite la extracción de una mezcla de bromo y cloro (o cloruro de bromo) del agua del océano que desciende. A continuación, el aire pasa a través de torres de absorción, donde se lava en contracorriente con una solución de carbonato de sodio.
Las diversas reacciones que ocurren se pueden resumir aproximadamente en la siguiente ecuación:
3 Na2CO3 + 2 Br2 + BrCl → NaBrO3 + 4 NaBr + NaCl + 3 CO2
Para eliminar las salpicaduras del aire, se instalan pequeñas cámaras empaquetadas entre las torres de absorción y los ventiladores.
Cuando la alcalinidad de la solución depuradora está casi agotada, la solución se transfiere a un tanque de almacenamiento y luego a un reactor, donde se trata con ácido sulfúrico y se vaporiza para liberar bromo. La reacción química se describe a continuación:
NaBrO3 + 5 NaBr + 3 H2SO4 → 3 Br2 + 3 Na2SO4 + 3 H2O
Se han utilizado otros métodos para extraer bromo, incluido el uso de electrólisis en la producción inicial en Alemania, que se empleó en lugar de cloro para oxidar los bromuros.
En Estados Unidos, se ha empleado un proceso de Kubierschky modificado para recuperar bromo como subproducto de los licores de producción de cloruro de potasio.
3. Usos del bromo
El bromo es un elemento versátil con una amplia gama de aplicaciones. Se utiliza ampliamente en la producción de retardantes de llama, fluidos de perforación, síntesis orgánica, productos farmacéuticos, biocidas para el tratamiento de agua y agricultura.
Además, se utiliza en la fabricación de tintes, repelentes de insectos, perfumes y materiales fotográficos.
Otras aplicaciones de los compuestos de bromo incluyen el control del mercurio y la fabricación de papel.
Los retardantes de llama bromados son una parte importante de los derivados del bromo. Desde principios de la década de 1990, su consumo ha aumentado sustancialmente y en 2013 representaron más de la mitad del consumo total de bromo.
Se utilizan en equipos industriales y domésticos como ordenadores, muebles, tableros, teléfonos móviles, televisores y textiles.
Las características de alta densidad de los compuestos de bromo se aplican beneficiosamente en fluidos hidráulicos, fluidos de medición, flotación de minerales y fluidos de perforación.
La industria de perforación de petróleo y gas utiliza bromuros de calcio, zinc y sodio para preparar fluidos de perforación, terminación, empacado y reparación de salmuera transparente y de alta densidad.
Un grupo importante y en expansión de biocidas bromados se utiliza para el tratamiento del agua, aunque el cloro controla la mayoría de los mercados de tratamiento del agua.
En general, tanto el segmento industrial como el de consumidores de la industria del tratamiento de agua están reemplazando cada vez más el cloro y los compuestos clorados por productos a base de bromo.
Los biocidas bromados también se prefieren a los biocidas clorados en diversas aplicaciones industriales debido a su mayor tolerancia a una amplia gama de niveles de pH, lo cual es una preocupación en las torres de enfriamiento y las aguas de proceso.
El bromo y sus compuestos se están utilizando para mitigar las emisiones de mercurio en las centrales eléctricas alimentadas con carbón.
Los compuestos de bromo inorgánicos, como el bromuro de calcio y el bromuro de sodio, se unen con el mercurio presente en los gases de combustión de las centrales eléctricas alimentadas con carbón, creando compuestos de mercurio que se capturan en depuradores, eliminando así hasta el 90% del mercurio liberado durante la combustión.
Referencias
- Bromine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_391.pub2
Bromine; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0218151310010311.a01.pub3