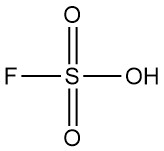
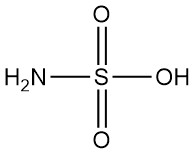
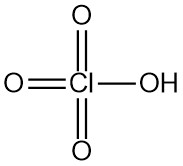
Brom ist eine Flüssigkeit mit hoher Dichte, dunkelroter Färbung und starken Raucheigenschaften, außerdem ist es stark ätzend und tränenfördernd. Der Geruch von Brom ist so stechend, dass er bereits in einer Menge von 1 ppm in der Luft wahrgenommen werden kann.
Die Farbe von Brom ist temperaturabhängig, mit gelb-orangen Farbtönen bei 20 K, die sich am Schmelzpunkt zu orange-rot, rotbraun und schließlich fast schwarz entwickeln. Flüssiges Brom behält einen dunkelroten Farbton bei, während seine Dämpfe im Allgemeinen orange bis rotbraun sind.
A. J. Balard entdeckte Brom im Jahr 1824, als er die Flora in einer Salzwiese in der Nähe von Montpellier, Frankreich, untersuchte. Während seiner Forschung beobachtete er eine Ablagerung von Natriumsulfat, die in einem Topf mit Mutterlauge aus Kochsalz kristallisiert war.
Bei der Untersuchung möglicher Verwendungsmöglichkeiten für die Ablaugen entdeckte BALARD, dass durch die Sättigung mit Chlor eine neue rote Flüssigkeit entstehen könnte, die destilliert werden konnte.
Inhaltsverzeichnis
1. Chemische Reaktionen von Brom
Die starken oxidierenden Eigenschaften von Brom sind für viele seiner chemischen Reaktionen verantwortlich. Die Elektronenaffinität von Brom liegt wie die meisten seiner anderen chemischen Eigenschaften zwischen denen von Chlor und Jod.
Brom wirkt als mäßig starkes Oxidationsmittel und wird durch Chlor oxidiert, um entsprechend seiner Stellung in der elektromotorischen Reihe elementares Brom zu erzeugen.
Brom wird in Wasser zu Bromid reduziert, wobei das Reduktionsmittel entweder das Wasser oder das restliche Brom ist. Im ersteren Fall entsteht Sauerstoff, wie die Gleichung zeigt:
2 Br2 + 2 H2O → 4 H+ + 4 Br– + O2 E0298 = +0,25 V
Brom reagiert mit Blausäure zu Bromcyan:
Br2 + HCN → BrCN + HBr
Carbonate reagieren mit Brom und erzeugen dabei Bromid- und Bromatsalze:
3 Br2 + 3 Na2CO3 → 5 NaBr + NaBrO3 + 3 CO2
Brom kann Schwefeldioxid zu Schwefelsäure oxidieren, wie die Gleichung zeigt:
Br2 + SO2 + 2 H2O → 2HBr + H2SO4
Brom reagiert mit rotem Phosphor und anderen Phosphorverbindungen unter Bildung von Phosphorsäure und Bromwasserstoff wie folgt:
3 Br2 + 2 P + 6 H2O → 6 HBr + 2 H3PO3
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
H3PO3 + Br2 + NaOH → NaH2PO4
Bei höheren Temperaturen reagiert Brom direkt mit Wasserstoff zu Bromwasserstoff, der die Grundlage für die kommerzielle Produktion von HBr unter Verwendung von Katalysatoren wie erhitzter Holzkohle und fein verteiltem Platinmetall bildet.
Brom reagiert mit vielen Metallen unter Bildung von Bromiden, wobei Natrium in Gegenwart von Natriumdampf heftig reagiert. Kalium und Cäsium reagieren heftig mit Brom.
Aluminium und Titan reagieren ebenfalls stark mit Brom, wobei Aluminium bei der Reaktion Licht emittiert, während Magnesium, Silber, Nickel und Blei mit ihren Bromiden überzogen werden und so eine weitere Reaktion verhindern.
Die schützende Beschichtung von Blei macht es zu einem nützlichen Material für Behälter zur Aufnahme von Brom, ebenso wie Nickel, Tantal, Hastelloy C und Monel und andere Kupferlegierungen.
Feuchtigkeit ist ein Schlüsselfaktor bei der Korrosion von Metallen durch Brom, wahrscheinlich aufgrund der Hydrolyseprodukte Bromwasserstoffsäure und hypobromige Säure.
Bei Feuchtigkeitsgehalten unter 40 ppm können Nickelbehälter zum Transport von Brom verwendet werden, Quecksilber sollte jedoch nicht in Instrumenten und Messgeräten verwendet werden, die Bromdampf ausgesetzt sind.
Trockenes Brom reagiert langsam mit Eisen und bildet eine Schutzschicht aus Eisenbromid. Im nassen Zustand entsteht jedoch eine Mischung aus hydratisierten Eisenbromiden, die nicht an der Eisenoberfläche haftet.
Mehrere andere Schwermetalle wie Kupfer, Mangan, Chrom, Antimon, Kobalt, Cadmium und Wismut reagieren mit Brom, wobei einige Metalle höhere Temperaturen benötigen, damit die Reaktion stattfindet.
1.1. Alken- und Alkinbromierung
Brom kann sich leicht an ungesättigte Verbindungen addieren. Diese Reaktionen werden typischerweise bei niedrigen Temperaturen durchgeführt, um Substitutionsnebenreaktionen zu verhindern. Während normalerweise kein Katalysator erforderlich ist, können hohe Temperaturen oder ultraviolette Strahlung die Reaktion beschleunigen.
Mehrere wichtige kommerzielle Produkte können durch Bromierung ungesättigter Verbindungen erhalten werden, darunter Ethylenbromid, Acetylentetrabromid, 2,3-Dibrompropanol, Hexabromcyclodecan und Tetrabrombisphenol-A-bis(2,3-dibrompropylether).
1.2. Bromierung aromatischer Verbindungen
Die Bromierung aromatischer Verbindungen kann durch drei Arten von Reaktionen erfolgen: (1) Addition, (2) Substitution an Seitenketten und (3) Substitution am aromatischen Ring.
Die Addition von Brom an aromatische Doppelbindungen ist typischerweise eine langsame Reaktion, wenn sie durch Licht katalysiert wird, Chlor kann jedoch die Reaktionsgeschwindigkeit erhöhen. Die Bromierung aromatischer Seitenketten erfolgt üblicherweise über eine radikalische Reaktion.
Die elektrophile Substitution am aromatischen Ring ist die bedeutendste Art der aromatischen Bromierung. In Gegenwart eines Katalysators kann Brom mit aromatischen Verbindungen reagieren und durch die folgende Reaktion Arylbromide und Bromwasserstoff erzeugen:
ArH + Br2 → ArBr + HBr
Geeignete Katalysatoren für die aromatische Bromierung sind Lewis-Säuren wie Halogenide von Aluminium, Eisen, Zink oder Antimon. Aktivierte aromatische Verbindungen wie Phenol, Anilin und aromatische Ether können ohne Verwendung eines Katalysators bromiert werden.
Umgekehrt können sehr stark desaktivierte aromatische Verbindungen, die elektronenziehende Gruppen enthalten, in Gegenwart von Schwefelsäure mit Salpetersäure eine Bromierung eingehen.
In situ aus Bromwasserstoff erzeugtes Brom wird in aromatischen Substitutionsreaktionen effizienter genutzt:
ArH + HBr + Cl2 → ArBr + 2 HCl
Zu diesem Zweck kann auch vorgefertigtes Bromchlorid verwendet werden. Substitutionsreaktionen mit BrCl laufen im Allgemeinen viel schneller ab als solche mit Brom allein.
1.3. Freiradikalische Bromierung
Brom reagiert leicht mit gesättigten Kohlenwasserstoffen und Alkylseitenketten aromatischer Verbindungen über einen Kettenreaktionsmechanismus, an dem freie Radikale beteiligt sind. Die Reaktion läuft über die folgenden Schritte ab:
Br2 → 2 Br•
RH + Br• → R• + HBr
R• + Br2 → RBr + Br•
Die Initiierung der Reaktion erfordert die Dissoziation von Brommolekülen, die durch thermische, photolytische oder Peroxidinitiatoren erreicht werden kann. Im Vergleich zu Chlor ist das Bromatom weniger reaktiv und der Wasserstoffabstraktionsschritt ist endotherm, was zu relativ langsamen Reaktionsgeschwindigkeiten führt.
Dennoch weist das Bromatom eine hohe Positionsselektivität auf. Beispielsweise werden bei der Bromierung von n-Butan sekundäre Wasserstoffatome 82-mal schneller ersetzt als primäre. Die Bromierung aromatischer Seitenketten verläuft viel schneller als die von Alkanen.
1.4. Herstellung von Bromwasserstoff
Bromwasserstoff ist ein wichtiges Zwischenprodukt bei der Herstellung einer Vielzahl organischer und anorganischer Bromide, darunter Arzneimittel, Farbstoffe, Parfüme, Fotochemikalien und viele andere chemische Verbindungen.
Die übliche kommerzielle Methode zur Herstellung von Bromwasserstoff beinhaltet die direkte Gasphasenreaktion von Wasserstoff und Brom, die ohne Katalysator durch die Aufrechterhaltung einer selbsterhaltenden Flamme in einem geschlossenen Brenner erreicht werden kann.
Br2 + H2 → 2 HBr + Heat
Im Labor kann Bromwasserstoff durch Destillation einer Lösung von Natrium- oder Kaliumbromid mit Phosphorsäure oder verdünnter Schwefelsäure (5,8 M) erzeugt werden. Konzentriertere Schwefelsäure oder ein Anstieg der Reaktionstemperatur auf über 75 °C sind jedoch nicht wirksam Das zunächst gebildete HBr oxidiert zu gasförmigem Brom (Br2).
Alternativ kann Bromwasserstoff durch Reduktion von Brom mit phosphoriger Säure erzeugt werden:
H3PO3 + Br2 + H2O → H3PO4 + 2 HBr
1.5. Bromierung mit Bromträgern
Bromkomplexe und Bromimide werden in Bromierungsreaktionen eingesetzt, die Selektivität erfordern. N-Bromsuccinimid (NBS) ist der am häufigsten verwendete Bromträger bei Bromierungen im Labor.
NBS hat eine einzigartige Anwendung bei radikalischen allylischen Bromierungen:

Andere wirksame Bromträger für chemische Reaktionen sind Dibromdimethylhydantoin, Dioxandibromid, Pyridinhydrobromiddibromid und verschiedene Arten quartärer Ammoniumpolybromide.
2. Herstellung von Brom
Brom wird aus natürlich vorkommenden bromhaltigen Laugen (Solen) oder aus Meerwasser sowie bei der Herstellung von Kaliumsalzen gewonnen.
Die Isolierung von Brom aus diesen Quellen ist aufgrund der deutlich höheren molaren Konzentration von Chloridionen im Vergleich zu Bromidionen in den meisten Salzlösungen und Meerwasser eine Herausforderung.
Um Brom zu extrahieren, ist eine Trennmethode mit hoher Selektivität erforderlich. Glücklicherweise gibt es eine Methode, die auf der einfacheren Oxidation von Bromid im Vergleich zu Chlorid und der Flüchtigkeit des Oxidationsprodukts Brom basiert.
Chlor wird als wirtschaftlichstes und praktischstes Oxidationsmittel verwendet.
Zu den vier Hauptstufen der Bromproduktion gehören die Oxidation von Bromid zu Brom, das Abtrennen von Brom aus der wässrigen Lösung, die Abtrennung von Brom aus dem Dampf und die Reinigung von Brom.
Üblicherweise werden zwei allgemeine Verfahren eingesetzt, bei denen die Chlorierung zur Bromrückgewinnung eingesetzt wird und die auf der folgenden chemischen Reaktion basieren:
2 Br– + Cl2 → Br2 + 2 Cl–
- Das erste Verfahren, das Ausdampfverfahren, wird bei bromhaltigen Solen und Ablaugen angewendet, wenn die Bromidkonzentration in der Sole über 1000 ppm liegt. Bei diesem Verfahren wird Dampf eingesetzt, um das Brom direkt aus dem Dampf zu kondensieren.
- Der zweite Prozess, der Ausblasprozess, kommt bei Meerwasser zum Einsatz und erfordert aufgrund der großen benötigten Strippgasmengen den Einsatz von Luft. Um das Brom zu konzentrieren, muss es in einer alkalischen oder reduzierenden Lösung eingefangen werden.
2.1. Ausdampfvorgang
Die Herstellung von Brom aus Solen, die Br-in-Konzentrationen von 1–5 g/L enthalten, folgt einem Verfahren, das erstmals 1906 von KUBIERSCHKY beschrieben wurde.
Die Rohsole wird in einem Wärmetauscher (a) erhitzt und dann durch Schwerkraftströmung durch zwei Füllkörpertürme (b) und (c) geleitet (Abbildung 1). Im oberen Turm trifft die Sole auf einen recycelten Gasstrom, der Chlor und Brom absorbiert.
Nahe dem Boden des unteren Turms (c) werden Chlor und Dampf eingeleitet. Während sie nach oben strömen, reagiert das Chlor mit dem Bromid in der Sole und erzeugt eine Mischung aus Bromdampf und Chlor (etwa 85:15 nach Gewicht), wobei der Dampf oben entnommen wird.
Das Wasser und die meisten Halogene werden kondensiert (d), und die flüssigen Phasen gelangen in einen Schwerkraftabscheider (e), während das Gas in den oberen Turm gelangt.
Vom Abscheider wird Wasser, das gelöste Halogene enthält, zum unteren (Ausdampf-)Turm geleitet, und die schwerere Bromschicht, die etwas Chlor enthält, fließt zu einer Fraktionierkolonne (g).
Die Chlordämpfe verbinden sich mit dem Strom zum oberen Turm, während das flüssige Brom mit einer Reinheit von etwa 99 % zur direkten Verwendung bei der Herstellung von Bromverbindungen oder zur weiteren Reinigung abgezogen wird.
Die heiße debromierte Sole wird behandelt, um den Säuregehalt (h) zu neutralisieren und bei Bedarf freie Halogene zu reduzieren, und dann durch den Wärmetauscher geleitet, wo sie die einströmende Sole erwärmt.
Jüngste Modifikationen des ursprünglichen Kubierschky-Verfahrens stehen im Zusammenhang mit dem größeren Umfang moderner Verfahren, korrosionsbeständigen Konstruktionsmaterialien sowie den für die Steuerung erforderlichen Verfahren und Instrumenten.
Die Prozesse werden durch die Messung kritischer Punkte wie pH-Wert, Oxidations-Reduktions-Potenzial, Durchflussraten, Temperaturen und Drücke gesteuert.
Säure entsteht, wenn Chlor mit reduzierenden Substanzen wie Schwefelwasserstoff in der Sole reagiert. Dieser Säuregehalt erhöht die Effizienz der Bromfreisetzung, indem er die Hydrolyse zu hypobromiger Säure verhindert.
Die Verwendung von Schwefelsäure wird jedoch nicht empfohlen, wenn die Sole Kalzium oder Strontium enthält, da diese als Sulfate ausfallen und die Turmpackung, Wärmetauscheroberflächen oder Soleentsorgungsbrunnen verunreinigen können. Wenn die Sole Sulfide enthält, entstehen Sulfate.
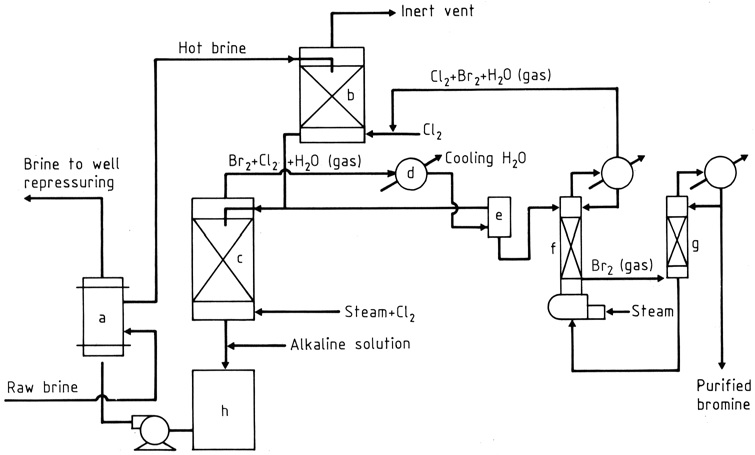
a) Brom-Kreuzwärmetauscher; b) Chlorabsorber; c) Ausdampfturm; d) Kondensator; e) Trennzeichen; f) Strippkolonne; g) Fraktionierungskolonne; h) Neutralisator
2.2. Meerwasserprozess
Die Gewinnung von Brom direkt aus Meerwasser, die zu einer erfolgreichen kommerziellen Gewinnung führte, wurde erstmals in der Nähe von Wilmington, North Carolina (USA) durchgeführt. Dies wurde mithilfe einer Luftblasmethode erreicht, die ursprünglich von H. H. DOW für die Soleverarbeitung entwickelt wurde.
Die Verwendung von Luft anstelle von Dampf wurde aufgrund der hohen Kosten für Dampf, der zum Erhitzen des Meerwassers erforderlich wäre, das nur etwa 65 mg/l Brom enthält, als notwendig erachtet. Bemerkenswert ist, dass das Werk in Wilmington nicht mehr in Betrieb ist.
Das Meerwasser wird an die Spitze von Ausblastürmen gepumpt, wobei die Zugabe von Schwefelsäure und Chlor direkt über den Pumpen erfolgt, um eine ordnungsgemäße Durchmischung beim Aufstieg zu gewährleisten.
Um die natürlichen Hydrogencarbonate zu neutralisieren und den pH-Wert auf 3,5 zu bringen, wird eine Menge von 1,3 kg 10 %iger Schwefelsäure pro Tonne Wasser benötigt, außerdem wird ein Überschuss von 15 % Chlor über den theoretischen Bedarf hinaus eingesetzt.
Durch die Türme wird Luft angesaugt, wodurch eine Mischung aus Brom und Chlor (oder Bromchlorid) aus dem absteigenden Meerwasser gewonnen werden kann. Anschließend wird die Luft durch Absorbertürme gesaugt, wo sie im Gegenstrom mit einer Natriumcarbonatlösung gereinigt wird.
Die verschiedenen auftretenden Reaktionen lassen sich grob durch die folgende Gleichung zusammenfassen:
3 Na2CO3 + 2 Br2 + BrCl → NaBrO3 + 4 NaBr + NaCl + 3 CO2
Um Sprühnebel aus der Luft zu entfernen, sind zwischen den Absorbertürmen und den Ventilatoren kleine Füllkörperkammern installiert.
Wenn die Alkalität der Wäscherlösung fast erschöpft ist, wird die Lösung in einen Lagertank und dann in einen Reaktor überführt, wo sie mit Schwefelsäure behandelt und ausgedampft wird, um Brom freizusetzen. Die chemische Reaktion wird wie folgt beschrieben:
NaBrO3 + 5 NaBr + 3 H2SO4 → 3 Br2 + 3 Na2SO4 + 3 H2O
Zur Gewinnung von Brom wurden auch andere Methoden eingesetzt, darunter die Elektrolyse in der frühen Produktion in Deutschland, die anstelle von Chlor zur Oxidation von Bromiden eingesetzt wurde.
In den Vereinigten Staaten wurde ein modifiziertes Kubierschky-Verfahren eingesetzt, um Brom als Nebenprodukt aus Kaliumchlorid-Produktionsflüssigkeiten zurückzugewinnen.
3. Verwendung von Brom
Brom ist ein vielseitiges Element mit einem breiten Anwendungsspektrum. Es wird in großem Umfang bei der Herstellung von Flammschutzmitteln, Bohrflüssigkeiten, organischer Synthese, Pharmazeutika, Bioziden für die Wasseraufbereitung und in der Landwirtschaft verwendet.
Darüber hinaus wird es bei der Herstellung von Farbstoffen, Insektenschutzmitteln, Parfüms und Fotomaterialien verwendet.
Weitere Anwendungen von Bromverbindungen umfassen die Quecksilberkontrolle und die Papierherstellung.
Ein wesentlicher Bestandteil der Bromderivate sind bromierte Flammschutzmittel. Seit Anfang der 1990er-Jahre ist ihr Verbrauch erheblich gestiegen und machte im Jahr 2013 mehr als die Hälfte des gesamten Bromverbrauchs aus.
Sie werden in Industrie- und Haushaltsgeräten wie Computern, Möbeln, Tafeln, Mobiltelefonen, Fernsehern und Textilien verwendet.
Die hohen Dichteeigenschaften von Bromverbindungen werden vorteilhaft in Hydraulikflüssigkeiten, Messflüssigkeiten, Erzflotationen und Bohrflüssigkeiten eingesetzt.
Calcium-, Zink- und Natriumbromide werden von der Öl- und Gasbohrindustrie zur Herstellung hochdichter, klarer Sole-Bohr-, Komplettierungs-, Packer- und Workover-Flüssigkeiten verwendet.
Eine bedeutende und wachsende Gruppe bromierter Biozide dient der Wasseraufbereitung, obwohl Chlor den Großteil der Wasseraufbereitungsmärkte kontrolliert.
Im Allgemeinen ersetzen sowohl Industrie- als auch Verbrauchersegmente der Wasseraufbereitungsindustrie Chlor und chlorierte Verbindungen zunehmend durch Produkte auf Brombasis.
Bromierte Biozide werden in verschiedenen industriellen Anwendungen auch gegenüber chlorierten Bioziden bevorzugt, da sie eine höhere Toleranz gegenüber einem breiten pH-Wert-Bereich aufweisen, was in Kühltürmen und Prozesswässern ein Problem darstellt.
Brom und seine Verbindungen werden zur Minderung der Quecksilberemissionen in Kohlekraftwerken eingesetzt.
Anorganische Bromverbindungen wie Calciumbromid und Natriumbromid verbinden sich mit Quecksilber in Rauchgasen von Kohlekraftwerken und bilden Quecksilberverbindungen, die in Wäschern aufgefangen werden und so bis zu 90 % des bei der Verbrennung freigesetzten Quecksilbers entfernen.
Verweise
- Bromine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_391.pub2
- Bromine; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0218151310010311.a01.pub3