
El benzaldehído es el aldehído aromático más importante, tanto en la naturaleza como en la industria. Se encuentra en muchas plantas, tanto ligadas como sueltas. Una fuente natural importante de benzaldehído es la amigdalina, un glucósido que se encuentra en las almendras amargas.
La distintiva fragancia de almendras se debe a pequeñas cantidades de benzaldehído libre, que se produce cuando se hidroliza la amígdala. El benzaldehído es también el componente principal de los aceites esenciales extraídos de las semillas de melocotones, cerezas y albaricoques.
En 1818 y 1819, VOGEL y MATRÈS informaron de forma independiente sobre la extracción de un aceite volátil de almendras amargas, junto con ácido cianhídrico. En 1832, WÖHLER y LIEBIG realizaron un estudio exhaustivo de este aceite y determinaron su composición química y su relación con el ácido benzoico y el cloruro de benzoílo.
Tabla de contenido
1. Propiedades físicas del benzaldehído
El benzaldehído (C7H6O) es un líquido incoloro, altamente refractivo y volátil en presencia de vapor. Es miscible con numerosos disolventes orgánicos y se puede mezclar con ácido sulfúrico concentrado, dióxido de carbono líquido, amoníaco líquido, metilamina y dietilamina a 25 °C.
Aquí hay un resumen de las propiedades físicas del benzaldehído:
| Propiedad | Valor |
|---|---|
| Peso molecular | 106,13 g/mol |
| Color | Incoloro |
| Olor | Almendras amargas |
| Estado físico | Líquido |
| Punto de ebullición | 179 °C a 101,3 kPa |
| Punto de fusión | -56 °C |
| Índice de refracción (20 °C) | 1,5450 |
| Densidad | 1,063 g/cm³ a 0 °C, 1,046 g/cm³ a 20 °C, 1,018 g/cm³ a 50 °C |
| Capacidad calorífica específica | 1,676 J g⁻¹ K⁻¹ a 25 °C |
| Calor de evaporación | 371,0 J/g a 179 °C |
| Calor de combustión estándar | 33,19 kJ/g |
| Punto de inflamación | 64,5 °C |
| Temperatura de autoignición | 190°C |
| Límite explosivo inferior | 1,4% vol. |
| Viscosidad dinámica (η) | 1,40 x 10⁻³ Pa·s a 25 °C
1,11 x 10⁻³ Pa·s a 40 °C |
| Tensión(es) superficial(es) | 40,04 x 10⁻³ N/m a 20 °C |
| Momento dipolar (m) | 2,92 D (9,74 x 10⁻³⁰ C m) en benceno líquido |
| Constante dieléctrica (εr) | 17,7 a 25 °C |
2. Reacciones químicas del benzaldehído
El benzaldehído y sus derivados tienen un comportamiento químico similar al de los aldehídos alifáticos, pero su reactividad se reduce debido a la resonancia de los electrones p del grupo carbonilo con el anillo aromático.
Esta propiedad única permite que el benzaldehído forme diversos compuestos, como bases de Schiff con aminas, oximas con hidroxilamina, hidrazonas con fenilhidrazina y acetales con alcoholes. También reacciona con cianuro de hidrógeno, bisulfito de sodio y compuestos de Grignard.
Una síntesis notable de benzaldehído es la reacción de Strecker, que utiliza amoníaco y cianuro de hidrógeno para formar un intermedio aminonitrilo que puede saponificarse para producir DL-2-fenilglicina.
El benzaldehído también puede autooxidarse en el aire para formar ácido benzoico. Este proceso se ve afectado por la luz y puede acelerarse con peróxidos o sales de metales pesados, pero ralentizarse con antioxidantes como los compuestos fenólicos y la difenilamina. El benzaldehído también se puede oxidar a ácido benzoico mediante agentes como el ácido nítrico y el óxido de cromo (VI).
La reducción o hidrogenación del benzaldehído en diferentes condiciones da como resultado diversos productos, incluidos alcohol bencílico, éter dibencílico, benzoína, 1,2-difeniletano-1,2-diol, estilbeno, tolueno y metilciclohexano. La hidrogenación catalítica, que se utiliza industrialmente, produce alcohol bencílico.
La reducción con alcoholatos de aluminio (reducción de Meerwein-Ponndorf-Verley) es otro método para obtener alcohol bencílico, y este proceso también puede reducir aldehídos insaturados, como el cinamaldehído, conservando dobles enlaces olefínicos.
El benzaldehído reacciona con amoníaco e hidrógeno en presencia de catalizadores de hidrogenación para producir bencilamina, que tiene importantes aplicaciones industriales. La cloración de cadena lateral de benzaldehído da como resultado la formación de cloruro de benzoílo.
Al igual que los aldehídos alifáticos, el benzaldehído también participa en reacciones de condensación con diversos compuestos orgánicos que contienen átomos de hidrógeno activos. Algunas de estas reacciones se utilizan en la industria. Por ejemplo, la condensación de Claisen-Schmidt con acetaldehído y álcali acuoso produce cinamaldehído.

La condensación Perkin con anhídrido acético en presencia de agentes condensantes específicos conduce a la producción industrial de ácido cinámico.

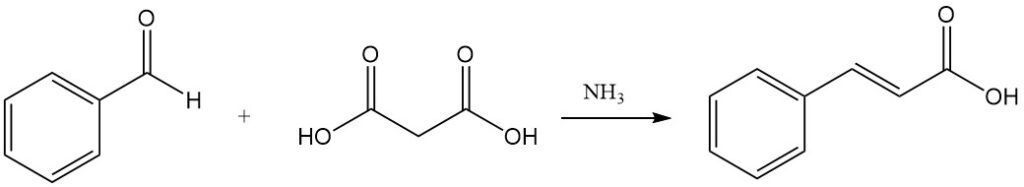
La condensación de Knoevenagel con ácido malónico, catalizada por sustancias débilmente básicas como amoníaco y aminas, es otra ruta hacia el ácido cinámico.
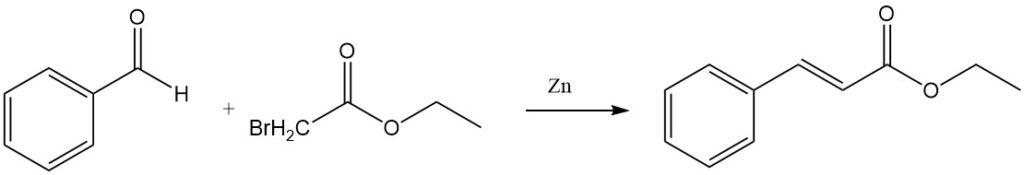
La reacción de Reformatsky de benzaldehído y bromoacetato de etilo en presencia de zinc activado produce cinamato de etilo.
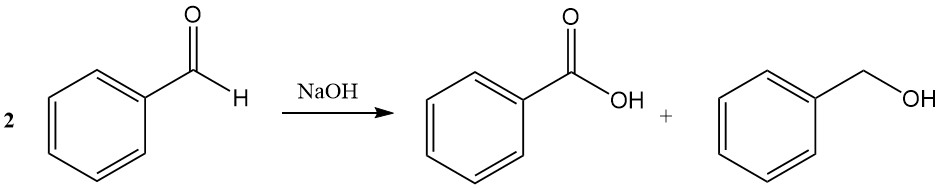
La reacción de Cannizzaro del benzaldehído conduce a la formación de ácido benzoico y alcohol bencílico en presencia de hidróxido de sodio concentrado o hidróxido de potasio.
La condensación de Claisen-Tishchenko de benzaldehído es catalizada por bencilato de sodio y aluminio para formar benzoato de bencilo.
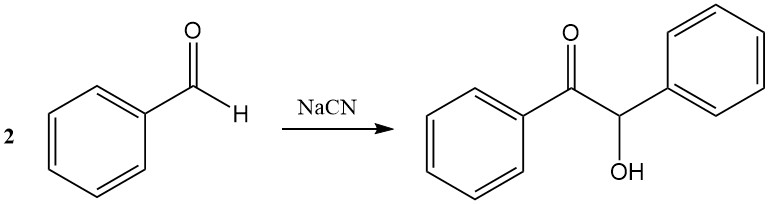
En la condensación de benjuí, dos moléculas de benzaldehído se combinan en presencia de cianuro para formar benjuí. Las sales de tiazolio pueden sustituir al cianuro como catalizadores.
El benzaldehído reacciona de manera diferente con el amoníaco que con los aldehídos alifáticos; la reacción continúa hasta la formación de 1-fenil-N,N’-bis(fenilmetileno)-metanodiamina (hidrobenzamida).

El benzaldehído tratado con la solución de Fehling forma alcohol bencílico y ácido benzoico, pero no óxido de cobre (I). Los aldehídos aromáticos no polimerizan ni forman compuestos cíclicos como los aldehídos alifáticos.
El benzaldehído se condensa con fenoles, aminas aromáticas y benceno para formar derivados de trifenilmetano. Esta reacción se utiliza industrialmente para fabricar tintes Verde Malaquita.
La sustitución electrófila del núcleo aromático en benzaldehído y otros aldehídos aromáticos, como cloración, nitración y sulfonación, ocurre principalmente en la posición meta.
3. Producción de benzaldehído
El benzaldehído se produce principalmente hidrolizando cloruro de benzal u oxidando parcialmente tolueno. Existen otros procesos de fabricación, pero actualmente no tienen importancia industrial.
3.1. Hidrólisis del cloruro de benzal
El benzaldehído se produce hidrolizando el cloruro de benzal, un compuesto que se obtiene fácilmente clorando tolueno. Esta hidrólisis se puede realizar en condiciones alcalinas o ácidas.

Hidrólisis alcalina:
El cloruro de benzal se puede saponificar con varios agentes alcalinos, como hidróxido de calcio, carbonato de calcio, hidrogenocarbonato de sodio o carbonato de sodio. El carbonato de sodio es el agente preferido porque minimiza las reacciones secundarias.
En un proceso más antiguo, el cloruro de benzal se saponifica con un ligero exceso de una solución de carbonato de sodio al 15% a 138 °C. El reactor está hecho de materiales específicos, como un recipiente agitador de acero al carbono revestido con Heresite (una resina fenólica) y un agitador de aleación de cobre y silicio.
Este proceso minimiza el contenido de cloro del producto destilado a menos del 0,01%. También se puede hidrolizar una mezcla de cloruro de benzal y benzotricloruro, comúnmente obtenida en la cloración de cadena lateral de tolueno. En este proceso, el benzotricloruro se convierte en benzoato de sodio y posteriormente en ácido benzoico.
En un proceso continuo más reciente, el cloruro de benzal y el agente saponificante alcalino se hacen reaccionar en un reactor de flujo utilizando un disolvente orgánico no reactivo. Luego, el benzaldehído extraído se separa de la fase alcalina acuosa haciendo fluir un disolvente orgánico no reactivo en la dirección opuesta. Este proceso continuo integra el reactor, la zona de extracción y la zona de lavado en un solo aparato.
Alternativamente, el cloruro de benzal se puede convertir en benzaldehído hirviéndolo con una solución acuosa de hexametilentetramina. La reacción de Sommelet también se puede utilizar para producir benzaldehído a partir de mezclas industriales de cloruro de bencilo y cloruro de benzal.
Hidrólisis ácida:
El cloruro de benzal también se puede hidrolizar en condiciones ácidas, utilizando ácidos y sales metálicas como catalizadores. Esto produce altos rendimientos de benzaldehído (más del 90%) y cloruro de hidrógeno, que se puede recuperar como ácido clorhídrico concentrado.
En el pasado, esta hidrólisis se realizaba a menudo en presencia de ácido sulfúrico concentrado, lo que daba como resultado la formación de grandes cantidades de ácido sulfúrico diluido como residuo. Este método es adecuado para la hidrólisis de ciertos benzaldehídos sustituidos que son difíciles de saponificar por otros medios.
Las sales metálicas, en particular las sales de hierro o zinc, también pueden catalizar la hidrólisis del cloruro de benzal. Es importante evitar la acumulación de agua en la mezcla de reacción, ya que puede reducir la actividad del catalizador.
El proceso se puede llevar a cabo utilizando varios catalizadores, como fosfato de zinc, laurato de zinc, cloruros de estaño, cloruro de cobre (II) y más. La reacción se puede realizar de forma discontinua o de forma continua en una cascada de reactores.
Hidrólisis en fase de vapor:
Un proceso continuo innovador implica la hidrólisis en fase de vapor de cloruro de benzal a temperaturas elevadas, catalizada por carbón activado tratado con ácido o impregnado con cloruro o sulfato metálico. Este proceso produce un alto rendimiento de benzaldehído del 97%.
Este método es particularmente adecuado para hidrolizar cloruros de benzal sustituidos con trifluorometilo, que de otro modo serían difíciles de convertir en los correspondientes benzaldehídos. Un proceso similar en fase de vapor implica hidrolizar cloruro de benzal a benzaldehído a 300 °C utilizando un catalizador como dióxido de silicio u óxido de aluminio.
3.2. Oxidación del tolueno
El benzaldehído se puede producir a partir de tolueno mediante oxidación parcial, que se puede realizar en fase gaseosa o líquida. Las condiciones deben controlarse cuidadosamente para favorecer la oxidación parcial, ya que el benzaldehído puede oxidarse aún más a ácido benzoico y otros productos.

Oxidación en fase gaseosa
En el proceso en fase gaseosa, el vapor de tolueno y el oxígeno pasan a través de un lecho de catalizador a altas temperaturas (250-650 °C). La reacción es muy caliente, por lo que es importante enfriarla de manera efectiva.
Para mejorar el rendimiento de benzaldehído, es útil diluir el vapor de tolueno y el oxígeno con un gas inerte, como vapor de agua, nitrógeno o dióxido de carbono.
Las mejores condiciones incluyen tasas de conversión bajas (10-20 % por pasada), tiempos de residencia cortos (0,1-1,0 segundos) y un control preciso de la cantidad de oxígeno. Incluso en estas condiciones, el rendimiento suele ser sólo del 40-60 % del rendimiento teórico basado en tolueno.
Esta oxidación del tolueno en fase gaseosa también produce otros compuestos, como anhídrido maleico, anhídrido citracónico, anhídrido ftálico, antraquinona, cresol, ácido acético y cantidades significativas de ácido benzoico, monóxido de carbono y dióxido de carbono. Agregar sulfato de potasio o fluoruro de sodio al catalizador o usar alta presión puede reducir la combustión completa.
Para la oxidación en fase gaseosa se utilizan a menudo varios catalizadores de óxido, que normalmente contienen molibdeno y otros elementos como hierro, níquel, cobalto, antimonio, bismuto, vanadio, fósforo, samario, tantalio, estaño y cromo.
Algunos catalizadores combinan paladio y ácido fosfórico sobre carbón activado, mientras que otros consisten en óxidos mixtos de plata y metales de transición. Otro proceso utiliza un catalizador de óxido mixto con uranio, cobre, hierro, fósforo, telurio y plomo además de molibdeno.
Oxidación en fase líquida
La oxidación en fase líquida de tolueno con oxígeno también es un método común. Esto suele hacerse en presencia de catalizadores como compuestos de cobalto, níquel, manganeso, hierro o cromo. También se han utilizado compuestos de plomo, compuestos de rutenio, sales de talio de ácidos orgánicos y diversos promotores, pero pueden provocar corrosión.
La formación de benzaldehído en la fase líquida también puede implicar oxidación con otros agentes como metanol, acetaldehído, ácido benzoico, ácido acético o la adición de agua.
La destilación se usa comúnmente para purificar el benzaldehído crudo obtenido de estos procesos, con pasos de purificación adicionales si es necesario para eliminar las impurezas que decoloran el producto.
Subproducto benzaldehído
En los procesos a gran escala para la producción de caprolactama y fenol, a menudo se producen cantidades importantes de benzaldehído como subproducto. Como resultado, los procesos de oxidación dedicados a la producción exclusiva de benzaldehído se utilizan con menos frecuencia en entornos industriales.
Estas corrientes de subproductos de benzaldehído normalmente se procesan para obtener benzaldehído puro. Es importante señalar que incluso cuando se produce benzaldehído como producto principal mediante oxidación catalítica en fase líquida, se pueden formar cantidades significativas de ácido benzoico y otros subproductos.
El benzaldehído bruto se refina normalmente mediante destilación a presión reducida en una columna de acero inoxidable.
Otros procesos de oxidación
Los procesos que implican oxidar tolueno con agentes como dióxido de manganeso en ácido sulfúrico, persulfato de sodio, óxido de cromo (VI) en anhídrido acético o cloruro de cromilo generalmente no son de importancia industrial debido a problemas de eliminación de aguas residuales.
3.3. Otros procesos de producción
Hay otras formas de producir benzaldehído, pero no se utilizan tan ampliamente como los métodos más comunes.
- Reacción de benceno y monóxido de carbono: El benzaldehído se puede producir haciendo reaccionar benceno con monóxido de carbono. Sin embargo, este método no se utiliza habitualmente en la industria.
- Oxidación o deshidrogenación del alcohol bencílico: el benzaldehído también se puede producir oxidando o deshidrogenando el alcohol bencílico. Este método es posible, pero no es la forma principal de producir benzaldehído a gran escala.
- Oxidación de estireno catalizada por rutenio con peryodato o hipoclorito: El benzaldehído se puede producir usando rutenio para catalizar la oxidación de estireno con peryodato o hipoclorito. Este método no se utiliza comúnmente en la industria para producir benzaldehído.
- Hidrólisis de mezclas de cloruro de bencilo y cloruro de benzal: El benzaldehído se puede preparar hidrolizando mezclas de cloruro de bencilo y cloruro de benzal en ácido nítrico diluido, usando pentóxido de vanadio como catalizador. Sin embargo, esta no es la forma principal de producir benzaldehído en la industria.
- Reducción de cloruro de benzoílo o benzoato de metilo: El benzaldehído también se puede obtener reduciendo el cloruro de benzoílo o el benzoato de metilo. Estos métodos generalmente no tienen importancia industrial para la producción de benzaldehído y es más probable que se utilicen en la síntesis de derivados nucleares sustituidos específicos.
En resumen, estos otros métodos para la producción de benzaldehído no se utilizan habitualmente en la industria. Los métodos descritos anteriormente son los enfoques principales para su fabricación a gran escala.
4. Usos del benzaldehído
El benzaldehído es una sustancia química versátil e importante con una amplia gama de aplicaciones. Se utiliza para producir una variedad de olores y sabores, incluidos los que se encuentran en el aceite de almendras amargas naturales, perfumes, jabones, alimentos y bebidas.
El benzaldehído se utiliza para producir derivados que se utilizan en las industrias de perfumes y sabores, como cinamaldehído, alcohol cinamílico, ácido cinámico y benzoato de bencilo.
El benzaldehído también se utiliza para producir tintes de trifenilmetano, como la base leuco del verde malaquita y el tinte de acridina benzoflavina.
En la industria farmacéutica, el benzaldehído se utiliza como intermediario en la fabricación de cloranfenicol, efedrina, ampicilina, difenilhidantoína y otros productos.
Otros intermedios químicos importantes obtenidos del benzaldehído incluyen benzoína, bencilamina, alcohol bencílico, ácido mandélico y 4-fenil-3-buten-2-ona (bencilidenacetona).
El benzaldehído también se utiliza en fotoquímica, como inhibidor de la corrosión y auxiliar de teñido, en la industria de galvanoplastia y en la producción de productos químicos agrícolas.
5. Toxicología del benzaldehído
El benzaldehído se utiliza en alimentos, cosméticos, productos farmacéuticos y jabones como agente aromatizante y aromático. Generalmente es seguro para estos usos. El benzaldehído también tiene aplicaciones industriales y agrícolas.
El benzaldehído tiene una toxicidad aguda moderada. La LD50 oral (dosis que mata al 50% de la población de prueba) es de 1,3 g/kg en ratas y 1 g/kg en cobayas. La dosis letal probable estimada para un ser humano de 70 kg es de 50 ml. La administración oral subcrónica a roedores no mostró efectos adversos a dosis diarias de 400 mg/kg en ratas y de 300 a 600 mg/kg en ratones.
Sin embargo, dosis más altas causaron daños al cerebro, los riñones y el estómago. Las pruebas de mutagenicidad fueron negativas. No se han informado estudios sobre los efectos cancerígenos, teratogénicos o reproductivos del benzaldehído.
Los efectos tóxicos del benzaldehído incluyen depresión, inactividad, temblores, convulsiones y coma. La muerte puede resultar de la depresión respiratoria. El benzaldehído tiene un efecto anestésico local débil y irrita levemente los ojos y el tracto respiratorio superior. La irritación de la piel es moderada y algunas personas pueden desarrollar una reacción alérgica.
Para minimizar los riesgos, evite el contacto con benzaldehído. Si es necesario el contacto, use guantes y ropa protectora. En áreas mal ventiladas, utilice aparatos de respiración autónomos para evitar la exposición por inhalación.
Referencia
- Benzaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_463.pub2


