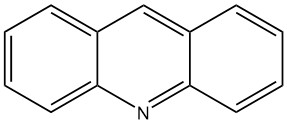
La acridina, con la fórmula molecular C13H9N, fue descubierta por primera vez en 1870 por C. GRAEBE y H. CARO en aceite de antraceno de alquitrán de hulla. Posteriormente, C. RIEDEL, A. BERNTHSEN y F. BENDER lo identificaron como dibenzopiridina en 1883.
Tabla de contenido
1. Propiedades físicas de la acridina
La acridina tiene una masa molar de 179,22 g/mol, un punto de fusión de 110 °C y un punto de ebullición de 345 °C (a presión atmosférica estándar).
A 20°C, su densidad es 1,1005 g/cm3. Existe en forma de cristales incoloros con forma de aguja o prisma y puede evaporarse cuando se expone al vapor.
La acridina es ligeramente soluble en agua hirviendo pero se disuelve fácilmente en varios disolventes orgánicos como etanol, éter, disulfuro de carbono y benceno. Sus soluciones presentan una fluorescencia azul.
2. Reacciones químicas de la acridina
La acridina actúa como una base terciaria débil. Forma sales cristalinas amarillas cuando reacciona con ácidos fuertes, que se descomponen fácilmente en agua hirviendo.
La acridina permanece estable cuando se calienta con álcali concentrado o ácido clorhídrico.
La nitración con ácido nítrico produce principalmente 2 y 4-nitroacridina, con pequeñas cantidades de dinitroacridinas.
La reducción de acridina da como resultado la formación de acridina (9,10-dihidroacridina) como producto preferido.
Dependiendo del agente oxidante utilizado, la oxidación de la acridina conduce a la formación de ácido acridínico (ácido quinolin-2,3-dicarboxílico) o acridona.
La acridina también puede formar sales de acridinio cuaternarias cuando reacciona con haluros y sulfatos de alquilo o arilo.
3. Producción de acridina
La acridina se puede aislar del aceite de antraceno de alquitrán de hulla, que hierve entre 300 y 360 °C, extrayéndolo con ácido sulfúrico diluido o bisulfito de sodio acuoso. El sulfonato de acridona de sodio se forma como una sal, que luego se puede descomponer usando soda cáustica para obtener la base libre de acridina.
Alternativamente, la acridina se puede sintetizar reduciendo acridona o 9-cloroacridina.

La acridona, que aparece como agujas de color amarillo pálido, con un punto de fusión de 354°C, se obtiene mediante la ciclación del ácido difenilamina-2-carboxílico (ácido fenilantranílico). Este último se sintetiza a partir de anilina y ácido 2-clorobenzoico.
La 9-cloroacridina, cristales casi incoloros con un punto de fusión de 120°C, se puede producir haciendo reaccionar cloruro de fosforilo con ácido difenilamina-2-carboxílico.
4. Aplicaciones de la acridina
Aunque la acridina en sí misma carece de importancia comercial significativa, la literatura de patentes sugiere varias aplicaciones para ella.
Se ha propuesto como antioxidante, inhibidor de la polimerización y corrosión, aditivo para agentes vulcanizantes peroxídicos para caucho de etileno-propileno y estabilizador térmico para poliolefinas.
La acridina también se utiliza como reactivo para pruebas de sangre oculta, incorporándose en tiras de papel para dichas pruebas. Los colorantes de acridina, sin embargo, se derivan de diferentes materiales de partida.
5. Toxicología de la acridina
Los estudios en animales indican que la acridina presenta una ligera toxicidad, con un valor LD50 de aproximadamente 2000 mg/kg (administración oral en ratas).
Las observaciones industriales demuestran que la exposición al polvo o vapor de acridina puede causar fuertes irritaciones en la piel y las membranas mucosas, lo que provoca síntomas como estornudos, picazón y potencialmente inflamación de la piel.
Se ha descubierto que ciertos derivados de acridina causan sensibilización de la piel, particularmente cuando se exponen a la luz. No se han especificado límites de exposición específicos en el lugar de trabajo (MAK, TLV) y actualmente no hay información disponible sobre la intoxicación por reabsorción causada por la acridina.
Referencia
- Acridine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_147
Preguntas más frecuentes
La acridina es un compuesto orgánico con la fórmula molecular C13H9N. Fue descubierto por primera vez en aceite de antraceno de alquitrán de hulla en 1870.
La acridina se puede separar del aceite de antraceno de alquitrán de hulla mediante extracción con ácido sulfúrico diluido o bisulfito de sodio acuoso. El compuesto aislado se procesa adicionalmente para obtener la base libre de acridina. Alternativamente, se puede sintetizar reduciendo acridona o 9-cloroacridina.
La acridina en sí no tiene importancia comercial significativa. Sin embargo, se propone como antioxidante, inhibidor de la polimerización y corrosión, y aditivo de agentes vulcanizantes para caucho. También se utiliza como estabilizador térmico de poliolefinas y como reactivo en análisis de sangre oculta. Los colorantes de acridina se producen a partir de otros materiales de partida.
La acridina presenta una ligera toxicidad. Los estudios en animales han demostrado que el valor LD50 (administración oral en ratas) es de aproximadamente 2000 mg/kg. La exposición al polvo o vapor de acridina puede causar irritaciones de la piel y las membranas mucosas, incluidos estornudos, picazón y potencialmente inflamación de la piel.