
Benzaldehyd ist der wichtigste aromatische Aldehyd, sowohl in der Natur als auch in der Industrie. Es kommt in vielen Pflanzen vor, sowohl gebunden als auch ungebunden. Eine wichtige natürliche Quelle für Benzaldehyd ist Amygdalin, ein Glykosid, das in Bittermandeln vorkommt.
Der charakteristische Mandelduft ist auf geringe Mengen freien Benzaldehyds zurückzuführen, der bei der Hydrolyse von Amygdalin entsteht. Benzaldehyd ist auch der Hauptbestandteil der ätherischen Öle, die aus den Kernen von Pfirsichen, Kirschen und Aprikosen gewonnen werden.
1818 und 1819 berichteten VOGEL und MATRÈS unabhängig voneinander über die Gewinnung eines ätherischen Öls aus Bittermandeln zusammen mit Blausäure. Im Jahr 1832 führten WÖHLER und LIEBIG eine umfassende Untersuchung dieses Öls durch und ermittelten seine chemische Zusammensetzung und Beziehung zu Benzoesäure und Benzoylchlorid.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Benzaldehyd
Benzaldehyd (C7H6O) ist eine farblose, stark brechende Flüssigkeit, die in Gegenwart von Dampf flüchtig ist. Es ist mit zahlreichen organischen Lösungsmitteln mischbar und kann bei 25 °C mit konzentrierter Schwefelsäure, flüssigem Kohlendioxid, flüssigem Ammoniak, Methylamin und Diethylamin gemischt werden.
Hier ist eine Zusammenfassung der physikalischen Eigenschaften von Benzaldehyd:
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht | 106,13 g/mol |
| Farbe | Farblos |
| Geruch | Bittere Mandeln |
| Physischer Zustand | Flüssigkeit |
| Siedepunkt | 179 °C bei 101,3 kPa |
| Schmelzpunkt | -56 °C |
| Brechungsindex (n20D) | 1,5450 |
| Dichte | 1,063 g/cm³ bei 0 °C, 1,046 g/cm³ bei 20 °C, 1,018 g/cm³ bei 50 °C |
| Spezifische Wärmekapazität | 1,676 J g⁻¹ K⁻¹ bei 25 °C |
| Verdampfungswärme | 371,0 J/g bei 179 °C |
| Standardverbrennungswärme | 33,19 kJ/g |
| Flammpunkt | 64,5 °C |
| Selbstentzündungstemperatur | 190 °C |
| Untere Explosionsgrenze | 1,4 Vol.-% |
| Dynamische Viskosität (η) | 1,40 x 10⁻³ Pa · s bei 25 °C
1,11 x 10⁻³ Pa · s bei 40 °C |
| Oberflächenspannung(en) | 40,04 x 10⁻³ N/m bei 20 °C |
| Dipolmoment (m) | 2,92 D (9,74 x 10⁻³⁰ C m) in flüssigem Benzol |
| Dielektrizitätskonstante (εr) | 17,7 bei 25 °C |
2. Chemische Reaktionen von Benzaldehyd
Benzaldehyd und seine Derivate haben ein ähnliches chemisches Verhalten wie aliphatische Aldehyde, ihre Reaktivität ist jedoch aufgrund der Resonanz der p-Elektronen der Carbonylgruppe mit dem aromatischen Ring verringert.
Diese einzigartige Eigenschaft ermöglicht es Benzaldehyd, verschiedene Verbindungen zu bilden, wie z. B. Schiffsche Basen mit Aminen, Oxime mit Hydroxylamin, Hydrazone mit Phenylhydrazin und Acetale mit Alkoholen. Es reagiert auch mit Blausäure, Natriumbisulfit und Grignard-Verbindungen.
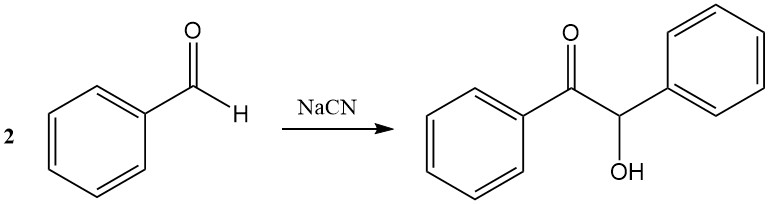
Eine bemerkenswerte Synthese von Benzaldehyd ist die Strecker-Reaktion, bei der Ammoniak und Cyanwasserstoff verwendet werden, um ein Aminonitril-Zwischenprodukt zu bilden, das zu DL-2-Phenylglycin verseift werden kann.
Benzaldehyd kann auch an der Luft zu Benzoesäure autoxidieren. Dieser Prozess wird durch Licht beeinflusst und kann durch Peroxide oder Schwermetallsalze beschleunigt, durch Antioxidantien wie Phenolverbindungen und Diphenylamin jedoch verlangsamt werden. Benzaldehyd kann auch durch Stoffe wie Salpetersäure und Chrom(VI)-oxid zu Benzoesäure oxidiert werden.
Die Reduktion oder Hydrierung von Benzaldehyd unter verschiedenen Bedingungen führt zu verschiedenen Produkten, darunter Benzylalkohol, Dibenzylether, Benzoin, 1,2-Diphenylethan-1,2-diol, Stilben, Toluol und Methylcyclohexan. Durch die industriell genutzte katalytische Hydrierung entsteht Benzylalkohol.
Die Reduktion mit Aluminiumalkoholaten (Meerwein-Ponndorf-Verley-Reduktion) ist eine weitere Methode zur Gewinnung von Benzylalkohol. Mit diesem Verfahren können auch ungesättigte Aldehyde wie Zimtaldehyd reduziert werden, wobei olefinische Doppelbindungen erhalten bleiben.
Benzaldehyd reagiert mit Ammoniak und Wasserstoff in Gegenwart von Hydrierungskatalysatoren zu Benzylamin, das bedeutende industrielle Anwendungen hat. Die Seitenkettenchlorierung von Benzaldehyd führt zur Bildung von Benzoylchlorid.
Wie aliphatische Aldehyde nimmt auch Benzaldehyd an Kondensationsreaktionen mit verschiedenen organischen Verbindungen teil, die aktive Wasserstoffatome enthalten. Einige dieser Reaktionen werden in der Industrie eingesetzt. Beispielsweise entsteht bei der Claisen-Schmidt-Kondensation mit Acetaldehyd und wässrigem Alkali Zimtaldehyd.

Die Perkin-Kondensation mit Essigsäureanhydrid in Gegenwart spezifischer Kondensationsmittel führt zur industriellen Produktion von Zimtsäure.

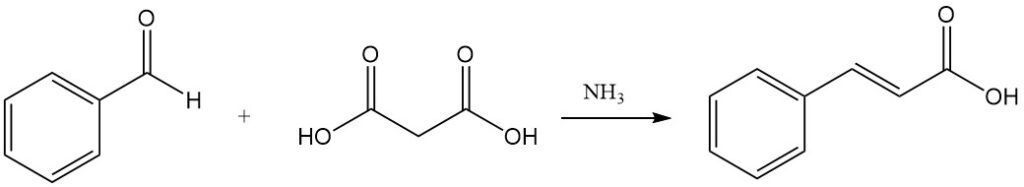
Die Knoevenagel-Kondensation mit Malonsäure, katalysiert durch schwach basische Substanzen wie Ammoniak und Amine, ist ein weiterer Weg zur Zimtsäure.
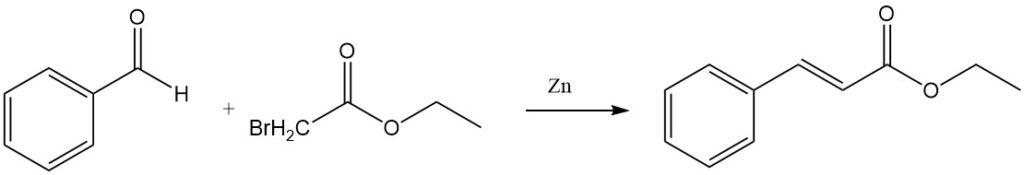
Die Reformatsky-Reaktion von Benzaldehyd und Ethylbromacetat in Gegenwart von aktiviertem Zink ergibt Ethylcinnamat.
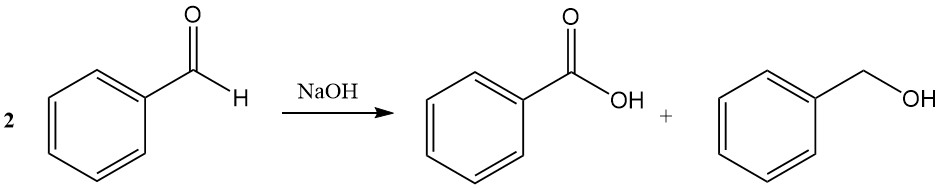
Die Cannizzaro-Reaktion von Benzaldehyd führt in Gegenwart von konzentriertem Natriumhydroxid oder Kaliumhydroxid zur Bildung von Benzoesäure und Benzylalkohol.
Die Claisen-Tishchenko-Kondensation von Benzaldehyd wird durch Natrium- und Aluminiumbenzylat katalysiert, um Benzylbenzoat zu bilden.
Bei der Benzoinkondensation verbinden sich zwei Benzaldehydmoleküle in Gegenwart von Cyanid zu Benzoin. Thiazoliumsalze können Cyanid als Katalysatoren ersetzen.
Benzaldehyd reagiert mit Ammoniak anders als aliphatische Aldehyde, die Reaktion läuft bis zur Bildung von 1-Phenyl-N,N‘-bis(phenylmethylen)-methandi-amin (Hydrobenzamid) ab.

Mit Fehlings Lösung behandelter Benzaldehyd bildet Benzylalkohol und Benzoesäure, jedoch kein Kupfer(I)-oxid. Aromatische Aldehyde polymerisieren nicht und bilden im Gegensatz zu aliphatischen Aldehyden keine zyklischen Verbindungen.
Benzaldehyd kondensiert mit Phenolen, aromatischen Aminen und Benzol zu Triphenylmethan-Derivaten. Diese Reaktion wird industriell zur Herstellung von Malachitgrün-Farbstoffen genutzt.
Die elektrophile Substitution des aromatischen Kerns in Benzaldehyd und anderen aromatischen Aldehyden, wie etwa Chlorierung, Nitrierung und Sulfonierung, erfolgt hauptsächlich in der Meta-Position.
3. Herstellung von Benzaldehyd
Benzaldehyd wird hauptsächlich durch Hydrolyse von Benzalchlorid oder teilweise Oxidation von Toluol hergestellt. Es gibt andere Herstellungsverfahren, die jedoch derzeit keine industrielle Bedeutung haben.
3.1. Hydrolyse von Benzalchlorid
Benzaldehyd wird durch Hydrolyse von Benzalchlorid hergestellt, einer Verbindung, die leicht durch Chlorierung von Toluol gewonnen wird. Diese Hydrolyse kann unter alkalischen oder sauren Bedingungen erfolgen.

Alkalische Hydrolyse:
Benzalchlorid kann mit verschiedenen alkalischen Mitteln wie Calciumhydroxid, Calciumcarbonat, Natriumhydrogencarbonat oder Natriumcarbonat verseift werden. Natriumcarbonat ist das bevorzugte Mittel, da es Nebenreaktionen minimiert.
In einem älteren Verfahren wird Benzalchlorid mit einem leichten Überschuss an 15 %iger Natriumcarbonatlösung bei 138 °C verseift. Der Reaktor besteht aus speziellen Materialien, wie einem mit Heresite (einem Phenolharz) ausgekleideten Rührgefäß aus Kohlenstoffstahl und einem Rührwerk aus einer Kupfer-Silizium-Legierung.
Dieser Prozess minimiert den Chlorgehalt des destillierten Produkts auf weniger als 0,01 %. Eine Mischung aus Benzalchlorid und Benzotrichlorid, die üblicherweise bei der Seitenkettenchlorierung von Toluol anfällt, kann ebenfalls hydrolysiert werden. Dabei wird Benzotrichlorid in Natriumbenzoat und anschließend in Benzoesäure umgewandelt.
In einem neueren kontinuierlichen Verfahren werden Benzalchlorid und das alkalische Verseifungsmittel in einem Durchflussreaktor unter Verwendung eines unreaktiven organischen Lösungsmittels zur Reaktion gebracht.
Der extrahierte Benzaldehyd wird dann von der wässrigen alkalischen Phase abgetrennt, indem ein unreaktives organisches Lösungsmittel in die entgegengesetzte Richtung geleitet wird. Dieser kontinuierliche Prozess integriert Reaktor, Extraktionszone und Waschzone in einem einzigen Apparat.
Alternativ kann Benzalchlorid durch Kochen mit einer wässrigen Lösung von Hexamethylentetramin in Benzaldehyd umgewandelt werden. Die Sommelet-Reaktion kann auch zur Herstellung von Benzaldehyd aus industriellen Mischungen von Benzylchlorid und Benzalchlorid genutzt werden.
Säurehydrolyse:
Benzalchlorid kann auch unter sauren Bedingungen hydrolysiert werden, wobei Säuren und Metallsalze als Katalysatoren verwendet werden. Dabei werden hohe Ausbeuten an Benzaldehyd (mehr als 90 %) und Chlorwasserstoff erzielt, die als konzentrierte Salzsäure zurückgewonnen werden können.
In der Vergangenheit wurde diese Hydrolyse oft in Gegenwart von konzentrierter Schwefelsäure durchgeführt, was zur Bildung großer Mengen verdünnter Schwefelsäure als Abfall führte. Dieses Verfahren eignet sich für die Hydrolyse bestimmter substituierter Benzaldehyde, die auf andere Weise nur schwer verseifbar sind.
Auch Metallsalze, insbesondere Eisen- oder Zinksalze, können die Hydrolyse von Benzalchlorid katalysieren. Es ist wichtig, die Ansammlung von Wasser in der Reaktionsmischung zu verhindern, da dies die Aktivität des Katalysators verringern kann.
Der Prozess kann mit verschiedenen Katalysatoren wie Zinkphosphat, Zinklaurat, Zinnchloriden, Kupfer(II)-chlorid und mehr durchgeführt werden. Die Reaktion kann diskontinuierlich oder kontinuierlich in einer Reaktorkaskade durchgeführt werden.
Dampfphasenhydrolyse:
Ein innovatives kontinuierliches Verfahren beinhaltet die Dampfphasenhydrolyse von Benzalchlorid bei erhöhten Temperaturen, katalysiert durch mit Säure behandelte oder mit Metallchlorid oder -sulfat imprägnierte Aktivkohle. Dieses Verfahren liefert eine hohe Benzaldehydausbeute von 97 %.
Diese Methode eignet sich besonders für die Hydrolyse trifluormethylsubstituierter Benzalchloride, deren Umwandlung in die entsprechenden Benzaldehyde ansonsten schwierig ist. Ein ähnlicher Dampfphasenprozess beinhaltet die Hydrolyse von Benzalchlorid zu Benzaldehyd bei 300 °C unter Verwendung eines Katalysators wie Siliziumdioxid oder Aluminiumoxid.
3.2. Oxidation von Toluol
Benzaldehyd kann aus Toluol durch partielle Oxidation hergestellt werden, die entweder in der Gasphase oder in der Flüssigphase erfolgen kann. Die Bedingungen müssen sorgfältig kontrolliert werden, um eine partielle Oxidation zu begünstigen, da Benzaldehyd weiter zu Benzoesäure und anderen Produkten oxidiert werden kann.

Gasphasenoxidation
Beim Gasphasenverfahren werden Toluoldampf und Sauerstoff bei hohen Temperaturen (250–650 °C) durch ein Katalysatorbett geleitet. Die Reaktion ist sehr heiß, daher ist es wichtig, sie effektiv zu kühlen.
Um die Ausbeute an Benzaldehyd zu verbessern, ist es hilfreich, den Toluoldampf und Sauerstoff mit einem Inertgas wie Wasserdampf, Stickstoff oder Kohlendioxid zu verdünnen.
Zu den besten Bedingungen gehören niedrige Umwandlungsraten (10–20 % pro Durchgang), kurze Verweilzeiten (0,1–1,0 Sekunden) und eine präzise Kontrolle der Sauerstoffmenge. Auch unter diesen Bedingungen beträgt die Ausbeute typischerweise nur 40–60 % der theoretischen Ausbeute bezogen auf Toluol.
Bei dieser Gasphasenoxidation von Toluol entstehen auch andere Verbindungen wie Maleinsäureanhydrid, Citraconsäureanhydrid, Phthalsäureanhydrid, Anthrachinon, Kresol, Essigsäure sowie erhebliche Mengen Benzoesäure, Kohlenmonoxid und Kohlendioxid. Die Zugabe von Kaliumsulfat oder Natriumfluorid zum Katalysator oder die Anwendung von hohem Druck kann die vollständige Verbrennung verringern.
Für die Gasphasenoxidation werden häufig verschiedene Oxidkatalysatoren verwendet, die typischerweise Molybdän und andere Elemente wie Eisen, Nickel, Kobalt, Antimon, Wismut, Vanadium, Phosphor, Samarium, Tantal, Zinn und Chrom enthalten.
Einige Katalysatoren kombinieren Palladium und Phosphorsäure auf Aktivkohle, andere bestehen aus Mischoxiden aus Silber und Übergangsmetallen. Ein anderes Verfahren verwendet einen Mischoxidkatalysator mit Uran, Kupfer, Eisen, Phosphor, Tellur und Blei zusätzlich zu Molybdän.
Flüssigphasenoxidation
Auch die Flüssigphasenoxidation von Toluol mit Sauerstoff ist eine gängige Methode. Dies geschieht üblicherweise in Gegenwart von Katalysatoren wie Kobalt-, Nickel-, Mangan-, Eisen- oder Chromverbindungen. Es wurden auch Bleiverbindungen, Rutheniumverbindungen, Thalliumsalze organischer Säuren und verschiedene Promotoren verwendet, die jedoch zu Korrosion führen können.
Die Bildung von Benzaldehyd in der flüssigen Phase kann auch eine Oxidation mit anderen Mitteln wie Methanol, Acetaldehyd, Benzoesäure, Essigsäure oder der Zugabe von Wasser umfassen.
Zur Reinigung des aus diesen Verfahren gewonnenen rohen Benzaldehyds wird üblicherweise die Destillation eingesetzt, gegebenenfalls mit weiteren Reinigungsschritten, um Verunreinigungen zu entfernen, die das Produkt verfärben.
Nebenprodukt Benzaldehyd
Bei großtechnischen Prozessen zur Phenol– und Caprolactam-Herstellung fallen häufig erhebliche Mengen Benzaldehyd als Nebenprodukte an. Infolgedessen werden spezielle Oxidationsverfahren zur ausschließlichen Herstellung von Benzaldehyd in industriellen Umgebungen seltener eingesetzt.
Diese Benzaldehyd-Nebenproduktströme werden typischerweise verarbeitet, um reinen Benzaldehyd zu erhalten. Es ist wichtig zu beachten, dass selbst bei der Herstellung von Benzaldehyd als Primärprodukt durch katalytische Flüssigphasenoxidation erhebliche Mengen an Benzoesäure und anderen Nebenprodukten entstehen können.
Der rohe Benzaldehyd wird üblicherweise durch Destillation bei vermindertem Druck in einer Edelstahlkolonne raffiniert.
Andere Oxidationsprozesse
Prozesse, bei denen Toluol mit Mitteln wie Mangandioxid in Schwefelsäure, Natriumpersulfat, Chrom(VI)-oxid in Essigsäureanhydrid oder Chromylchlorid oxidiert wird, sind aus Gründen der Abwasserentsorgung im Allgemeinen nicht von industrieller Bedeutung.
3.3. Andere Produktionsprozesse
Es gibt andere Möglichkeiten, Benzaldehyd herzustellen, diese werden jedoch nicht so häufig verwendet wie die gebräuchlicheren Methoden.
- Reaktion von Benzol und Kohlenmonoxid: Benzaldehyd kann durch Reaktion von Benzol mit Kohlenmonoxid hergestellt werden. Allerdings wird diese Methode in der Industrie nicht häufig eingesetzt.
- Oxidation oder Dehydrierung von Benzylalkohol: Benzaldehyd kann auch durch Oxidation oder Dehydrierung von Benzylalkohol hergestellt werden. Diese Methode ist möglich, aber nicht die Hauptmethode zur Herstellung von Benzaldehyd im großen Maßstab.
- Rutheniumkatalysierte Oxidation von Styrol mit Periodat oder Hypochlorit: Benzaldehyd kann hergestellt werden, indem Ruthenium zur Katalyse der Oxidation von Styrol mit Periodat oder Hypochlorit verwendet wird. Dieses Verfahren wird in der Industrie nicht häufig zur Herstellung von Benzaldehyd eingesetzt.
- Hydrolyse von Benzylchlorid- und Benzalchlorid-Mischungen: Benzaldehyd kann durch Hydrolyse von Mischungen aus Benzylchlorid und Benzalchlorid in verdünnter Salpetersäure unter Verwendung von Vanadiumpentoxid als Katalysator hergestellt werden. Dies ist jedoch nicht die Hauptmethode zur Herstellung von Benzaldehyd in der Industrie.
- Reduktion von Benzoylchlorid oder Methylbenzoat: Benzaldehyd kann auch durch Reduktion von Benzoylchlorid oder Methylbenzoat hergestellt werden. Diese Methoden sind für die Herstellung von Benzaldehyd im Allgemeinen nicht von industrieller Bedeutung und werden eher bei der Synthese spezifischer kernsubstituierter Derivate eingesetzt.
Zusammenfassend lässt sich sagen, dass diese anderen Methoden zur Herstellung von Benzaldehyd in der Industrie nicht häufig eingesetzt werden. Die zuvor beschriebenen Methoden sind die primären Ansätze für die Herstellung in großem Maßstab.
4. Verwendung von Benzaldehyd
Benzaldehyd ist eine vielseitige und wichtige Chemikalie mit einem breiten Anwendungsspektrum. Es wird zur Herstellung einer Vielzahl von Geruchs- und Geschmacksstoffen verwendet, darunter solche, die in natürlichem Bittermandelöl, Parfüms, Seifen, Lebensmitteln und Getränken enthalten sind.
Benzaldehyd wird zur Herstellung von Derivaten verwendet, die in der Parfüm- und Aromaindustrie verwendet werden, wie z. B. Zimtaldehyd, Zimtalkohol, Zimtsäure und Benzylbenzoat.
Benzaldehyd wird auch zur Herstellung von Triphenylmethanfarbstoffen verwendet, beispielsweise der Leukobase von Malachitgrün und dem Acridinfarbstoff Benzoflavin.
In der pharmazeutischen Industrie wird Benzaldehyd als Zwischenprodukt bei der Herstellung von Chloramphenicol, Ephedrin, Ampicillin, Diphenylhydantoin und anderen Produkten verwendet.
Weitere wichtige chemische Zwischenprodukte, die aus Benzaldehyd gewonnen werden, sind Benzoin, Benzylamin, Benzylalkohol, Mandelsäure und 4-Phenyl-3-buten-2-on (Benzylidenaceton).
Benzaldehyd wird außerdem in der Photochemie, als Korrosionsinhibitor und Färbehilfsmittel, in der Galvanikindustrie und bei der Herstellung von Agrarchemikalien eingesetzt.
5. Toxikologie von Benzaldehyd
Benzaldehyd wird in Lebensmitteln, Kosmetika, Pharmazeutika und Seife als Geschmacks- und Duftstoff verwendet. Für diese Verwendungszwecke ist es im Allgemeinen sicher. Benzaldehyd findet auch industrielle und landwirtschaftliche Anwendungen.
Benzaldehyd hat eine mäßige akute Toxizität. Die orale LD50 (Dosis, die 50 % einer Testpopulation tötet) beträgt 1,3 g/kg bei Ratten und 1 g/kg bei Meerschweinchen. Die geschätzte wahrscheinliche tödliche Dosis für einen 70 kg schweren Menschen beträgt 50 ml. Die subchronische orale Verabreichung an Nagetiere zeigte bei Tagesdosen von 400 mg/kg bei Ratten und 300–600 mg/kg bei Mäusen keine nachteiligen Auswirkungen.
Höhere Dosen verursachten jedoch Schäden an Gehirn, Niere und Vormagen. Mutagenitätstests waren negativ. Es liegen keine Studien zu krebserzeugenden, teratogenen oder reproduktiven Wirkungen von Benzaldehyd vor.
Zu den toxischen Wirkungen von Benzaldehyd gehören Depressionen, Inaktivität, Zittern, Krampfanfälle und Koma. Eine Atemdepression kann zum Tod führen. Benzaldehyd hat eine schwache lokalanästhetische Wirkung und reizt das Auge und die oberen Atemwege leicht. Die Hautreizung ist mäßig und bei einigen Personen kann es zu einer allergischen Reaktion kommen.
Um Risiken zu minimieren, vermeiden Sie den Kontakt mit Benzaldehyd. Bei erforderlichem Kontakt Handschuhe und Schutzkleidung tragen. In schlecht belüfteten Bereichen umluftunabhängige Atemschutzgeräte verwenden, um eine Inhalationsexposition zu vermeiden.
Referenz
- Benzaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_463.pub2


