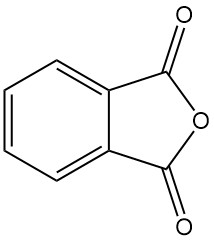
Was ist Phthalsäureanhydrid?
Phthalsäureanhydrid [85-44-9], auch bekannt als Isobenzofuran-1,3-dion, ist eine organische Verbindung mit der Formel C6H4(CO)2O. Es ist ein farbloser bis weißer, nadelförmiger Feststoff mit einem milden, charakteristischen Geruch, der durch die Dehydrierung von Phthalsäure.
Phthalsäureanhydrid war das erste Anhydrid einer Dicarbonsäure, das kommerziell genutzt wurde. Es ist eine wichtige Industriechemikalie, die zur großtechnischen Herstellung von Weichmachern für Kunststoffe verwendet wird.
A. Laurent entdeckte Phthalsäureanhydrid erstmals im Jahr 1836 und wird seit 1872 von der BASF mithilfe des Naphthalin-Oxidationsverfahrens hergestellt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Phthalsäureanhydrid
Phthalsäureanhydrid liegt als farblose Nadeln oder Plättchen mit monokliner oder rhombischer Kristallform vor. Die physikalischen Eigenschaften von Phthalsäureanhydrid sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [85-44-9] |
| Chemische Formel | C8H4O3 |
| Molekulargewicht | 148,12 g/mol |
| Dichte (fest bei 4 °C) | 1,527 g/cm3 |
| Spezifische Dampfdichte (1013 mbar) | 6,61 kg/m3 |
| Schmelzpunkt | 131,6 °C |
| Siedepunkt (1013 mbar) | 295,1 °C |
| Fusionswärme | 159,1 J/g |
| Verbrennungswärme | 22.160,7 J/g |
| Bildungswärme (Naphthalin) | 12.058 J/g |
| Bildungswärme (o-Xylol) | 8.625 J/g |
| Sublimationswärme | 601 J/g |
| Verdampfungswärme | 441,7 J/g |
| Flammpunkt | 152 °C |
| Zündtemperatur | 580 °C |
| Entflammbarkeitsgrenzen (1013 mbar) | Oberer Teil: 10,5 Vol.-% Unterer Teil: 1,7 Vol.-% |
| Untere Staubexplosionsgrenze | 25 g/m3 |
Die Dichte von flüssigem Phthalsäureanhydrid zwischen 140 und 240 °C lässt sich mit folgender Gleichung ermitteln:
ρ/kg.m-3 = 1321.55-0.6697 (t/°C)-0.000905 (t/°C) 2
Die Löslichkeitsdaten von Phthalsäureanhydrid in verschiedenen Lösungsmitteln sind in Tabelle 2 aufgeführt.
Die gemeldeten Daten zur Explosionsgefahr von Phthalsäureanhydrid in der Luft weisen erhebliche Unterschiede auf. Bei Konzentrationen unter 100 g/m³ kann es zu Explosionen kommen, beeinflusst durch in der Probe vorhandene Verunreinigungen. Jüngste industrielle Zwischenfälle deuten darauf hin, dass eine Konzentration von mehr als 35 g/m³ Phthalsäureanhydrid im Reaktionsproduktgas bei Kontakt mit Wärmeträgersalz aufgrund gebrochener Reaktorrohre zu einer Entzündung führen kann.
| Lösungsmittel | Temperatur (°C) | Löslichkeit (g/100 g) |
|---|---|---|
| Wasser | 20 | 1,64 |
| Wasser | 50 | 1,74 |
| Wasser | 100 | 19,0 |
| Kohlenstoffdisulfid | 20 | 0,7 |
| Ameisensäure | 20 | 4.7 |
| Pyridin | 20 | 80 |
| Benzol | - | löslich |
| Ethanol | 20 | löslich |
| Diethylether | 20 | schwer löslich |
2. Phthalsäureanhydrid-Reaktionen
Phthalsäureanhydrid zeigt die Reaktivität von cyclischem Anhydrid und aromatischen Verbindungen.
Die Reaktion von Phthalsäureanhydrid mit Alkoholen oder Diolen ergibt Ester oder Polyester. Beispielsweise reagiert Phthalsäureanhydrid mit Ethylenglykol zu Polyester, einem Polymer mit sich wiederholenden Estereinheiten.
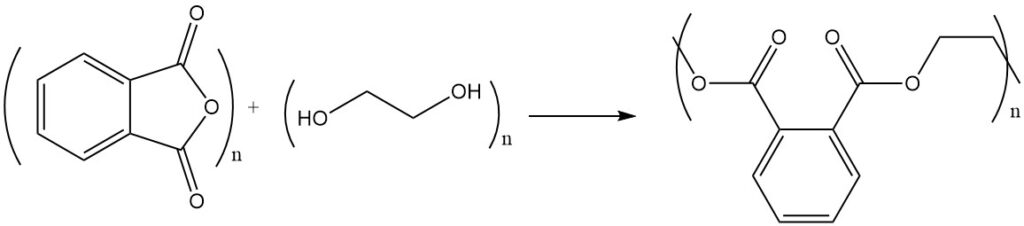
Ungesättigte Polyesterharze entstehen durch Polykondensation mit Maleinsäureanhydrid oder Fumarsäure.
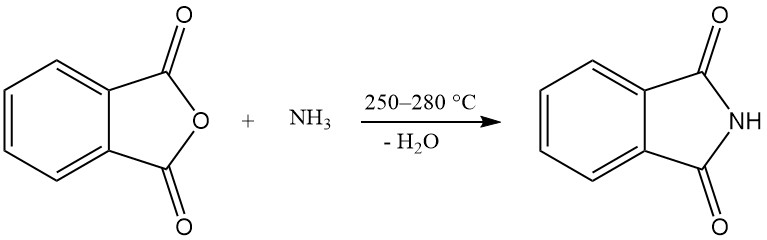
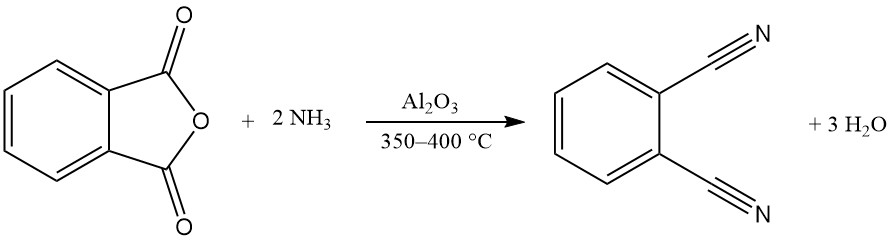
Eine oder beide Carboxygruppen von Phthalsäureanhydrid können mit Ammoniak unter Bildung von Phthalimid oder Phthalonitril reagieren.
Phthalein- und Rhodaminfarbstoffe, von denen einige auf eine mehr als hundertjährige Produktionsgeschichte zurückblicken, werden durch die Reaktion von Phthalsäureanhydrid mit Phenolen, Aminophenolen oder Chinaldinderivaten gewonnen. Fluorescein wird aus Phthalsäureanhydrid und Resorcin unter Verwendung von Säurekatalysatoren synthetisiert.
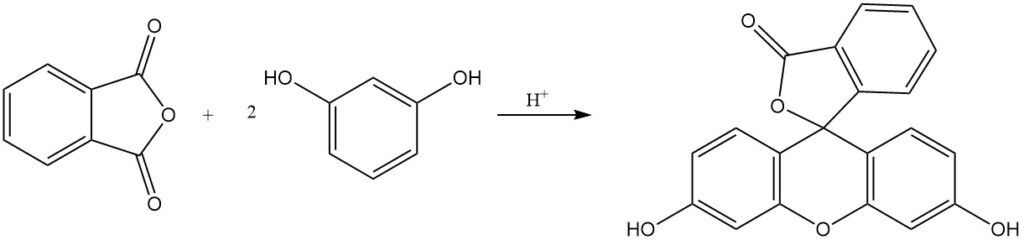
Bei der Reaktion von Phthalsäureanhydrid mit Phenol entsteht in Gegenwart eines Säurekatalysators Phenolphthalein.
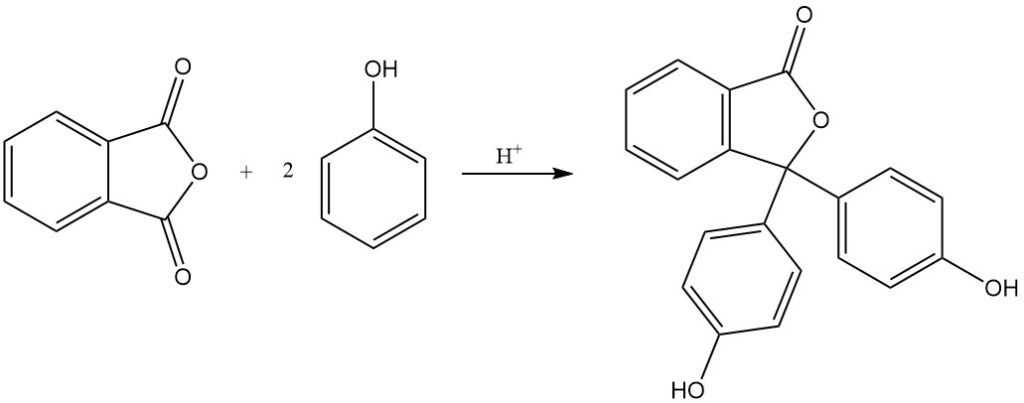
Wenn Phthalsäureanhydrid mit 4-Aminophenol umgesetzt wird, entsteht N-(4-Hydroxyphenyl)phthalimid.
Durch die Friedel-Crafts-Reaktion von Phthalsäureanhydrid mit Benzolderivaten und anschließendem Ringschluss entstehen Anthrachinonderivate, die zur Herstellung von Anthrachinonfarbstoffen verwendet werden.
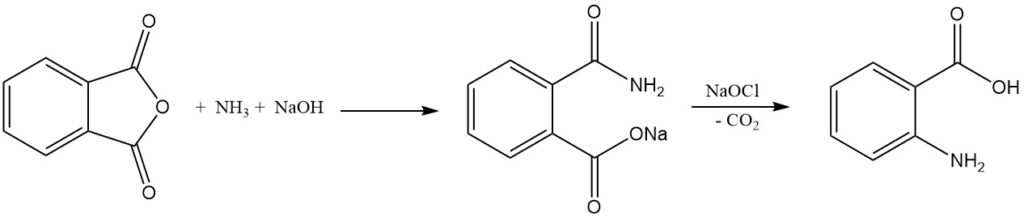
Die industrielle Synthese von Anthranilsäure aus Phthalsäureanhydrid umfasst zwei Schritte. Zuerst reagiert Phthalsäureanhydrid mit Ammoniak in Gegenwart von Natriumhydroxid unter Bildung von Phthalaminsäuresalz, und dann unterliegt das Natriumsalz der Phthalaminsäure einer Hofmann-Umlagerung und Decarboxylierung, wenn es mit Hypochlorit behandelt wird, um Anthranilsäure zu ergeben.
Terephthalsäure kann durch Umlagerung von Dikaliumphthalat hergestellt werden, aber technische Herausforderungen haben diesen Prozess überflüssig gemacht.
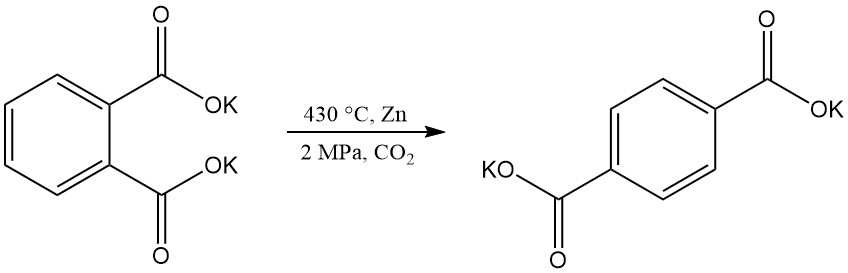
Die elektrochemische Hydrierung von Phthalsäureanhydrid ergibt 3,5-Dihydrophthalsäure, während die Hydrierung mit einem Nickelkatalysator Phthalid erzeugt.
3. Herstellung von Phthalsäureanhydrid
Phthalsäureanhydrid wird großtechnisch überwiegend durch Gasphasenoxidation von o-Xylol oder Naphthalin hergestellt. Es kann auch durch Wirbelschichtoxidation von Naphthalin oder durch Flüssigphasenoxidation von o-Xylol hergestellt werden.
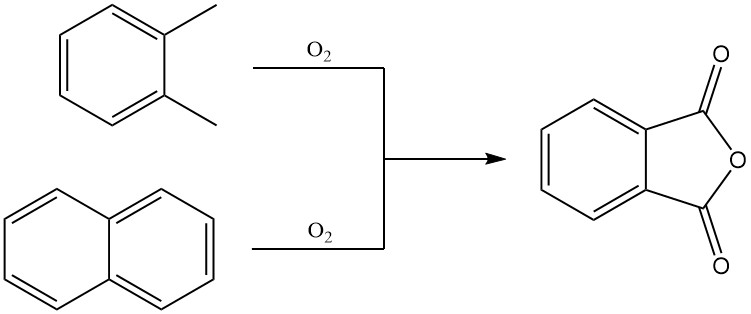
3.1. Herstellung von Phthalsäureanhydrid durch Gasphasenoxidation von o-Xylol oder Naphthalin
Vorgewärmtes o-Xylol wird mit heißer Luft vermischt und in einen Rohrreaktor eingespeist, der einen hochselektiven Katalysator enthält. Die Oxidationsreaktion ist exotherm und die erzeugte Wärme wird zur Dampferzeugung genutzt, wobei überschüssiger Dampf zur externen Nutzung zur Verfügung steht.
Die Reaktorabgase werden vorgekühlt. Bei hohen Phthalsäureanhydrid-Konzentrationen kann ein Teil des flüssigen Phthalsäureanhydrids direkt in einem Kondensator gesammelt werden und der verbleibende Produktgasstrom gelangt in ein Schaltkondensatorsystem.
Die Rippenrohre innerhalb der Schaltkondensatoren werden in einem zyklischen Prozess durch Wärmeträgeröl gekühlt. Während des Kühlzyklus kondensiert Phthalsäureanhydrid als Feststoff an den Rohren, und ein anschließender Heizzyklus schmilzt das abgeschiedene Phthalsäureanhydrid, das dann in einem Lagertank gesammelt wird.
Nach der Phthalsäureanhydrid-Abtrennung müssen Nebenprodukte enthaltende Abgase durch Wasserwäsche, katalytische Verbrennung oder thermische Verbrennung gereinigt werden.
Die Wasserwäsche ermöglicht die Konzentration von Maleinsäure (einem Nebenprodukt) aus der Waschlösung, die zu Fumarsäure oder Maleinsäureanhydrid weiterverarbeitet werden kann.
Durch die Kombination der Wäsche mit der Maleinsäureanhydrid-Produktion entfällt die Einleitung belasteter Abwässer.
Das rohe Phthalsäureanhydrid wird in ein kontinuierliches thermisches/chemisches Behandlungssystem überführt, das sämtliche Phthalsäure-Nebenprodukte wieder in Phthalsäureanhydrid umwandelt. Abschließend wird das behandelte rohe Phthalsäureanhydrid durch ein kontinuierliches, zweistufiges Destillationssystem gereinigt.
3.1.1. Kommerzielle Prozesse
Das BASF-Verfahren arbeitet mit einem breiten Spektrum an o-Xylol-Beladungen (bis zu 105 g/m³) und verwendet einen Endreaktor für Reduzierung von Nebenprodukten und Qualitätsverbesserung.
Dieses Verfahren bietet einen flexiblen Betrieb für optimierte Ausbeute, reduzierten Abfall und eine längere Lebensdauer des Katalysators und erfordert keine SO2-Aktivierung oder einen Vorkondensator für die Sammlung von rohem Phthalsäureanhydrid.
Das erzeugte rohe Phthalsäureanhydrid enthält einen geringen Nebenproduktgehalt, wodurch es für einen geringen Energieverbrauch und einen hohen Nettoenergieexport optimiert ist.
Der Wacker-Prozess berücksichtigt o-Xylol, Naphthalin oder deren Mischungen. Es verwendet o-Xylol-Beladungen von 90–100 g/m³ (STP) und konzentriert sich auf Prozessmodifikationen zur Energieeinsparung.
Der Nippon Shokubai VGR-Prozess zeichnet sich durch Abgasrecycling aus, wodurch die Sauerstoffkonzentration auf <10 Vol.-% reduziert wird, um einen sicheren Betrieb mit hohem Sauerstoffgehalt zu gewährleisten -Xylolbeladung (bis zu 85 g/m³ STP). Dieses Verfahren erzielt dank eines speziellen Katalysatorsystems hohe Ausbeuten und kann auch Naphthalin als Ausgangsmaterial verwenden.
Der Alusuisse-Ftalital LAR-Prozess schlägt o-Xylol-Beladungen von bis zu 134 g/m³ (STP) für eine potenzielle Energie- und Anlagengrößenreduzierung vor . Es verwendet kommerziell Beladungen von bis zu 80 g/m³ (STP) und verwendet ring- oder halbringförmige Katalysatoren, die sowohl o-Xylol als auch Naphthalin oder deren Mischungen verarbeiten können.
Der Rhône-Poulenc-Prozess verwendet o-Xylol als Ausgangsmaterial und unterzieht das Rohprodukt vor der Zweistufe einer chemischen Nachbehandlung Destillation. Es behandelt Abgase durch Verbrennung.
Der ELF Atochem/Nippon Shokubai-Prozess nutzt den Nippon Shokubai-Katalysator für die Verarbeitung von o-Xylol oder Naphthalin und verwendet industrielle Beschickungsmengen von bis zu 75 g/m³ (STP) für o-Xylol.
3.1.2. Katalysator und Reaktionsmechanismus
Moderne Anlagen nutzen zur Energieeffizienz überwiegend ringförmige Katalysatoren in salzschmelzgekühlten Rohrreaktoren. Es sind auch Halbschalenstützen erhältlich.
Typische Katalysatoren bestehen aus einem inerten Keramikträger (Silikat, Siliziumkarbid usw.), der mit einer dünnen Schicht aus Vanadium- und Titanoxiden beschichtet ist. Antimon, Rubidium, Cäsium, Niob und Phosphor können zugesetzt werden, um die Selektivität gegenüber Phthalsäureanhydrid zu erhöhen.
Zweizonenkatalysatoren, die Zonen mit niedriger und hoher Aktivität kombinieren, sind üblich, wobei einige Prozesse drei Zonen für hohe o-Xylolbeladungen verwenden und bestimmte Katalysatoren für eine längere Lebensdauer eine SO2-Aktivierung erfordern.
Der genaue Reaktionsweg für die Bildung von Phthalsäureanhydrid ist nicht vollständig geklärt und hängt von Messmethoden und Versuchsaufbauten ab.
Ein Redoxmechanismus, an dem Sauerstoffatome im Katalysatorgitter beteiligt sind, wird allgemein akzeptiert. Obwohl der intermediäre Alkohol nicht eindeutig beobachtet wurde, ist sein Vorhandensein bei der Umwandlung von o-Xylol in Phthalsäureanhydrid wahrscheinlich.
Bei der industriellen o-Xylol-Umwandlung werden Ausbeuten von mehr als 80 % des theoretischen Maximums erreicht (ca. 110–112 kg PA pro 100 kg o-Xylol). Aufgrund zusätzlicher Nebenprodukte wie Naphthochinon sind die Naphthalin-Umwandlungsausbeuten jedoch typischerweise niedriger (etwa 85 % des theoretischen Maximums oder 98 kg PA pro 100 kg Naphthalin).
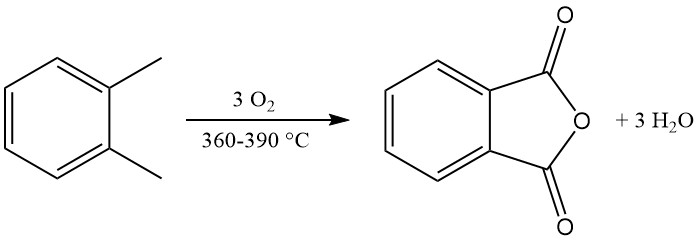
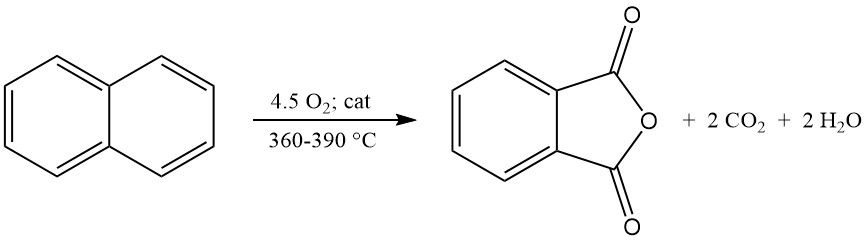
Die exotherme Oxidationsreaktion erzeugt erhebliche Wärme: 1300–1800 kJ/mol für o-Xylol und 2100–2500 kJ/mol für Naphthalin. Diese Wärme wird häufig zur Dampferzeugung genutzt.
Zu den Hauptnebenprodukten der o-Xylol-Oxidation gehören Maleinsäure und Phthalid, und bei der Naphthalin-Oxidation entsteht zusätzlich Naphthochinon, das einer stärkeren Reinigung bedarf.
3.1.3. Reinigung von Phthalsäureanhydrid
Um nach der ersten Reaktionsstufe hochreines Phthalsäureanhydrid zu erhalten, wird das Rohprodukt vor der Destillation häufig einer thermischen Behandlung unterzogen, um Verunreinigungen zu entfernen.
Für Produkte mit geringer Verunreinigung aus o-Xylol eignet sich eine einfache Wärmebehandlung (100–400 °C). Ziel der Behandlung ist die Beseitigung von Wasser, niedrigsiedenden Verunreinigungen (Maleinsäureanhydrid, o-Tolualdehyd) und Phthalid.
Phthalsäureanhydrid, das durch die Oxidation von Naphthalin entsteht, erfordert aufgrund des Vorhandenseins von Naphthochinon als Nebenprodukt eine zusätzliche chemische Behandlung.
Für die Naphthochinon-Eliminierung können verschiedene Chemikalien verwendet werden, darunter Schwefelsäure, Natriumhydroxid, Borsäure/Schwefelsäure-Mischung, Kaliumdisulfid, Natriumcarbonat, Kaliummaleat und aliphatische Polydiene.
Die Destillation dient als letzte Reinigungsstufe für rohes Phthalsäureanhydrid.
Der Destillationsprozess (Abbildung 1) umfasst typischerweise ein kontinuierliches System mit mehreren Kolonnen.
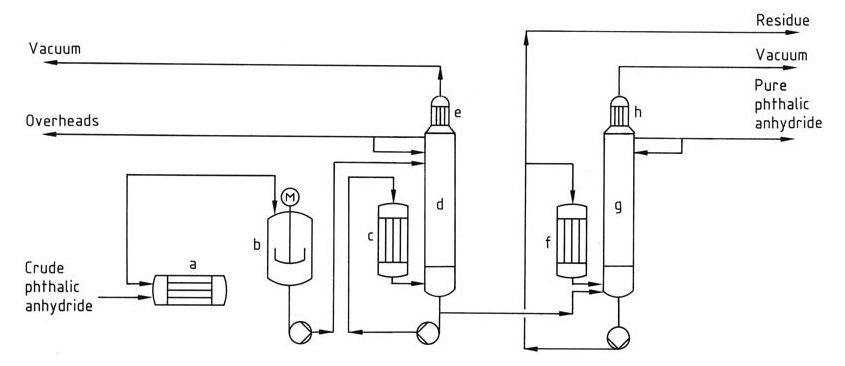
a) Erhitzer für rohes Phthalsäureanhydrid; b) Vorzerleger; c) Reboiler; d) Stripperkolonne; e) Kondensator; f) Reboiler; g) Destillationskolonne; h) Kondensator
Zuerst wandelt der Vorzersetzer restliche Phthalsäure im Rohprodukt in Phthalsäureanhydrid um, und dann konzentriert und entfernt die erste Kolonne niedrigsiedende Verunreinigungen wie Maleinsäureanhydrid und Benzoesäure aus dem Kopf. Schließlich reinigt die zweite Kolonne Phthalsäureanhydrid durch Destillation, wobei der hochsiedende Rückstand zurückbleibt.
3.2. Herstellung von Phthalsäureanhydrid durch Wirbelschichtoxidation von Naphthalin
Phthalsäureanhydrid kann durch Wirbelschichtoxidation von Naphthalin hergestellt werden. Ein Beispiel ist das Badger-Verfahren, das immer noch verwendet wird. Anlagen, die dieses Verfahren anwenden, können ihre Produktionskapazität durch die Injektion von Sauerstoff und Luft steigern, was eine höhere Naphthalinkonzentration ermöglicht.
Das flüssige Naphthalin wird direkt am Bettboden eingespritzt und verdampft, um eine gleichmäßige Verteilung im gesamten Katalysator zu gewährleisten. Der Luftsauerstoff wird über eine Verteilerplatte zugeführt, um die Reaktion zu erleichtern.
Durch kräftiges Mischen im Wirbelbett wird eine gleichmäßige Temperatur (345–385 °C) aufrechterhalten, und die durch die Reaktion erzeugte Wärme wird über Kühlrohre zur Hochdruckdampferzeugung genutzt.
Zur Abtrennung und Wiederverwertung des Katalysators, der mit SO2 regeneriert werden kann, werden Zyklone und Keramikfilter eingesetzt.
Bis zu 60 % des Phthalsäureanhydrids werden als flüssiges Kondensat zurückgewonnen, der Rest wird durch Desublimation in Schaltkondensatoren gewonnen und schließlich unter Vakuum destilliert, um reines Produkt zu erzeugen.
3.3. Herstellung von Phthalsäureanhydrid durch Flüssigphasenoxidation von o-Xylol
Phthalsäureanhydrid kann durch Flüssigphasenoxidation von o-Xylol hergestellt werden. Bei diesem Verfahren wird eine Mischung aus Essigsäure, o-Xylol (> 99 % ortho-Isomergehalt für hohe Ausbeute erforderlich) und Ein Katalysator auf Kobalt-, Mangan- und Brombasis wird einem Kaskadenreaktorsystem zugeführt.
Die Reaktion beginnt unter Druck mit Luftinjektion und schreitet durch die nachfolgenden Gefäße voran. Als Nebenprodukt entstehendes Wasser wird im ersten Gefäß durch azeotrope Destillation mit o-Xylol entfernt.
Phthalsäure-Isomere werden getrennt und durch Kristallisation wird Phthalsäureanhydrid gewonnen. Aufgrund der Anwesenheit von Brom im Katalysator erfordert das Rohprodukt eine spezielle Vorbehandlung vor der endgültigen Reinigung durch Destillation.
Der Sisas-Prozess ist ein zweistufiger Prozess, bei dem o-Xylol in flüssiger Phase zu roher o-Toluylsäure oxidiert und nicht umgesetztes o-Xylol recycelt wird. Anschließend wird die abgetrennte o-Toluylsäure in der Gasphase zu Phthalsäureanhydrid oxidiert.
Die Gesamtmolausbeute an Phthalsäureanhydrid bezogen auf o-Xylol kann bis zu 88 % erreichen.
Der Flüssigphasenoxidationsprozess ist eine Alternative zu herkömmlichen Methoden, hat jedoch im Vergleich zur katalytischen Festbettoxidation keine breite industrielle Akzeptanz gefunden.
4. Verwendung von Phthalsäureanhydrid
Die wichtigste Anwendung von Phthalsäureanhydrid ist die Herstellung von Weichmachern. Die Hauptanwendungen von Phthalsäureanhydrid sind die Herstellung von Weichmachern (55 %), ungesättigten Polyesterharzen (14 %), Alkydharzen (15 %) und anderen chemischen Produkten wie Farbstoffen und Pigmenten, Waschmitteln, Herbiziden und Insektiziden, Flammschutzmitteln und Saccharin und Polyesterharz-Vernetzungsmittel.
Es wird weltweit für ein äußerst breites Anwendungsspektrum eingesetzt, das von der Kunststoffindustrie bis zur Synthese von Harzen, landwirtschaftlichen Fungiziden und Aminen reicht.
5. Toxikologie von Phthalsäureanhydrid
Phthalsäureanhydrid weist eine geringe akute Toxizität auf, kann jedoch beim Einatmen zu Atemwegsreizungen und Sensibilisierungen führen. Studien zur chronischen Exposition deuten darauf hin, dass kein krebserzeugendes Potenzial besteht, und begrenzte Daten zur Reproduktionstoxizität erfordern weitere Untersuchungen.
Akute Toxizität
Phthalsäureanhydrid weist basierend auf den LD50-Werten eine geringe akute Toxizität auf:
- Oral (Ratte): 1500–4000 mg/kg
- Inhalation (Ratte): >210 mg/m³ h (Staub)
- Dermal (Kaninchen): >10000 mg/kg
Hautkontakt mit Phthalsäureanhydrid kann zu leichten Reizungen führen, während Augenkontakt reizend ist. Es kann auch eine Hautsensibilisierung hervorrufen.
Subakute Toxizität
Eine 28-tägige ernährungsbedingte Exposition von Ratten (bis zu 3800 ppm) zeigte keine signifikanten Auswirkungen.
Sondenstudien an Ratten zeigten bei Dosen über 1200 mg/kg/Tag eine Toxizität der Nieren und der Magenschleimhaut.
Inhalationsstudien zeigten bei verschiedenen Tieren bei hohen Konzentrationen (10000 mg/m³) eine Reizung der Atemwege.
Wiederholte inhalative Exposition (8,5 mg/m³) verursachte bei Ratten Reizungen der Atemwege und häufige Lungenentzündungen.
Genotoxizität
In In-vitro-Tests mit und ohne metabolische Aktivierung wurden keine mutagenen oder chromosomalen Wirkungen beobachtet.
Chronische Toxizität und Karzinogenität
Langzeit-Ernährungsstudien an Ratten und Mäusen bei hohen Dosen (bis zu 3600 mg/kg/Tag) zeigten im Vergleich zu Kontrollen keine erhöhte Tumorbildung.
Reproduktionstoxizität
Begrenzte Studien zur intraperitonealen Injektion bei Mäusen deuten auf ein potenzielles Missbildungsrisiko bei hohen Dosen (≥ 55,5 mg/kg/Tag) während der Schwangerschaft hin. Allerdings schränken der Expositionsweg und die Tierbelastung die Aussagekraft dieser Ergebnisse ein.
Referenzen
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- Phthalic anhydride (PA): a valuable substrate in organic transformations. – https://pubs.rsc.org/en/content/articlehtml/2023/ra/d3ra03378c
- Process for the production of phthalic anhydride. – https://patents.google.com/patent/US4435580A/en




