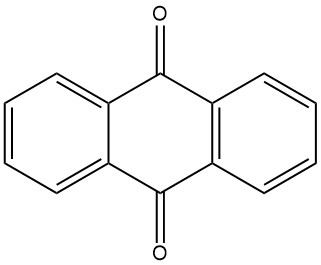
Anthrachinon ist ein gelber, kristalliner Feststoff, der bei Raumtemperatur in Wasser und organischen Lösungsmitteln nahezu unlöslich ist. Seine Löslichkeit nimmt mit der Temperatur zu. Anthrachinon wird als Vorstufe bei der Herstellung einer Vielzahl von Farbstoffen sowie als Katalysator bei der Zellstoffherstellung verwendet.
Anthrachinon wurde erstmals 1835 synthetisiert, seine zentrale Rolle in der Farbstoffindustrie wurde jedoch erst 1868 erkannt. Seitdem hat sich die Anthrachinonchemie rasant ausgeweitet, was zur Entwicklung neuartiger Beizfarbstoffe, Säurefarbstoffe, Küpenfarbstoffe, Dispersionsfarbstoffe und Reaktivfarbstoffe geführt hat Farbstoffe.
In den letzten Jahrzehnten hat die Anthrachinonindustrie einen globalen Wandel erlebt. Um der wachsenden Nachfrage nach Anthrachinon gerecht zu werden, wurden neue Syntheseverfahren entwickelt und die Verarbeitungsmethoden effizienter und umweltfreundlicher gestaltet.
Eine der bahnbrechendsten Anwendungen von Anthrachinon ist seine Verwendung als Katalysator beim alkalischen Holzzellstoff. Dieser Zweig der Anthrachinonchemie entwickelt sich rasant und hat das Potenzial, die Anforderungen der Farbstoffindustrie zu übertreffen.
Die Nachfrage nach Anthrachinon ist seit 1870 stetig gestiegen, und der aktuelle jährliche Bedarf übersteigt 30.000 Tonnen.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Anthrachinon
Die physikalischen Eigenschaften von Anthrachinon sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | 84-65-1 |
| Chemische Formel | C14H8O2 |
| Molmasse | 208,20 g/mol |
| Aussehen | Kristallines Anthrachinon ist zarte, hellgelbe bis blassgelbe Nadeln. Wenn es fein verteilt oder aus Schwefelsäure ausgefällt wird, erscheint es fast farblos. |
| Schmelzpunkt | 287°C |
| Siedepunkt | 377°C |
| Kristallklasse | Monoklin |
| Space-Gruppe | P 21/a |
| Einheitszellenabmessungen |
|
| Kristalldichte |
|
| Dampfdruck |
|
| Molare Wärmekapazität bei konstantem Druck (cp) | 265 J mol−1 K−1 |
| Bildungsenthalpie | -179 kJ/mol |
| Verbrennungsenthalpie | 6449 kJ/mol bei 25°C |
| Schmelzenthalpie | 32,57 kJ/mol bei 287°C |
| Flammpunkt | 185°C |
| UV-Spektrum | Vier charakteristische Banden bei 251 nm (emax 54000), 279 nm (emax 17600), 321 nm (emax 4800) und 377 nm (emax 110), die jeweils eine ausgeprägte Schwingungsstruktur aufweisen. |
| IR-Spektrum | Sehr wenige Banden, hauptsächlich mit einer bemerkenswerten Bande bei nC=O = 1680 cm−1 aufgrund der hohen Symmetrie der Verbindung. |
| Löslichkeit |
|
| Andere |
|
2. Chemische Reaktionen von Anthrachinon
2.1. Oxidation
- Anthrachinon ist unter normalen Bedingungen oxidationsstabil, kann jedoch unter rauen Bedingungen mit Natriumhydroxid und Natriumchlorat zu Alizarin oxidiert werden.
- Anthrachinon kann mit konzentrierter Schwefelsäure und Borsäure, Persulfaten oder Metaarsensäure bei Temperaturen über 200 °C zu Polyhydroxyanthrachinonen oxidiert werden.
- Abhängig von seinem SO3-Gehalt kann Oleum auch zur Oxidation von Anthrachinon zu Polyhydroxyanthrachinonen bei niedrigeren Temperaturen verwendet werden.
- Konzentrierte Salpetersäure oxidiert Anthrachinon nicht, sondern nitriert es. Einige Mischungen aus Anthrachinon und Salpetersäure können explosiv sein.
2.2. Die Ermäßigung
- Anthrachinon kann mit üblichen Reduktionsmitteln oder Wasserstoff in Gegenwart eines Katalysators zu Anthrahydrochinon reduziert werden.
- Natriumhyposulfit in einer alkalischen Lösung reduziert Anthrachinon zu einem blutroten Natriumsalz von Anthrahydrochinon, das sich in einer sauren Lösung zu seinem tautomeren Oxanthron umlagern kann.
- Stärkere Reduktionsmethoden wie Zinnsalzsäure oder katalytische Hydrierung unter hohem Druck oder hoher Temperatur ergeben Anthron, das im Gleichgewicht mit seinem Tautomer Anthrol (9-Hydroxyanthracen) vorliegt und sich anschließend in Anthracen und Hydroanthracen umwandelt.
- Bei Verwendung von Zink oder Natriumhydroxid entsteht durch Dimerisierung Dianthranol.
- Unter bestimmten Reaktionsbedingungen kann der Reduktionsprozess gezielt auf die beiden äußeren Kerne gerichtet werden, was zur Bildung von 1,2,3,4-Tetrahydroanthrachinon oder Octahydroanthrachinon führt.
2.3. Kondensation
Anthrachinon kann mit Glycerin, Eisenpulver und Schwefelsäure zu Benzanthron kondensiert werden.
2.4. Chlorierung
- Anthrachinon kann in Oleum vor allem an der Alpha-Position chloriert werden.
- Durch Erhitzen von Anthrachinon mit Antimonpentachlorid oder ähnlichen Chlor freisetzenden Reagenzien entstehen chlorierte Produkte, die von Monochloranthrachinon bis Perchloranthrachinon reichen.
2.5. Sulfonierung und Hydroxylierung
- Schwefelsäure oder Oleum können Anthrachinon sulfonieren und/oder hydroxylieren.
- Konzentrierte Schwefelsäure sulfoniert hauptsächlich Anthrachinon über 200 °C.
- Oleum wird typischerweise zur Sulfonierung von Anthrachinon bei Temperaturen zwischen 140 °C und 160 °C verwendet, wobei wichtige Reaktionsprodukte entstehen, darunter β-Sulfonsäuren wie Anthrachinon-2-sulfonsäure, Anthrachinon-2,6-disulfonsäure und Anthrachinon-2,7 -Disulfonsäure.
- In Gegenwart von Quecksilber erfolgt die Sulfonierung überwiegend an der Alpha-Position und es entstehen Anthrachinon-1-sulfonsäure, Anthrachinon-1,5-disulfonsäure und Anthrachinon-1,8-disulfonsäure.
2.6. Nitrierung
- Die Nitrierung von Anthrachinon erfordert strenge Bedingungen, wobei hauptsächlich Alpha-Nitroanthrachinone neben unterschiedlichen Anteilen an Beta-Nitro- und Alpha,Beta-Dinitroanthrachinonen entstehen.
- Es finden sowohl Mono- als auch Dinitrierungsprozesse statt, die oft zu unreinen Nitrierungsprodukten führen, die eine umfangreiche Aufbereitung zur Auftrennung in 1-Nitroanthrachinon, 1,5-Dinitroanthrachinon und 1,8-Dinitroanthrachinon erfordern.
3. Industrielle Produktion von Anthrachinon
Bei der industriellen Herstellung von Anthrachinon kommen mehrere Verfahren zum Einsatz. Die gebräuchlichste Methode ist die Dampfphasenoxidation von Anthracen mit Luft. Aufgrund der Knappheit von Anthracen gewinnen jedoch auch das Naphthalinverfahren und die Synthese aus Phthalsäureanhydrid und Benzol an Bedeutung.
1. Oxidation von Anthracen
Anthrachinon wird traditionell aus Anthracen synthetisiert, das aus Kohlenteer gewonnen wird. Bei diesem Verfahren wird Anthracen mit Chromsäure in einer Lösung aus 48 %iger Schwefelsäure oxidiert. Das Nebenprodukt Chrom(III)sulfat muss zu Gerbstoffen verarbeitet werden. Diese Methode erfordert hochreines Anthracen mit einer Reinheit von mindestens 94 %.
2. Dampfphasenoxidation von Anthracen
Ungefähr 85 % der weltweiten Anthrachinonproduktion beruht auf der Dampfphasenoxidation von Anthracen mithilfe von Luft. Allerdings hat die rückläufige Anthracenproduktion zu einer Versorgungsknappheit geführt, was den Naphthalinprozess begünstigt. Naphthalin ist in Kohlenteer leicht verfügbar und kann auch aus Rückstandsölen aus der Benzinreformierung gewonnen werden.
3. Naphthalin-Prozess
Dieses Verfahren wird in Japan von Kawasaki und in Europa von Bayer eingesetzt. Dabei handelt es sich um eine dreistufige Synthese von Anthrachinon:
- Naphthochinon wird durch Dampfphasenoxidation von Naphthalin mit Luft hergestellt.
- Butadien wird in einer Diels-Alder-Reaktion mit dem Naphthochinon eingeführt.
- Das resultierende Tetrahydroanthrachinon wird einer Oxidehydrierung unterzogen.
- Bei diesem Prozess entsteht Phthalsäureanhydrid als Nebenprodukt.
4. Synthese aus Phthalsäureanhydrid und Benzol
In Regionen, in denen Anthracen nicht ausreichend aus Steinkohlenteer verfügbar ist, kann Anthrachinon aus Phthalsäureanhydrid und Benzol synthetisiert werden. Bei diesem Verfahren werden pro Tonne Anthrachinon etwa 1,4 Tonnen Aluminiumchlorid und 4 bis 6 Tonnen Schwefelsäure eingesetzt.
Aufgrund der Knappheit von Anthracen hat es erneut an Bedeutung gewonnen. Die Verfügbarkeit von kostengünstigem Phthalsäureanhydrid in ausreichenden Mengen, erreicht durch die wirtschaftliche Oxidation von Naphthalin oder o-Xylol mit Luft, hat zum Wiederaufleben dieser Syntheseroute beigetragen.
5. Styrol-Dimerisierungsprozess
Anfang der 1970er Jahre führte BASF ein weiteres faszinierendes Verfahren zur Herstellung von Anthrachinon ein. Diese Methode beginnt mit der Dimerisierung von Styrol zu 1-Methyl-3-phenylindan, die durch einen Säurekatalysator erleichtert wird. Anschließend wird 1-Methyl-3-phenylindan in der Dampfphase durch Oxidation mit Luft in Anthrachinon umgewandelt.
3.1. Oxidation von Anthracen mit Chromsäure
Die industrielle Herstellung von Anthrachinon durch Chromsäureoxidation ist ein etablierter und effizienter Prozess. Es ist relativ kostengünstig und kann im Batch-Betrieb durchgeführt werden.
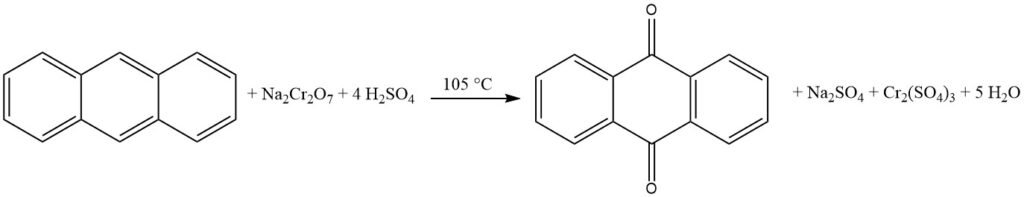
Der Prozess beginnt mit der Herstellung einer Anthracenpaste, indem reines Anthracen (Reinheit 94–95 %) fein pulverisiert und in einem Rührgefäß mit Wasser und einem Netzmittel vermischt wird. Anschließend wird die Anthracenpaste durch abwechselnde Zugabe von 48 %iger Schwefelsäure und 20 %iger Natriumdichromatlösung oxidiert. Die Reaktion wird kontrolliert, um übermäßige Schaumbildung und Temperaturanstieg zu vermeiden.
Nachdem die Oxidation abgeschlossen ist, wird die Reaktionsmischung filtriert und das filtrierte Material gewaschen und in Wasser suspendiert. Das rohe Anthrachinonprodukt wird dann filtriert und weist eine Reinheit von etwa 95 % auf. Das Rohanthrachinon kann durch Trocknung oder Umkristallisation weiterverarbeitet werden, um einen Reinheitsgrad von bis zu 99 % zu erreichen.
Dieser Prozess wird häufig mit der Herstellung von Gerbstoffen kombiniert, da hier nur minimale Kosten für das Oxidationsmittel anfallen.
3.2. Dampfphasenoxidation von Anthracen mit Luft
Die Dampfphasenoxidation von Anthracen mit Luft ist eine effiziente und gut kontrollierte Methode zur Herstellung von hochreinem Anthrachinon.
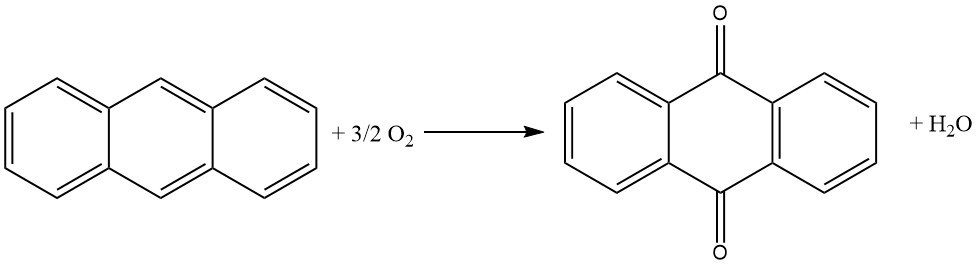
Es basiert auf der Verwendung von Katalysatoren, die denen ähneln, die bei der Oxidation von Naphthalin oder o-Xylol zu Phthalsäureanhydrid verwendet werden. Das Verfahren zeichnet sich durch eine hohe Anthracenumwandlung, minimale Nebenproduktbildung und hohe Produktreinheit aus.
Der Prozess beginnt mit der Verdampfung von Anthracen mithilfe eines vorgewärmten Luft-Wasserdampf-Gemisches. Anschließend wird der Gasstrom vorsichtig mit zusätzlicher Luft vermischt, um eine Explosionsgefahr zu vermeiden. Diese Mischung wird dann von unten in einen katalytischen Ofen geleitet, wo die Temperatur kontrolliert wird.
Der Katalyseofen besteht aus 1400 Litern schichtweise angeordnetem Katalysatormaterial. Der untere Teil, in dem die Reaktion stattfindet, wird auf 390 °C abgekühlt, während der obere Teil auf 339 °C erhitzt wird. Der Katalysator ist typischerweise Eisenvanadat, hergestellt aus Ammoniumvanadat und Eisen(III)-chlorid.
Die den Katalyseofen verlassenden Gase werden verschiedenen Kühl- und Filterstufen unterzogen, um das Anthrachinonprodukt von den Nebenproduktgasen zu trennen.
Der in diesem Verfahren verwendete Eisenvanadat-Katalysator wird durch Auflösen von rotem Eisen(III)-oxid in Salzsäure und Wasser hergestellt. Anschließend wird diese Lösung mit Ammoniumvanadat in Wasser vermischt und ausgefällt. Die resultierende Lösung wird in einer beheizbaren Kugelmühle auf Bimsstein eingedampft und anschließend kalziniert. Der resultierende Katalysator sollte eine gelbbraune Farbe haben.
Im Laufe der Zeit kann die Aktivität des Katalysators abnehmen, was zu einem Rückgang der Anthrachinon-Ausbeute und einem Anstieg der Phthalsäureanhydrid-Produktion führt. Um die Aktivität des Katalysators aufrechtzuerhalten oder zu reaktivieren, kann der Oxidationsluft eine kleine Menge Ammoniak zugesetzt oder der erschöpfte Katalysator mit einer verdünnten Alkalilösung gewaschen werden.
Dieses Verfahren liefert Anthrachinon mit einer hohen Reinheit von 99 %.
3.3. Naphthalin-Prozess
Das von Kawasaki Kasei Chemicals entwickelte Naphthalin-Verfahren ist ein dreistufiges Verfahren zur Herstellung von Anthrachinon aus Naphthalin.
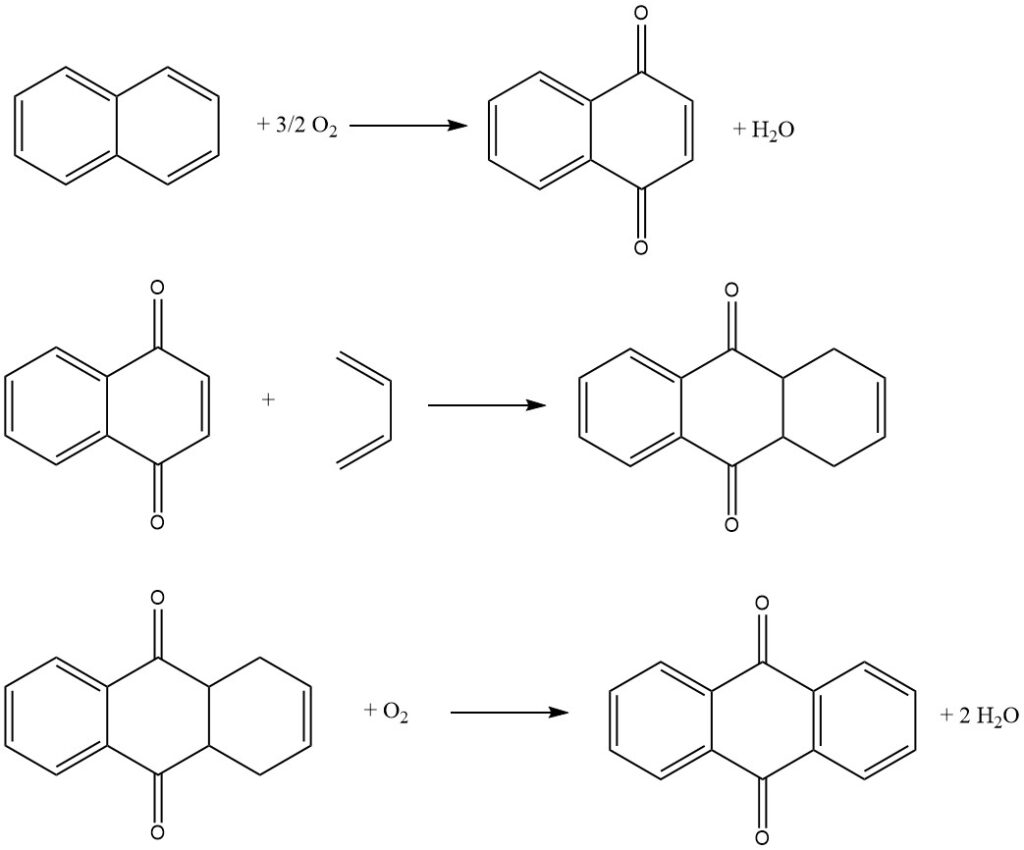
Schritt 1: Naphthalin-Oxidation
Im ersten Schritt wird Naphthalin mit Luft an einem Vanadiumpentoxid-Katalysator oxidiert, um Naphthochinon und Phthalsäureanhydrid zu erzeugen. Die Reaktion wird in der Gasphase bei hoher Temperatur durchgeführt.
Schritt 2: Diels-Alder-Reaktion mit Butadien
Im zweiten Schritt wird Naphthochinon mit Butadien in einer Diels-Alder-Reaktion zu Tetrahydroanthrachinon umgesetzt. Die Reaktion wird in flüssiger Phase unter Verwendung eines organischen Lösungsmittels wie Xylol oder Tetrahydroanthrachinon durchgeführt.
Schritt 3: Oxydehydrierung von Tetrahydroanthrachinon
Im dritten Schritt wird Tetrahydroanthrachinon mit Luft zu Anthrachinon oxidiert. Die Reaktion wird in wässriger Phase unter Verwendung eines alkalischen Katalysators durchgeführt.
Rückgewinnung von Phthalsäureanhydrid
Das im ersten Schritt erzeugte Phthalsäureanhydrid kann durch Kristallisation und Filtration aus der wässrigen Lösung zurückgewonnen werden.
Bayers Variante des Naphthalin-Prozesses
Bayers Variante des Naphthalin-Verfahrens unterscheidet sich vom Kawasaki-Kasei-Verfahren in folgenden Punkten:
- Die Naphthalinoxidation wird mit einer Mischung aus Luft und recyceltem Reaktionsgas durchgeführt.
- Die Diels-Alder-Reaktion mit Butadien wird ohne Reinigung der Naphthalin-Oxidationsprodukte durchgeführt.
- Das Tetrahydroanthrachinon wird in Gegenwart von Naphthalin zu Anthrachinon oxidiert.
- Anthrachinon und Phthalsäureanhydrid werden durch fraktionierte Destillation getrennt.
3.4. Synthese aus Phthalsäureanhydrid und Benzol
Die Synthese von Anthrachinon aus Phthalsäureanhydrid und Benzol ist ein zweistufiger Prozess:
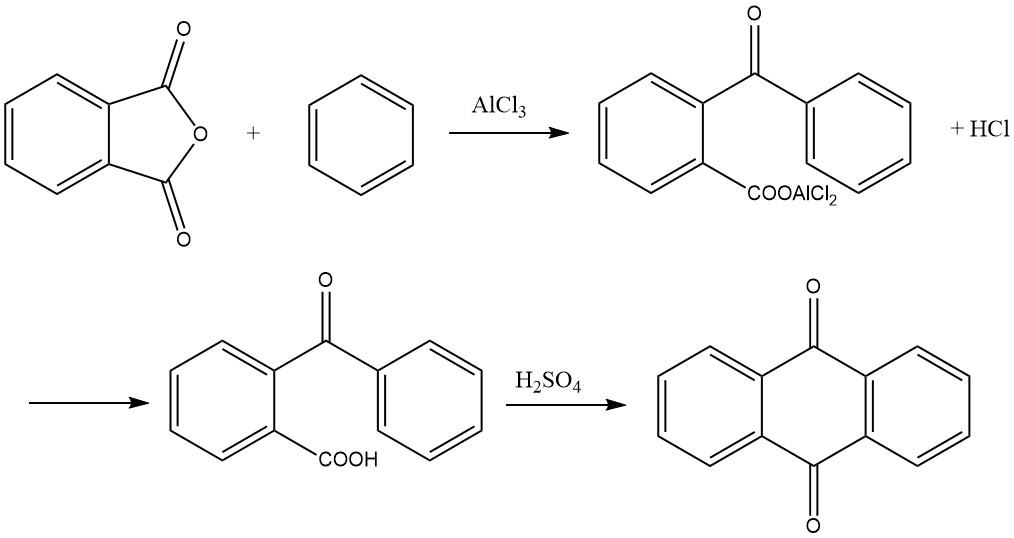
1. Bildung von o-Benzoylbenzoesäure
Im ersten Schritt wird o-Benzoylbenzoesäure durch eine Friedel-Crafts-Acylierung unter Verwendung von Phthalsäureanhydrid und Benzol als Ausgangsmaterialien gebildet. Bei dieser Reaktion entsteht als Primärprodukt ein Aluminiumchloridkomplex der o-Benzoylbenzoesäure, der sich im Reaktionsgefäß verfestigen kann.
Um dieses Problem anzugehen, wurden verschiedene Methoden vorgeschlagen, darunter:
- Durchführung der Reaktion mit überschüssigem Benzol, um Ausbeuten von über 95 % zu erzielen.
- Durchführung der Reaktion in einem lösungsmittelfreien Verfahren in Kugelmühlen unter Verwendung von Ethylenglykol oder 1,4-Butandiol, um das Verfestigungsproblem zu mildern und den erforderlichen Benzolüberschuss zu reduzieren.
Die Reaktion läuft typischerweise mit einem Molverhältnis von 1:1:2 für Phthalsäureanhydrid, Benzol und Aluminiumchlorid ab. Sie findet bei Temperaturen unter 45 °C statt und erzeugt als Nebenprodukt Chlorwasserstoff. Während der Reaktion kommt es zu starker Schaumbildung, wodurch sich das Volumen um ein Vielfaches erhöht, was bei der Bemessung der Ausgangsmenge berücksichtigt werden muss.
Der Abschluss der Reaktion wird angezeigt, wenn 1 Mol Chlorwasserstoff pro Mol Phthalsäureanhydrid entstanden ist. Das resultierende Reaktionsprodukt wird dann in eine verdünnte Säurelösung gegeben, wobei o-Benzoylbenzoesäure ausfällt. Dieser Niederschlag wird abgetrennt, gewaschen und getrocknet und ergibt mehr als 95 % des gewünschten Produkts.
2. Cyclisierung zu Anthrachinon
Im zweiten Schritt kann o-Benzoylbenzoesäure weiter zu Anthrachinon umgewandelt werden. Während es möglich ist, mit dem im ersten Schritt gebildeten Aluminiumchloridkomplex zu beginnen und 1 Mol Chlorwasserstoff durch Erhitzen auf 200 °C zu Anthrachinon abzuspalten, besteht die in der Praxis bevorzugte Methode darin, die getrocknete o-Benzoylbenzoesäure mit Schwefelsäure zu kondensieren .
Die Säure wird in etwa dem Drei- bis Vierfachen ihres Gewichts in 95–98 %iger Schwefelsäure gelöst und auf eine Temperatur von 115 bis 140 °C erhitzt. Die Dauer des Erhitzens hängt von Faktoren wie der Menge und Konzentration der Schwefelsäure sowie der Temperatur ab.
Sobald die Reaktion abgeschlossen ist, fällt bei Zugabe von Wasser Anthrachinon aus, das anschließend filtriert und getrocknet werden kann. Alternativ kann ein Teil des Produkts durch direktes Abkühlen der Schwefelsäurelösung in grob kristallisierter Form erhalten werden. Die Ausbeute in diesem Schritt ist nahezu quantitativ.
Die Kondensationslösung kann auch direkt zur Herstellung von Benzanthron- oder Anthrachinonsulfonsäuren genutzt werden.
3.5. Styrolprozess
Das von der BASF entwickelte Styrolverfahren ist ein mehrstufiges Verfahren zur Herstellung von Anthrachinon aus Styrol. Es handelt sich um eine effiziente und vielseitige Methode, die hochreines Anthrachinon liefert.
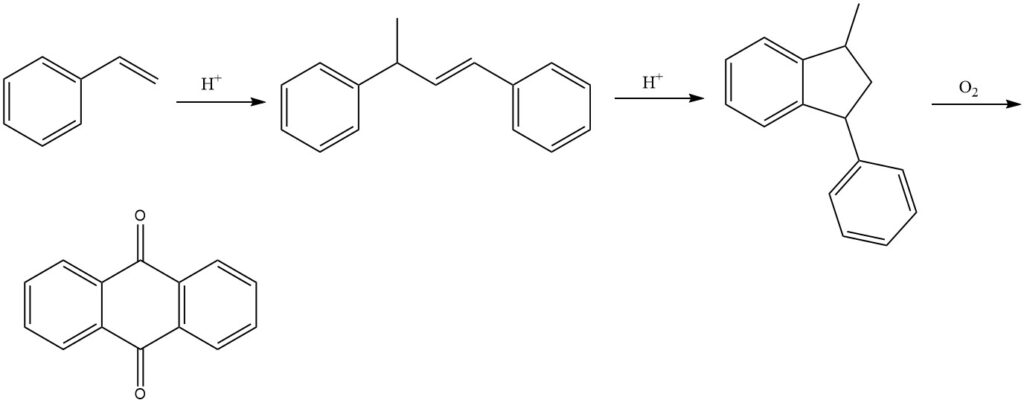
Der Prozess beginnt mit der Dimerisierung von Styrol in Gegenwart saurer Katalysatoren zur Herstellung von 1,3-Diphenyl-2-buten. Anschließend erfolgt die Cyclisierung von 1,3-Diphenyl-2-buten zu 1-Methyl-3-phenylindan. Schließlich wird 1-Methyl-3-phenylindan mit Luft in der Dampfphase oxidiert, um Anthrachinon herzustellen.
Im Oxidationsschritt können verschiedene Katalysatoren verwendet werden, beispielsweise Vanadiumverbindungen (hauptsächlich Vanadiumpentoxid), häufig in Kombination mit anderen Oxiden wie Thalliumoxid und Antimonoxid.
Das Styrolverfahren führt zu Ausbeuten des Endprodukts von etwa 77 %. Das ausgefallene Reaktionsprodukt kann jedoch noch Nebenprodukte enthalten, was eine weitere Reinigung zur endgültigen Isolierung von reinem Anthrachinon erforderlich macht.
4. Verwendung von Anthrachinon
Anthrachinon ist eine vielseitige und wichtige Chemikalie, die bei der Herstellung einer breiten Palette von Produkten verwendet wird, darunter Farbstoffe, Kunststoffe, Arzneimittel und Papier.
Farbstoffproduktion
Anthrachinon wird zur Herstellung einer breiten Palette von Farbstoffen verwendet, darunter Säurefarbstoffe, Basenfarbstoffe, Küpenfarbstoffe, Dispersionsfarbstoffe und Reaktivfarbstoffe. Diese Farbstoffe werden in einer Vielzahl von Branchen eingesetzt, darunter in der Textil-, Kunststoff- und Druckindustrie.
Kunststoffproduktion
Anthrachinon wird auch bei der Herstellung von Kunststoffen wie Polyethylenterephthalat (PET) und Polybutylenterephthalat (PBT) verwendet. Diese Kunststoffe werden in einer Vielzahl von Produkten verwendet, darunter Lebensmittelverpackungen, Getränkeflaschen und elektrische Komponenten.
Pharmazeutische Produktion
Anthrachinon wird auch bei der Herstellung von Arzneimitteln wie Abführmitteln und entzündungshemmenden Medikamenten verwendet.
Papierproduktion
Anthrachinon wird in der Papierindustrie als Redoxkatalysator verwendet, um die alkalische Hydrolyse von polymerem Lignin zu erleichtern. Dies führt zu einer höheren Fruchtfleischausbeute und einer kürzeren Garzeit.
Andere Anwendungen
Anthrachinon wird auch in einer Vielzahl anderer Anwendungen eingesetzt, beispielsweise zur Herstellung von Vergällungsmitteln zum Saatgutschutz, zur Modifizierung von Standölen und zur Verbesserung des Kolophoniums.
Aktuelle Trends
In den letzten Jahren kam es aufgrund von Umweltbedenken zu einer Verlagerung der Produktion von Anthrachinonfarbstoffen von Sulfonsäuren hin zu Nitroverbindungen. Beim Sulfonsäureverfahren fallen große Mengen Abwasser an, während das Nitroverbindungsverfahren effizienter ist und weniger Abfall produziert.
5. Anthrachinon-Toxikologie
Anthrachinon ist eine relativ ungiftige Chemikalie. Es gilt als biologisch inert, das heißt, es ist in biologischen Systemen inaktiv. Dies ist wahrscheinlich auf seine geringe Löslichkeit sowohl in Wasser als auch in Lipiden zurückzuführen.
Für Anthrachinon liegen keine toxikologischen Daten vor, aber Studien haben gezeigt, dass es die Augen weniger reizt als Benzochinon und ein ähnliches Maß an Inertheit wie inerter Staub aufweist.
Für Anthrachinon im beruflichen Bereich wird ein MAK-Wert von 10 mg/m3 empfohlen. Das bedeutet, dass Anthrachinonstaub als gering gesundheitsgefährdend einzustufen ist.
Referenz
- Anthraquinone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_347

