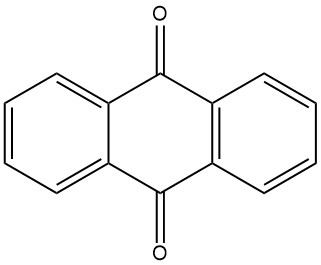
L’anthraquinone est un solide cristallin jaune presque insoluble dans l’eau et les solvants organiques à température ambiante. Sa solubilité augmente avec la température. L’anthraquinone est utilisée comme précurseur dans la production d’une large gamme de colorants, ainsi que comme catalyseur dans la fabrication de la pâte à papier.
L’anthraquinone a été synthétisée pour la première fois en 1835, mais son rôle central dans l’industrie des colorants n’a été réalisé qu’en 1868. Depuis lors, la chimie de l’anthraquinone s’est développée rapidement, conduisant au développement de nouveaux colorants mordants, colorants acides, colorants en cuve, colorants dispersés et réactifs. colorants.
Au cours des dernières décennies, l’industrie de l’anthraquinone a connu une transformation mondiale. De nouvelles procédures de synthèse ont été développées pour répondre à la demande croissante d’anthraquinone, et les méthodes de traitement ont évolué pour devenir plus efficaces et plus respectueuses de l’environnement.
L’une des applications les plus révolutionnaires de l’anthraquinone est son utilisation comme catalyseur dans la fabrication de pâte à papier alcaline. Cette branche de la chimie des anthraquinones se développe rapidement et a le potentiel de dépasser les demandes de l’industrie des colorants.
La demande d’anthraquinone n’a cessé d’augmenter depuis 1870 et la demande annuelle actuelle dépasse 30 000 tonnes.
Table des matières
1. Propriétés physiques de l’anthraquinone
Les propriétés physiques de l’anthraquinone sont répertoriées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Numéro CAS | 84-65-1 |
| Formule chimique | C14H8O2 |
| Masse molaire | 208,20 g/mol |
| Apparence | L'anthraquinone cristalline est constituée d'aiguilles délicates, jaune clair à jaune pâle. Lorsqu'il est finement divisé ou précipité à partir de l'acide sulfurique, il apparaît presque incolore. |
| Point de fusion | 287°C |
| Point d'ébullition | 377°C |
| Classe de cristal | Monoclinique |
| Groupe d'espace | P 21/a |
| Dimensions des cellules unitaires |
|
| Densité cristalline |
|
| Pression de vapeur |
|
| Capacité thermique molaire à pression constante (cp) | 265 J mol−1 K−1 |
| Enthalpie de formation | -179 kJ/mol |
| Enthalpie de combustion | 6 449 kJ/mol à 25 °C |
| Enthalpie de fusion | 32,57 kJ/mol à 287°C |
| Point d'éclair | 185°C |
| Spectre UV | Quatre bandes distinctes à 251 nm (emax 54 000), 279 nm (emax 17 600), 321 nm (emax 4 800) et 377 nm (emax 110), chacune présentant une structure vibratoire prononcée. |
| Spectre IR | Très peu de bandes, comportant principalement une bande notable à nC=O = 1 680 cm−1 en raison de la haute symétrie du composé. |
| Solubilité |
|
| Autre |
|
2. Réactions chimiques de l’anthraquinone
2.1. Oxydation
- L’anthraquinone est stable à l’oxydation dans des conditions normales, mais peut être oxydée en alizarine dans des conditions difficiles avec l’hydroxyde de sodium et le chlorate de sodium.
- L’anthraquinone peut être oxydée en polyhydroxyanthraquinones avec de l’acide sulfurique concentré et de l’acide borique, des persulfates ou de l’acide métaarsenique à des températures supérieures à 200°C.
- L’oléum peut également être utilisé pour oxyder l’anthraquinone en polyhydroxyanthraquinones à des températures plus basses, en fonction de sa teneur en SO3.
- L’acide nitrique concentré n’oxyde pas l’anthraquinone, mais la nitrate. Certains mélanges d’anthraquinone et d’acide nitrique peuvent être explosifs.
2.2. Réduction
- L’anthraquinone peut être réduite en anthrahydroquinone avec des agents réducteurs courants ou de l’hydrogène en présence d’un catalyseur.
- L’hyposulfite de sodium dans une solution alcaline réduit l’anthraquinone en un sel de sodium rouge sang d’anthrahydroquinone, qui peut se réorganiser en son tautomère oxanthrone dans une solution acide.
- Des méthodes de réduction plus vigoureuses, telles que l’étain- acide chlorhydrique ou l’hydrogénation catalytique sous haute pression ou température, produisent de l’anthrone, qui existe en équilibre avec son anthrol tautomère (9-hydroxyanthracène) et se transforme ensuite en anthracène et hydroanthracène.
- Lorsque du zinc ou de l’hydroxyde de sodium sont utilisés, le dianthranol est produit par dimérisation.
- Dans certaines conditions de réaction, le processus de réduction peut être dirigé spécifiquement vers les deux noyaux externes, conduisant à la formation de 1,2,3,4-tétrahydroanthraquinone ou octahydroanthraquinone.
2.3. Condensation
L’anthraquinone peut être condensée avec du glycérol, de la poudre de fer et de l’acide sulfurique pour produire de la benzanthrone.
2.4. Chloration
- L’anthraquinone peut être chlorée dans l’oléum, principalement en position alpha.
- Le chauffage de l’anthraquinone avec du pentachlorure d’antimoine ou des réactifs libérant du chlore similaires donne des produits chlorés allant de la monochloroanthraquinone à la perchloroanthraquinone.
2.5. Sulfonation et hydroxylation
- L’acide sulfurique ou l’oléum peuvent sulfoner et/ou hydroxyler l’anthraquinone.
- L’acide sulfurique concentré sulfonate principalement l’anthraquinone au-dessus de 200°C.
- L’oléum est généralement utilisé pour sulfoner l’anthraquinone à des températures comprises entre 140 °C et 160 °C, produisant des produits de réaction majeurs, notamment des acides β-sulfoniques comme l’acide anthraquinone-2-sulfonique, l’acide anthraquinone-2,6-disulfonique et l’anthraquinone-2,7. -acide disulfonique.
- En présence de mercure, la sulfonation se produit principalement en position alpha, produisant de l’acide anthraquinone-1-sulfonique, de l’acide anthraquinone-1,5-disulfonique et de l’acide anthraquinone-1,8-disulfonique.
2.6. Nitration
- La nitration de l’anthraquinone nécessite des conditions rigoureuses, aboutissant principalement à des alpha-nitroanthraquinones ainsi qu’à des proportions variables de bêta-nitro et d’alpha, bêta-dinitroanthraquinones.
- Des processus de mono- et de dinitration se produisent, donnant souvent des produits de nitration impurs qui nécessitent un traitement approfondi pour être séparés en 1-nitroanthraquinone, 1,5-dinitroanthraquinone et 1,8-dinitroanthraquinone.
3. Production industrielle d’anthraquinone
Plusieurs procédés sont utilisés dans la production industrielle de l’anthraquinone. La méthode la plus courante est l’oxydation de l’anthracène en phase vapeur à l’aide d’air. Cependant, le procédé au naphtalène et la synthèse à partir de l’anhydride phtalique et du benzène gagnent également en importance en raison de la rareté de l’anthracène.
1. Oxydation de l’anthracène
L’anthraquinone est traditionnellement synthétisée à partir de l’anthracène, obtenu à partir du goudron de houille. Ce processus implique l’oxydation de l’anthracène avec de l’acide chromique dans une solution d’acide sulfurique à 48 %. Le sous-produit sulfate de chrome (III) doit être transformé en agents de bronzage. Cette méthode nécessite de l’anthracène de haute pureté avec une pureté minimale de 94 %.
2. Oxydation en phase vapeur de l’anthracène
Environ 85 % de la production mondiale d’anthraquinone repose sur l’oxydation de l’anthracène en phase vapeur à l’aide de l’air. Cependant, la baisse de la production d’anthracène a entraîné une pénurie d’approvisionnement, favorisant le procédé au naphtalène. Le naphtalène est facilement disponible dans le goudron de houille et peut également être extrait des huiles résiduelles obtenues lors du reformage de l’essence.
3. Processus au naphtalène
Ce procédé est employé au Japon par Kawasaki et en Europe par Bayer. Il s’agit d’une synthèse de l’anthraquinone en trois étapes :
- La naphtoquinone est préparée par oxydation en phase vapeur du naphtalène avec de l’air.
- Le butadiène est introduit dans une réaction de Diels-Alder avec la naphtoquinone.
- La tétrahydroanthraquinone résultante est soumise à une oxydéshydrogénation.
Ce processus génère de l’anhydride phtalique comme sous-produit.
4. Synthèse à partir d’anhydride phtalique et de benzène
Dans les régions où l’anthracène n’est pas suffisamment disponible à partir du goudron de houille, l’anthraquinone peut être synthétisée à partir de l’anhydride phtalique et du benzène. Ce procédé implique l’utilisation d’environ 1,4 tonne de chlorure d’aluminium et de 4 à 6 tonnes d’acide sulfurique par tonne d’anthraquinone.
Il a acquis une importance renouvelée en raison de la rareté de l’anthracène. La disponibilité d’anhydride phtalique à faible coût en quantités suffisantes, obtenue grâce à l’oxydation économique du naphtalène ou de l’o-xylène avec l’air, a contribué à la résurgence de cette voie de synthèse.
5. Processus de dimérisation du styrène
Au début des années 1970, BASF a introduit un autre procédé de production d’anthraquinone fascinant. Cette méthode commence par la dimérisation du styrène en 1-méthyl-3-phénylindane, facilitée par un catalyseur acide. Ensuite, le 1-méthyl-3-phénylindane est transformé en anthraquinone en phase vapeur par oxydation avec l’air.
3.1. Oxydation de l’anthracène avec l’acide chromique
La production industrielle d’anthraquinone par oxydation de l’acide chromique est un procédé bien établi et efficace. Elle est relativement peu coûteuse et peut être réalisée par lots.
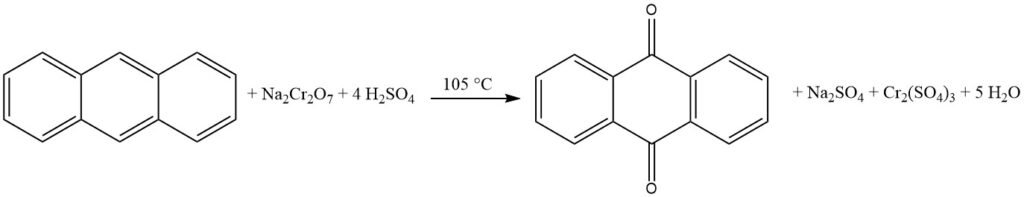
Le processus commence par la préparation d’une pâte d’anthracène en pulvérisant finement de l’anthracène pur (pureté de 94 à 95 %) et en le mélangeant avec de l’eau et un agent mouillant dans un récipient mélangeur. La pâte anthracénique est ensuite oxydée en ajoutant alternativement des portions d’acide sulfurique à 48 % et une solution de bichromate de sodium à 20 %. La réaction est contrôlée pour éviter un moussage excessif et une élévation de température.
Une fois l’oxydation terminée, le mélange réactionnel est filtré et le matériau filtré est lavé et mis en suspension dans l’eau. Le produit anthraquinone brut est ensuite filtré et présente une pureté d’environ 95 %. L’anthraquinone brute peut être ensuite traitée par séchage ou recristallisation pour atteindre un niveau de pureté allant jusqu’à 99 %.
Ce processus est souvent combiné à la production d’agents tannants, car il implique des dépenses minimes pour l’agent oxydant.
3.2. Oxydation en phase vapeur de l’anthracène avec l’air
L’oxydation en phase vapeur de l’anthracène avec l’air est une méthode efficace et bien contrôlée pour la production d’anthraquinone de haute pureté.
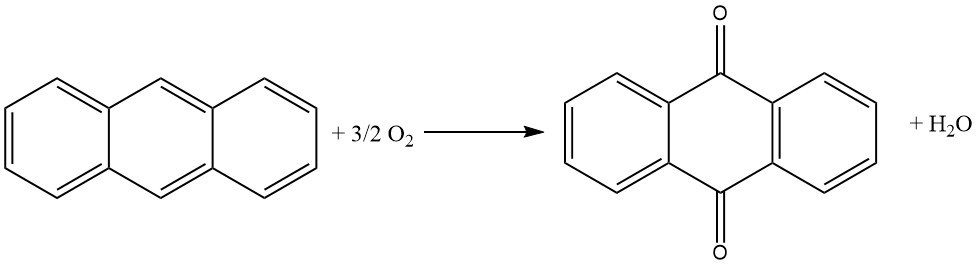
Elle repose sur l’utilisation de catalyseurs similaires à ceux utilisés dans l’oxydation du naphtalène ou de l’o-xylène en anhydride phtalique. Le procédé se caractérise par une conversion élevée de l’anthracène, une formation minimale de sous-produits et une pureté élevée du produit.
Le processus commence par l’évaporation de l’anthracène à l’aide d’un mélange air-vapeur d’eau préchauffé. Le flux de gaz est ensuite soigneusement mélangé à de l’air supplémentaire pour éviter tout risque d’explosion. Ce mélange est ensuite dirigé par le bas vers un four catalytique dont la température est contrôlée.
Le four catalytique est constitué de 1 400 litres de matériau catalyseur disposé en couches. La partie inférieure, où a lieu la réaction, est refroidie à 390°C, tandis que la partie supérieure est chauffée à 339°C. Le catalyseur est généralement du vanadate de fer, préparé à partir de vanadate d’ammonium et de chlorure de fer (III).
Les gaz sortant du four catalytique sont soumis à diverses étapes de refroidissement et de filtration pour séparer le produit anthraquinone des gaz sous-produits.
Le catalyseur au vanadate de fer utilisé dans ce procédé est préparé en dissolvant de l’oxyde de fer rouge (III) dans de l’acide chlorhydrique et de l’eau. Cette solution est ensuite mélangée avec du vanadate d’ammonium dans l’eau et précipitée. La solution résultante est évaporée sur de la pierre ponce dans un broyeur à boulets chauffant puis calcinée. Le catalyseur résultant doit avoir une couleur jaune-brun.
Au fil du temps, l’activité du catalyseur peut diminuer, entraînant une baisse du rendement en anthraquinone et une augmentation de la production d’anhydride phtalique. Pour maintenir ou réactiver l’activité du catalyseur, une petite quantité d’ammoniac peut être ajoutée à l’air d’oxydation, ou le catalyseur épuisé peut être lavé avec une solution alcaline diluée.
Ce procédé produit de l’anthraquinone d’une pureté élevée de 99 %.
3.3. Procédé au naphtalène
Le procédé au naphtalène, mis au point par Kawasaki Kasei Chemicals, est un procédé en trois étapes permettant de produire de l’anthraquinone à partir du naphtalène.
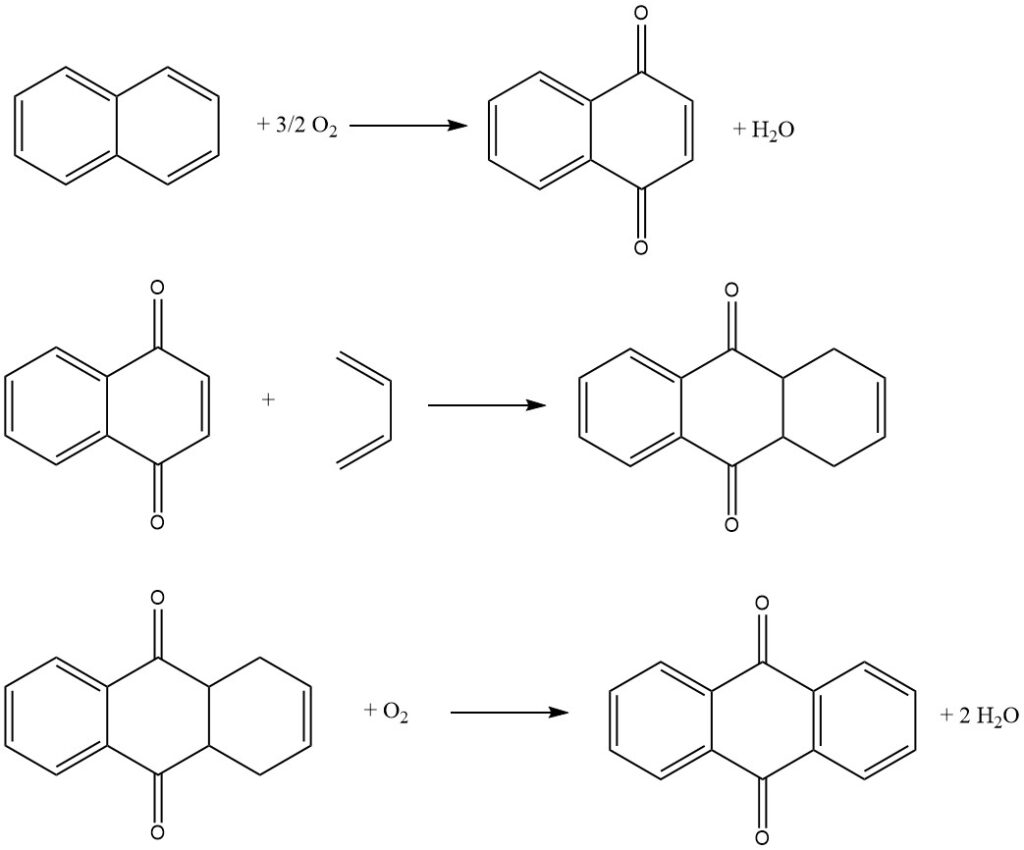
Étape 1 : Oxydation du naphtalène
Dans la première étape, le naphtalène est oxydé avec de l’air sur un catalyseur au pentoxyde de vanadium pour produire de la naphtoquinone et de l’anhydride phtalique. La réaction est conduite en phase gazeuse à haute température.
Étape 2 : Réaction de Diels-Alder avec le butadiène
Dans la deuxième étape, la naphtoquinone réagit avec le butadiène dans une réaction de Diels-Alder pour produire de la tétrahydroanthraquinone. La réaction est conduite en phase liquide en utilisant un solvant organique tel que le xylène ou la tétrahydroanthraquinone.
Étape 3 : Oxydéhydrogénation de la tétrahydroanthraquinone
Dans la troisième étape, la tétrahydroanthraquinone est oxydée avec l’air pour produire de l’anthraquinone. La réaction est conduite en phase aqueuse en utilisant un catalyseur alcalin.
Récupération d’anhydride phtalique
L’anhydride phtalique produit dans la première étape peut être récupéré de la solution aqueuse par cristallisation et filtration.
Variante Bayer du procédé au naphtalène
La variante Bayer du procédé au naphtalène diffère du procédé Kawasaki Kasei des manières suivantes :
- L’oxydation du naphtalène est réalisée avec un mélange d’air et de gaz réactionnel recyclé.
- La réaction de Diels-Alder avec le butadiène est réalisée sans purifier les produits d’oxydation du naphtalène.
- La tétrahydroanthraquinone est oxydéhydrogénée en anthraquinone en présence de naphtalène.
- L’anthraquinone et l’anhydride phtalique sont séparés par distillation fractionnée.
3.4. Synthèse à partir d’anhydride phtalique et de benzène
La synthèse de l’anthraquinone à partir de l’anhydride phtalique et du benzène se déroule en deux étapes :
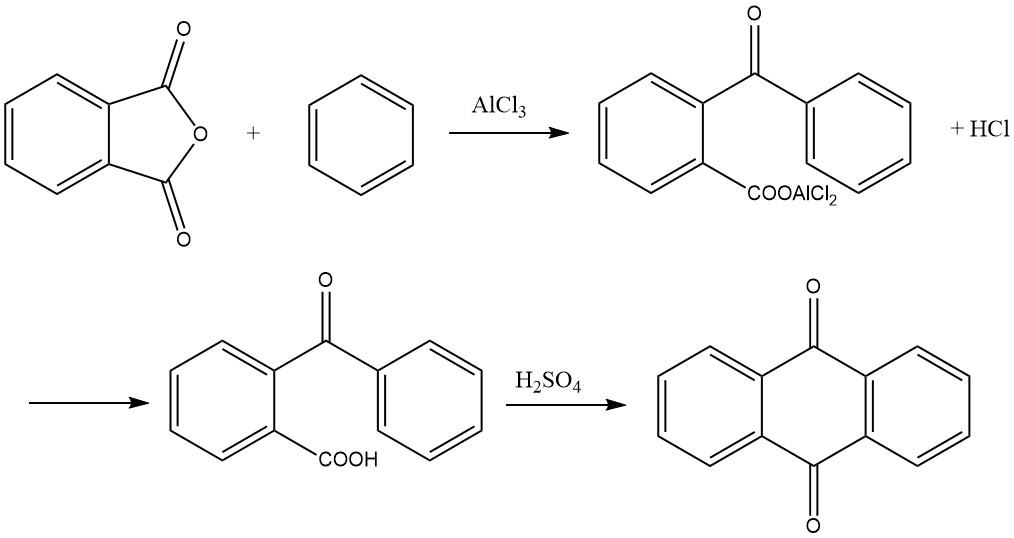
1. Formation d’acide o-benzoylbenzoïque
Dans la première étape, l’acide o-benzoylbenzoïque est formé par une acylation de Friedel-Crafts utilisant de l’anhydride phtalique et du benzène comme matières premières. Cette réaction produit un complexe de chlorure d’aluminium et d’acide o-benzoylbenzoïque comme produit primaire, qui peut se solidifier dans le récipient de réaction.
Pour résoudre ce problème, diverses méthodes ont été proposées, notamment :
- Réaliser la réaction avec un excès de benzène pour obtenir des rendements supérieurs à 95 %.
- Effectuer la réaction dans un processus sans solvant dans des broyeurs à boulets, en utilisant de l’éthylène glycol ou du 1,4-butanediol pour atténuer le problème de solidification et réduire l’excès requis de benzène.
La réaction se déroule généralement avec un rapport molaire de 1:1:2 pour l’anhydride phtalique, le benzène et le chlorure d’aluminium. Elle se produit à des températures inférieures à 45 °C et génère du chlorure d’hydrogène comme sous-produit. Un moussage important se produit au cours de la réaction, augmentant le volume plusieurs fois, ce qui doit être pris en compte lors de la mesure de la charge initiale.
La fin de la réaction est indiquée lorsque 1 mole de chlorure d’hydrogène par mole d’anhydride phtalique s’est dégagée. Le produit de réaction résultant est ensuite placé dans une solution acide diluée, précipitant l’acide o-benzoylbenzoïque. Ce précipité est séparé, lavé et séché, donnant plus de 95 % du produit souhaité.
2. Cyclisation en anthraquinone
Dans la deuxième étape, l’acide o-benzoylbenzoïque peut être davantage converti en anthraquinone. Bien qu’il soit possible de partir du complexe de chlorure d’aluminium formé lors de la première étape et de cliver 1 mole de chlorure d’hydrogène par chauffage à 200 °C pour donner de l’anthraquinone, la méthode préférée en pratique consiste à condenser l’acide o-benzoylbenzoïque séché avec de l’acide sulfurique. .
L’acide est dissous dans environ trois à quatre fois son poids dans de l’acide sulfurique à 95-98 % et chauffé à une température allant de 115 à 140 °C. La durée du chauffage dépend de facteurs tels que la quantité et la concentration de l’acide sulfurique ainsi que la température.
Une fois la réaction terminée, l’anthraquinone précipite lors de l’ajout d’eau et peut ensuite être filtrée et séchée. Alternativement, une partie du produit peut être obtenue sous forme grossièrement cristallisée en refroidissant directement la solution d’acide sulfurique. Le rendement de cette étape est presque quantitatif.
La solution de condensation peut également être directement utilisée pour la production d’acides benzanthrone ou anthraquinonesulfonique.
3.5. Processus au styrène
Le procédé au styrène, développé par BASF, est un procédé en plusieurs étapes permettant de produire de l’anthraquinone à partir du styrène. Il s’agit d’une méthode efficace et polyvalente qui produit de l’anthraquinone de haute pureté.
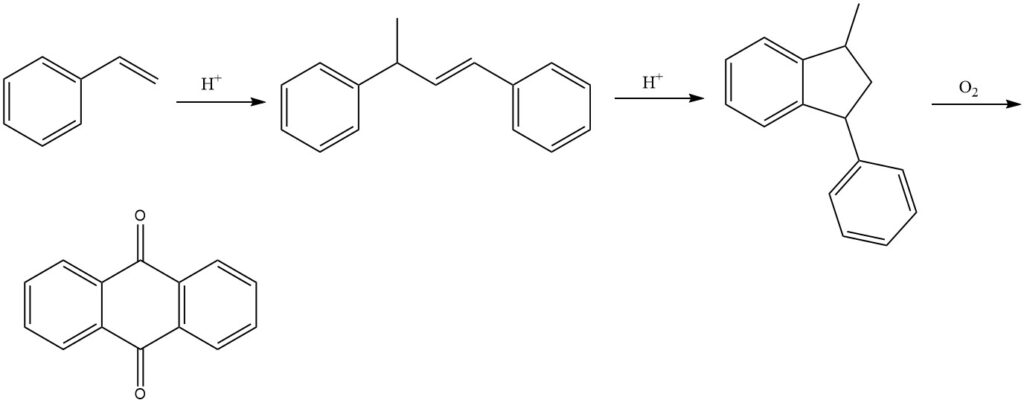
Le processus commence par la dimérisation du styrène en présence de catalyseurs acides pour produire du 1,3-diphényl-2-butène. Ceci est suivi par la cyclisation du 1,3-diphényl-2-butène pour former le 1-méthyl-3-phénylindane. Enfin, le 1-méthyl-3-phénylindane est oxydé avec de l’air en phase vapeur pour produire de l’anthraquinone.
Divers catalyseurs peuvent être utilisés dans l’étape d’oxydation, tels que les composés du vanadium (principalement le pentoxyde de vanadium), souvent en combinaison avec d’autres oxydes tels que l’oxyde de thallium et l’oxyde d’antimoine.
Le procédé au styrène donne des rendements d’environ 77 % pour le produit final. Cependant, le produit de réaction précipité peut encore contenir des sous-produits, nécessitant une purification plus poussée pour l’isolement final de l’anthraquinone pure.
4. Utilisations de l’anthraquinone
L’anthraquinone est un produit chimique polyvalent et important utilisé dans la production d’une large gamme de produits, notamment des colorants, des plastiques, des produits pharmaceutiques et du papier.
Production de colorants
L’anthraquinone est utilisée pour produire une large gamme de colorants, notamment des colorants acides, des colorants de base, des colorants de cuve, des colorants dispersés et des colorants réactifs. Ces colorants sont utilisés dans diverses industries, notamment le textile, le plastique et l’imprimerie.
Production de matières plastiques
L’anthraquinone est également utilisée dans la production de plastiques, tels que le polyéthylène téréphtalate (PET) et le polybutylène téréphtalate (PBT). Ces plastiques sont utilisés dans une variété de produits, notamment les emballages alimentaires, les bouteilles de boissons et les composants électriques.
Production pharmaceutique
L’anthraquinone est également utilisée dans la production de produits pharmaceutiques, tels que des laxatifs et des anti-inflammatoires.
Production de papier
L’anthraquinone est utilisée dans l’industrie papetière comme catalyseur redox pour faciliter l’hydrolyse alcaline de la lignine polymère. Cela entraîne une augmentation du rendement en pulpe et une réduction du temps de cuisson.
Autres applications
L’anthraquinone est également utilisée dans diverses autres applications, telles que la production de dénaturants pour la protection des semences, la modification des standolies et l’amélioration de la colophane.
Tendances récentes
Ces dernières années, la production de colorants anthraquinoniques a évolué des acides sulfoniques vers des composés nitro en raison de préoccupations environnementales. Le procédé à l’acide sulfonique génère de grandes quantités d’eaux usées, tandis que le procédé aux composés nitro est plus efficace et produit moins de déchets.
5. Toxicologie des anthraquinones
L’anthraquinone est un produit chimique relativement non toxique. Il est considéré comme biologiquement inerte, ce qui signifie qu’il est inactif dans les systèmes biologiques. Cela est probablement dû à sa faible solubilité dans l’eau et dans les lipides.
Il existe un manque de données toxicologiques disponibles sur l’anthraquinone, mais des études ont montré qu’elle est moins irritante pour les yeux que la benzoquinone et présente un niveau d’inertie similaire à celui des poussières inertes.
Une valeur MAK de 10 mg/m3 a été recommandée pour l’anthraquinone en milieu professionnel. Cela signifie que la poussière d’anthraquinone est considérée comme présentant un faible risque pour la santé.
Référence
- Anthraquinone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_347




