1. Friedel-Crafts acylation
L’acylation de Friedel-Crafts implique la production d’une cétone aromatique par la réaction entre un composé aromatique et un agent acylant, qui peut être un halogénure d’acyle, un anhydride d’acide, un acide ou un ester. Cette réaction a lieu en présence d’un catalyseur acide.
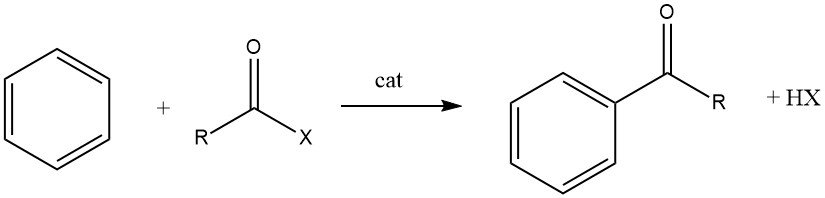
Table des matières
L’acylation de substrats aromatiques revêt une importance industrielle significative car elle est utilisée pour la synthèse d’intermédiaires aromatiques largement utilisés dans la fabrication de produits pharmaceutiques, d’insecticides, de plastifiants, de colorants, de parfums et de divers autres produits commerciaux. Ces composés spécialisés sont généralement produits à plus petite échelle par rapport aux produits alkylés.
| Agent acylant | Composé aromatique | Produit | Utilisation finale |
|---|---|---|---|
| Anhydride acétique | benzène | acétophénone | parfums, produits pharmaceutiques, solvant, plastifiant |
| Anhydride acétique | toluène | 4-méthylacétophénone | parfums |
| Anhydride acétique | anisole | 4-méthoxyacétophénone | parfums |
| Anhydride acétique | isobutylbenzène | 4-isobutylactophénone | produits pharmaceutiques |
| Chlorure de dichloroacétyle | 1,2-dichlorobenzène | α,α,2,4-tétrachloroacétophénone | insecticides |
| Chlorure de chlorobutyroyle | fluorobenzène | chloropropyl 4-fluorophénylcétone | produits pharmaceutiques |
| Tétrachlorométhane | benzène | benzophénone | produits pharmaceutiques, insecticides, parfums |
| Chlorure de benzoyle | benzène | benzophénone | |
| Phosgène | N,N-diméthylaniline | 4,4'-bis-diméthylaminobenzophénone | teintures |
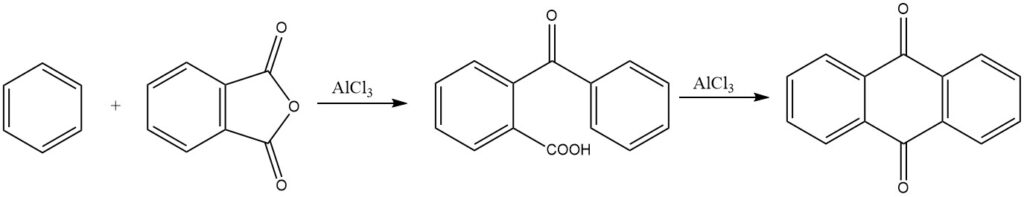
| Anhydride phtalique | benzène | Acide 2-benzoylbenzoïque | anthraquinone |
L’acylation démontre une polyvalence remarquable, donnant naissance à divers produits, notamment des aldéhydes aromatiques, des alkyl aryl cétones, des diaryl cétones symétriques et asymétriques, ainsi que des produits de cyclisation.
Les agents acylants présentent généralement une réactivité plus élevée que les agents alkylants, permettant aux acylations d’être conduites dans des conditions relativement douces. Les substrats aromatiques avec des substituants donneurs d’électrons tels que des groupes alkyle, hydroxyle ou alcoxy présentent une réactivité accrue.
Inversement, les composés aromatiques contenant des substituants attracteurs d’électrons tels que les groupes nitro, acyle, carboxyle ou nitrile sont beaucoup plus difficiles à faire réagir, même avec des agents acylants hautement actifs.
L’introduction du premier groupe acyle inhibe l’entrée d’un second groupe acyle, rendant la disubstitution dans le même cycle rare. Cependant, il existe quelques exceptions, telles que la diacylation du mésitylène, du durène et de l’anisole à l’aide d’un mélange d’acide acétique glacial et de pentoxyde de phosphore.
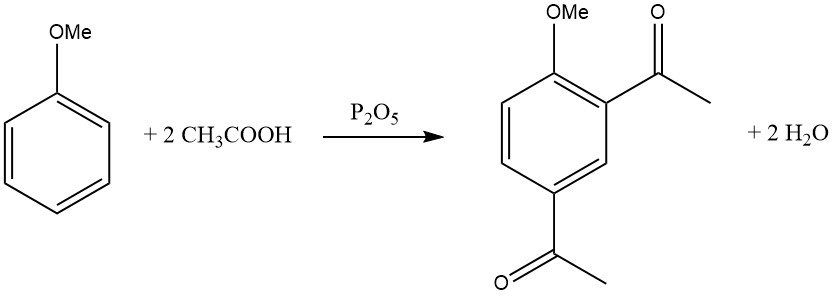
Les substituants donneurs d’électrons facilitent l’acylation et l’amélioration de la réactivité due à la polysubstitution est remarquable.
Outre le benzène et ses dérivés, les composés aromatiques carbocycliques polynucléaires tels que le naphtalène, le diphényle, l’anthracène, le phénanthrène et le pyrène peuvent également servir de substrats dans les réactions d’acylation.
Les hétérocycles riches en électrons tels que le pyrrole, le furane et le thiophène, ainsi que leurs dérivés polycycliques, présentent une réactivité élevée.
En revanche, la pyridine et la quinoléine ne réagissent pas à moins d’être activées par des substituants. Les substrats aromatiques non benzénoïdes actifs dans l’acylation comprennent les azulènes, les ferrocènes et les indolizines.
Malgré le partage de certaines similitudes avec l’alkylation de Friedel-Crafts, l’acylation présente des différences caractéristiques.
Par exemple, la consommation du catalyseur acide est typiquement au moins stoechiométrique, bien qu’il existe des cas dans la littérature où des quantités sous-stoechiométriques d’acides de Lewis sont utilisées. La réaction se déroule avec une régiosélectivité plus élevée et plus d’uniformité par rapport à l’alkylation de Friedel-Crafts, ce qui entraîne moins d’isomérisations et de réactions secondaires.
1.1. Catalyseurs d’acylation
Les catalyseurs utilisés dans l’alkylation de Friedel-Crafts peuvent également être utilisés pour des réactions d’acylation. Le catalyseur de choix dans la plupart des cas est AlCl3. Les impuretés présentes dans AlCl3, telles que FeCl3 ou des traces d’eau, améliorent les rendements de réaction et la réactivité du système, en particulier dans les cas où les réactions sont par ailleurs lentes.
Cependant, dans certains cas, l’activité élevée d’AlCl3 peut conduire à des réactions secondaires indésirables, telles que la décomposition d’hétérocycles réactifs comme le benzofurane, la décomposition d’éther ou des réarrangements de groupes alkyle.
Pour modérer l’activité d’AlCl3 dans de tels cas, des solvants complexants comme le nitrobenzène peuvent être utilisés pour former des adduits 1:1. De plus, BF3 et SnCl4 sont des catalyseurs d’acylation appropriés pour les hétérocycles sensibles.
Lorsque des agents acylants tels que des anhydrides, des esters ou des acides carboxyliques sont utilisés, des acides protoniques forts tels que l’acide sulfurique, l’acide perchlorique, l’acide orthophosphorique et l’acide polyphosphorique peuvent également être appliqués.
L’acide polyphosphorique, qui était initialement principalement utilisé pour les réactions de cyclisation intramoléculaire, est maintenant de plus en plus utilisé dans les acylations intermoléculaires.
La réaction d’un halogénure d’acyle avec un substrat aromatique, catalysée par AlCl3, conduit à la formation d’un complexe stable de l’acide de Lewis avec la cétone aromatique. Le produit est ensuite libéré par hydrolyse.
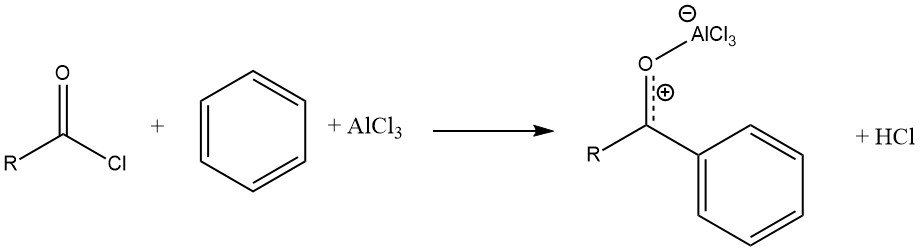
Contrairement aux alkylations de Friedel-Crafts, le catalyseur doit typiquement être appliqué en quantités au moins stoechiométriques par rapport à l’halogénure d’acyle. Cependant, il existe quelques exceptions où des quantités « vraiment catalytiques » (sous-stoechiométriques) d’acides de Lewis sont utilisées, telles que le chlorure ferreux, les oxydes de zinc ou de fer, le chlorure de cobalt et les triflates de métaux de terres rares.
Pour les agents acylants comme les acides carboxyliques ou les esters, au moins deux fois la quantité de catalyseur est nécessaire, et dans le cas des anhydrides, trois fois la quantité (mais 1,5 mole par mole de produit).
Le fluorure d’hydrogène parfois en combinaison avec le fluorure de bore est un catalyseur important sur le plan industriel. Il offre l’avantage de récupérer le catalyseur par distillation, réduisant ainsi la formation de déchets.
Cette technologie est utilisée commercialement pour l’acylation de l’isobutylbenzène en 4-isobutyacétophénone, un intermédiaire dans la production d’ibuprofène, un médicament anti-inflammatoire largement utilisé.
1.1.1. Catalyseurs hétérogènes
Si la synthèse classique de Friedel-Crafts avec des catalyseurs homogènes reste la principale méthode de préparation des cétones aromatiques, elle présente plusieurs inconvénients :
1. Il nécessite souvent des quantités stoechiométriques voire excessives de « catalyseur » du fait de la formation de complexes stables avec les produits. Ces catalyseurs, comme AlCl3, agissent plus comme des réactifs que comme de véritables catalyseurs, contribuant de manière significative aux coûts de production. Ils doivent être séparés et lavés du produit et ne peuvent pas être facilement recyclés.
2. Le système de réaction est hautement corrosif, nécessitant des réacteurs et des équipements coûteux pour la purification des gaz résiduaires, qui contiennent non seulement du HCl mais également des hydrocarbures chlorés.
3. Le catalyseur doit être neutralisé et éliminé avec un grand volume d’eaux usées, ce qui augmente l’impact environnemental.
Ces dernières années, des efforts ont été faits pour remplacer les catalyseurs homogènes par des catalyseurs hétérogènes. Les catalyseurs hétérogènes offrent des avantages tels que ne pas nécessiter de quantités stoechiométriques, être non corrosifs, une séparation facile sans neutralisation, et la possibilité de les recycler ou de les utiliser dans des procédés continus en lit fixe.
Les catalyseurs d’acylation hétérogènes doivent être des acides de Lewis ou de Brønsted forts. Certaines classes importantes d’acides solides qui peuvent catalyser cette réaction sont:
1. Zéolithes : Alumino-silicates cristallins microporeux avec de forts centres de Brønsted ou de Lewis. Des systèmes à pores moyens comme H-ZSM-5 ou des systèmes à gros pores comme la zéolite HY, la zéolite bêta ou la mordénite ont été utilisés avec succès pour des réactions d’acylation avec des composés aromatiques riches en électrons.
2. Argiles modifiées : Les minéraux argileux, lorsqu’ils sont modifiés, peuvent augmenter le nombre de sites acides. Les argiles traitées à l’acide (catalyseurs acides de Brønsted) et les argiles à échange d’ions (catalyseurs acides de Lewis) sont utilisées dans le commerce pour diverses réactions catalysées par un acide.
3. Superacides solides : Les acides forts plus forts que l’acide sulfurique à 100 %, y compris les oxydes sulfatés tels que ZrO2, TiO2, HfO2, Fe2O3 et SnO2, ont été étudiés en tant que superacides solides pour les réactions d’acylation.
4. Divers : D’autres catalyseurs comme les hétéropolyacides, les acides montés en surface (proton ou acides de Lewis sur un support) et le Nafion ont également été étudiés pour les réactions d’acylation, mais ils ne sont pas encore utilisés commercialement.
En utilisant des catalyseurs hétérogènes, les chercheurs visent à surmonter les limites des catalyseurs homogènes et à développer des procédés plus durables et efficaces pour la synthèse des cétones aromatiques.
1.2. Solvants dans la réaction d’acylation
Pour les réactions d’acylation utilisant un système catalytique halogénure d’acyle – acide de Lewis, le choix du solvant joue un rôle crucial. Des solvants non polaires comme CCl4 ou CS2, ainsi que des solvants de polarité moyenne comme le dichlorométhane ou le 1,2-dichloroéthane, peuvent être utilisés comme substrat aromatique.
Avec AlCl3 comme catalyseur, des systèmes hétérogènes se forment dans ces solvants. Cependant, l’utilisation de solvants comme le nitrométhane ou le nitrobenzène donne des solutions homogènes et une réactivité réduite en raison de la formation de complexes. Le choix du solvant peut également influencer la régiosélectivité de la réaction d’acylation.
Un danger à prendre en compte est que les produits d’addition d’AlCl3 et de nitrobenzène peuvent se décomposer de manière explosive à des températures élevées.
Il existe trois procédures courantes pour effectuer l’acylation à l’aide d’un système catalyseur halogénure d’acyle – acide de Lewis :
1. L’agent acylant est ajouté à une solution ou suspension refroidie du catalyseur dans un solvant, suivi de l’ajout du substrat aromatique au complexe acylant préformé (méthode Perrier).
2. Tous les réactifs sont mélangés et refroidis, et le catalyseur est lentement ajouté (méthode Elbs).
3. Le substrat aromatique sert de solvant au catalyseur, puis l’agent acylant est ajouté lentement (méthode Bouveault).
La méthode Perrier est souvent préférée car elle maintient un rapport constant du catalyseur à l’agent acylant tout au long de la réaction.
Si l’acide sulfurique est utilisé comme catalyseur, un grand excès d’acide est nécessaire et les réactifs y sont ajoutés. Pour éviter les réactions de sulfonation du cycle ou d’aldolisation, la température doit être maintenue en dessous de 100 °C.
1.3. Agents acylants
L’acylation de Friedel-Crafts présente une polyvalence remarquable en raison de la variation systématique qui peut être introduite à la fois dans l’agent d’acylation et le substrat aromatique. La réactivité des agents acylants suit une tendance comme suit :
[RCO]+[BF4]− > [RCO]+[ClO4]− > RCOO-SO3H > RCOX (RCO)2 O > RCO2R’ > RCONR’2
Les perchlorates d’acyle ioniques et les tétrafluoroborates sont des agents puissants, tandis que les esters d’acide et les amides sont presque inactifs sans catalyseurs. La réactivité des halogénures d’acyle diminue dans l’ordre : RCOI > RCOBr > RCOCl > RCOF.
La réactivité des halogénures d’acyle est également influencée par le substituant R, qui peut être un alkyle ou un aryle et peut contenir des groupes halogène, alkyle, alcoxy ou nitro. La réactivité est en outre influencée par le type de substrat aromatique et le catalyseur utilisé.
Les halogénures d’acyle aromatiques peuvent contenir des substituants nitro ou être du type pyridine, comme démontré dans la synthèse de 3-benzoylpyridine à partir de benzène et de chlorure de nicotinyle.
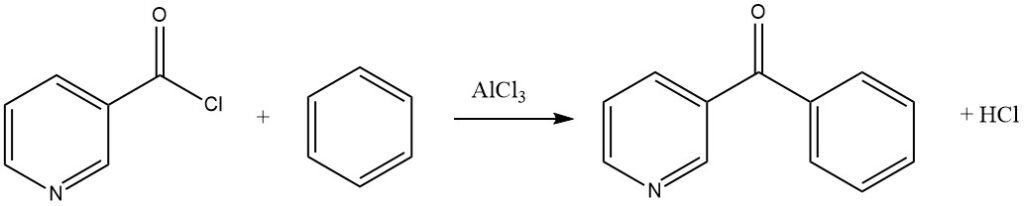
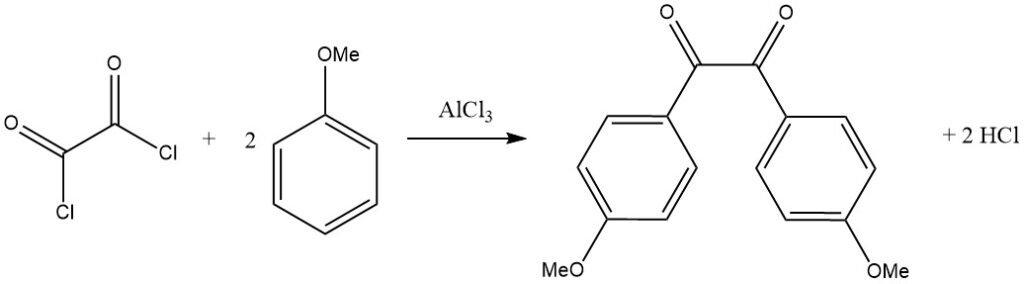
Les halogénures d’acyle bifonctionnels peuvent également agir comme agents acylants, comme on le voit dans la réaction du chlorure d’oxalyle avec un substrat aromatique activé comme l’anisole, conduisant au dérivé de benzile correspondant.
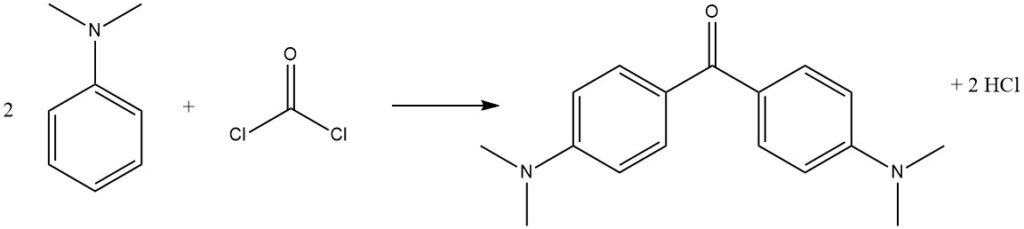
Le phosgène, un réactif commercialement important, peut réagir avec la N,N-diméthylaniline pour produire de la 4,4′-bis(diméthylamino)benzophénone (cétone de Michler), utilisée dans la production de colorants.
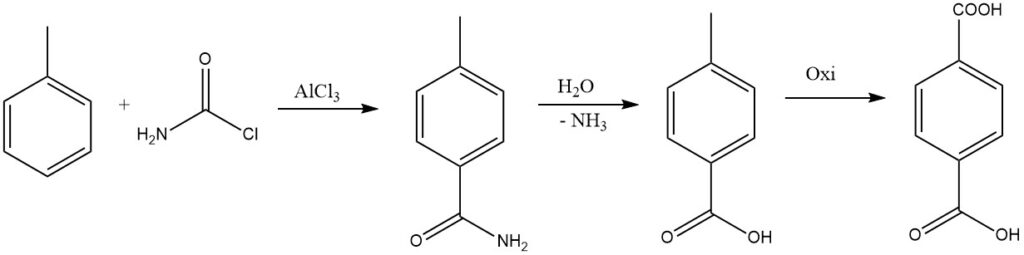
En remplaçant un halogène du phosgène par un groupe amide, l’amide résultant peut être hydrolysé pour former l’acide, qui est considéré pour la synthèse industrielle de l’acide téréphtalique.
Les isocyanates, les isothiocyanates et le CO2 peuvent également servir d’agents d’acylation en présence d’AlCl3 pour donner des acides carboxyliques aromatiques ou leurs dérivés.
Les agents acylants bifonctionnels asymétriques, tels que les chlorures d’acide contenant un groupe ester, réagissent sélectivement avec le groupe acyle le plus actif.
De même, les anhydrides d’acides, tels que les anhydrides succinique, glutarique ou maléique, en présence de 2 moles d’AlCl3 par mole d’anhydride, peuvent produire des acides 4-aryl-4-oxobutanoïques, qui sont des intermédiaires dans la synthèse Haworth des aromatiques polynucléaires.
La synthèse d’anthraquinone à partir d’anhydride phtalique et de benzène a une importance commerciale. Dans des conditions fortement acides, le 3,3-diphénylphtalide peut également se former.
Avec les catalyseurs zéolitiques, des acides carboxyliques non activés peuvent être utilisés en phase liquide pour réagir avec le toluène, donnant des p-acyltoluènes avec des rendements élevés. Ce processus s’est révélé très prometteur, avec des rendements atteignant jusqu’à 96 %.
2. Acylation du benzène et des dérivés du benzène
2.1. Acylation du benzène
L’acylation industrielle du benzène avec de l’anhydride acétique, en utilisant AlCl3 comme catalyseur et en maintenant une température de 30 °C par refroidissement, donne de l’acétophénone avec un rendement de 85 %. Cependant, l’acétophénone est aujourd’hui majoritairement produite industriellement par oxydation de l’éthylbenzène ou du cumène.
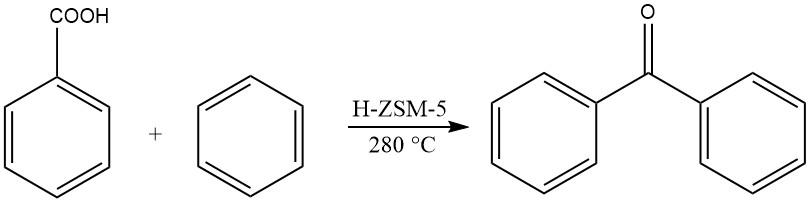
Une autre méthode implique l’acylation en phase gazeuse du benzène avec de l’acide benzoïque à des températures élevées, produisant de la benzophénone.
2.2. Acylation du toluène
L’acylation du toluène, en utilisant du chlorure d’acétyle et du chlorure d’aluminium comme catalyseur, conduit à la formation de 4-méthylacétophénone avec une sélectivité impressionnante de 97,6 %. Ce composé trouve une application dans la fabrication de parfums.
2.3. Acylation des substrats désactivés
Les composés aromatiques benzénoïdes contenant des substituants nitro, carboxyle, nitrile et acyle présentent un obstacle à la substitution électrophile. Cependant, l’acylation de ces composés ne devient réalisable qu’en présence d’un second substituant activateur, tel qu’un groupe hydroxy ou alcoxy.
D’autre part, des substrats désactivés comme le chlorobenzène peuvent être soumis à une acylation pour former des p-chlorobenzophénones, en utilisant des catalyseurs hétérogènes commerciaux comme les zéolithes ou la zircone sulfatée, connus pour leurs propriétés de superacides solides.
2.4. Acylation des substrats activés
L’acylation de substrats activés, tels que le phénol, peut être réalisée à l’aide de divers catalyseurs, notamment l’acide carboxylique – ZnCl2, l’acide carboxylique – BF3 ou l’acide carboxylique – acide polyphosphoré. L’acylation des phénols démontre jusqu’à 25% de sélectivité pour la substitution ortho, le rapport ortho sur para étant fortement influencé par le choix des catalyseurs et des solvants.
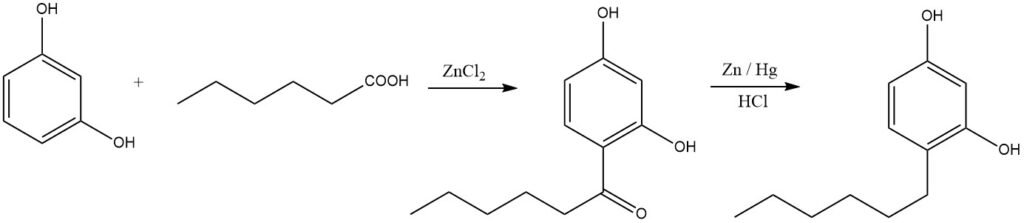
Les alkylphénols linéaires peuvent être synthétisés par acylation suivie d’une réduction. Un exemple illustratif est la production d’hexylrésorcinol, largement utilisé comme désinfectant :
Les phénols et les éthers phényliques sont des substrats hautement réactifs et présentent une réactivité dans des conditions relativement douces. Par exemple, l’anisole peut être facilement acylé à 40 – 50 °C en présence d’acide polyphosphorique. Les éthers phényliques, quant à eux, subissent une acylation principalement en position 4.
Une alternative écologique aux systèmes d’acylation conventionnels de Friedel – Craft évite la formation de déchets de sels et de sous-produits. Cette approche implique l’utilisation d’anhydrides mixtes d’acide trifluoroacétique, qui sont générés in situ par réaction avec des acides carboxyliques. De faibles concentrations de H3PO4 servent de catalyseur et l’acide trifluoroacétique peut être recyclé après déshydratation.
2.5. Acylation des amines aromatiques
Après la N-acylation, les amines aromatiques présentent une réactivité semblable aux composés alkylaromatiques dans les réactions d’acylation. Les amines aromatiques tertiaires, telles que la N,N-diméthylaniline, peuvent subir une acylation en position 4, en utilisant P2O5 comme catalyseur. Ceci est bien connu dans la synthèse de la cétone de Michler.
2.6. Réactions de cyclisation
La 6-méthoxy-1-tétralone est obtenue avec un rendement impressionnant de 96 % en faisant réagir l’acide 4-(3-méthoxyphényl)butyrique.
Les cyclisations intermoléculaires sont clairement démontrées dans les réactions de l’anhydride phtalique avec le benzène et ses dérivés, entraînant respectivement l’anthraquinone et les anthraquinones substituées.
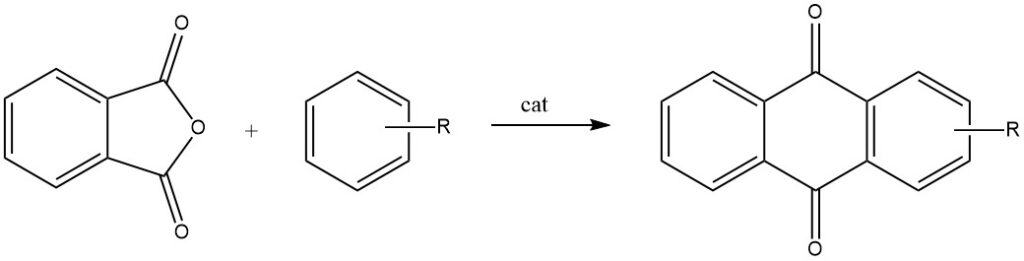
Lorsque l’anhydride phtalique réagit avec le toluène ou le chlorobenzène, il subit un processus en deux étapes, conduisant à la formation d’anthraquinones 2-substituées.
A l’inverse, la réaction avec le 4-chlorophénol donne directement la 1,4-dihydroxyanthraquinone (chinizarine). L’oxydation, la nitration, la chloration ou l’amination ultérieures de ces produits génèrent des intermédiaires essentiels pour la chimie fine.
De plus, l’acylation Friedel – Crafts de l’éthylbenzène avec l’anhydride phtalique produit, par un procédé en deux étapes, la 2-éthylanthraquinone, un composant important utilisé dans la synthèse de H2O2.
3. Acylation des composés aromatiques polynucléaires
3.1. Acylation du naphtalène
L’acylation du naphtalène donne généralement des mélanges de dérivés 1- et 2-acyle, et les proportions relatives de ces dérivés sont principalement influencées par le choix du solvant. Lorsque des solvants non polaires tels que CS2 ou CCl4 sont utilisés, l’acylation se produit principalement en position 1. A l’inverse, dans des solvants polaires tels que CH3NO2 ou C6H5NO2, la formation de 2-acétylnaphtalènes est favorisée.
3.2. Acylation des naphtalènes substitués
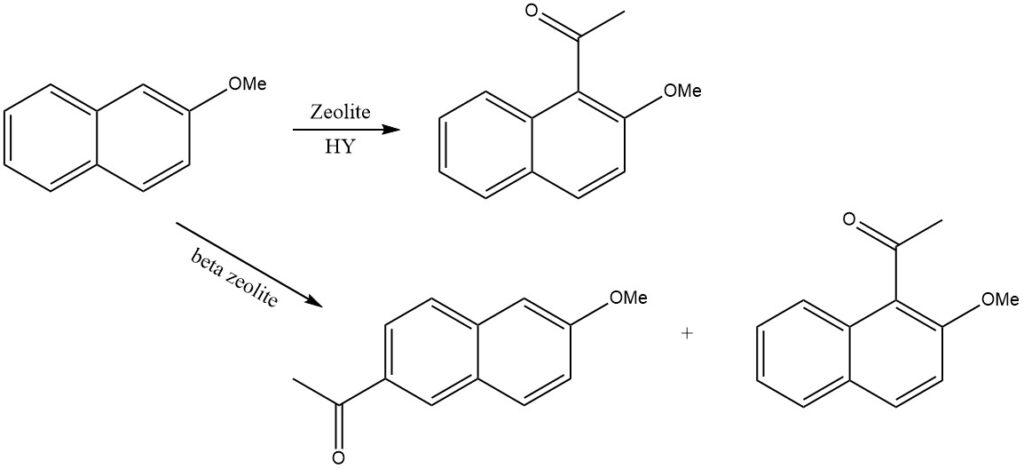
L’acylation de naphtalènes substitués donne souvent des mélanges complexes de produits. Typiquement, le cycle le plus fortement activé est plus sujet à l’acylation. Cependant, la régiosélectivité peut être contrôlée par la sélectivité de forme des zéolithes.
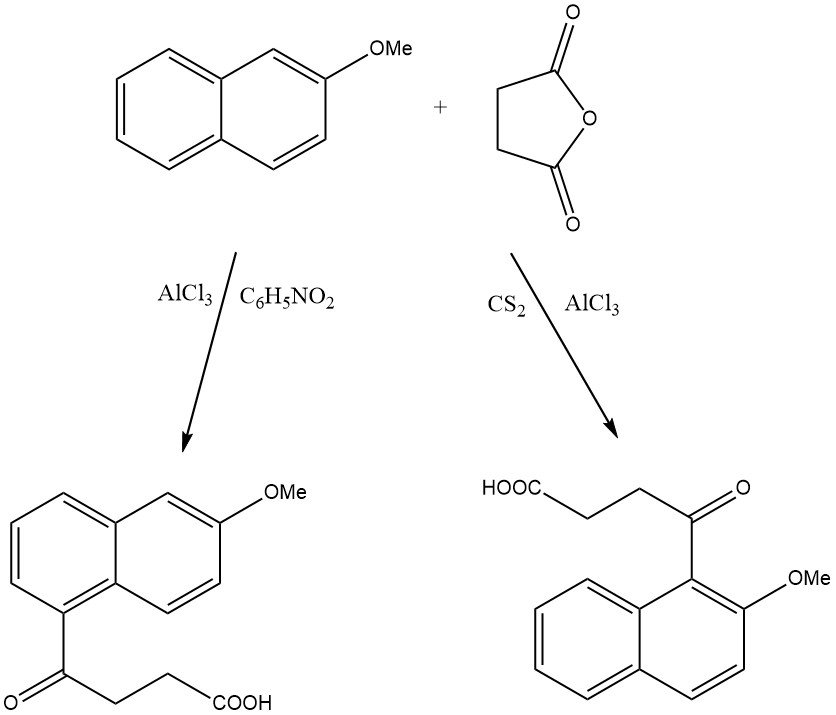
Par exemple, lorsque le 2-méthoxynaphtalène est acylé sur la zéolite HY, seul le 1-acétyl-2-méthoxynaphtalène est produit, tandis que sur la zéolite bêta, le 2-acétyl-6-méthoxynaphtalène est formé.
La 1,5-diacylation nécessite des conditions plus strictes, comme on le voit dans la synthèse du 1,5-dibenzoylnaphtalène. Ce composé peut encore être fusionné dans du chlorure d’aluminium et de sodium pour donner de la dibenzopyrènequinone, un colorant commercialisé sous le nom d’Indanthren Goldgelb GK.
Lorsque le naphtalène réagit avec des composés diacyle, les produits 1,8-diacylés sont souvent formés.
3.3. Acylation des biphényles
Lorsqu’un cycle d’une molécule de biphényle est désactivé par un substituant attracteur d’électrons, l’autre cycle devient plus réactif et peut subir une acylation en position 4. La désactivation d’un cycle améliore la réactivité de l’autre cycle, le rendant plus sensible à la substitution électrophile, et ainsi, l’acylation se produit préférentiellement en position 4.
3.4. Acylation de l’anthracène
En présence d’AlCl3 et dans des conditions douces dans des solvants non polaires (0 °C, benzène), l’anthracène subit une acylation à la position 9 la plus réactive. L’isomérisation du complexe cétone – AlCl3 est empêchée par la précipitation.
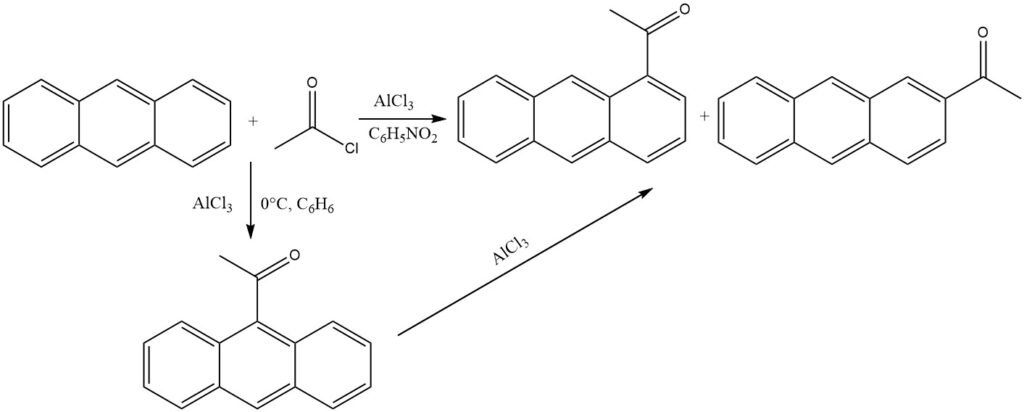
Cependant, lorsque des solvants polaires comme le nitrobenzène sont utilisés, un mélange composé principalement de 1-acylanthracène et d’un peu de 2-acylanthracène se forme. Dans ce scénario également, le 9-acylanthracène est probablement le produit initial, qui subit ensuite une isomérisation.
3.5. Acylation du phénanthrène
De même, lorsque le phénanthrène est acylé dans le nitrobenzène, les principaux produits obtenus sont les isomères 2- et 3-acyle. D’autre part, l’utilisation du dichloroéthane, un solvant moins polaire, conduit principalement à la formation de l’isomère 9-acyle comme produit principal. Le choix du solvant joue un rôle crucial dans la détermination de la régiosélectivité de la réaction d’acylation du phénanthrène.
4. Acylation des composés hétéroaromatiques
Le furane, le thiophène et le pyrrole possèdent une densité électronique élevée, ce qui les rend hautement activés dans les réactions de substitution électrophile, permettant leur acylation dans des conditions de réaction douces.
4.1. Acylation du furane
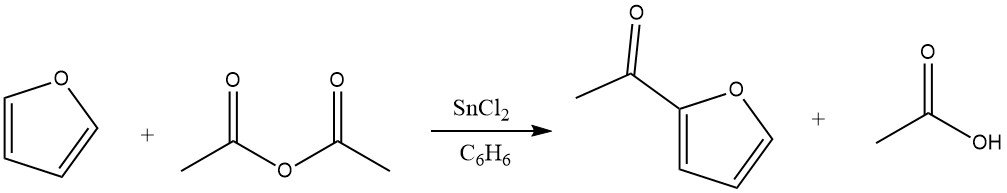
L’acylation du furane entraîne des rendements significatifs du dérivé 2-acyle, en particulier lorsque les anhydrides servent d’agents d’acylation. L’excellente réactivité du furane permet l’utilisation du benzène comme solvant. Les catalyseurs appropriés pour cette réaction comprennent le chlorure de zinc, le trifluorure de bore et l’acide phosphorique. De plus, l’acylation peut également avoir lieu en position 5.
4.2. Acylation du thiophène
La réactivité du thiophène peut être assimilée à celle de l’anisole. Le thiophène peut être efficacement acylé, donnant des rendements élevés des produits souhaités, lorsque des halogénures d’acyle sont utilisés en présence de SnCl4 ou des anhydrides sont utilisés avec de l’acide phosphorique ou du ZnCl2 comme agent d’acylation.
4.3. Acylation du pyrrole
L’acylation du pyrrole peut avoir lieu même en l’absence de catalyseurs, bien que ZnCl2, BF3 et AlCl3 soient couramment utilisés en conjonction avec des anhydrides comme agents acylants. Généralement, l’acylation se produit en position 2 du cycle pyrrole, mais la 2,5-diacylation est également possible. Cependant, la 3-acylation n’est observée que lorsque les positions 2 et 5 sur le cycle pyrrole sont bloquées.
4.4. Acylation des imidazoles
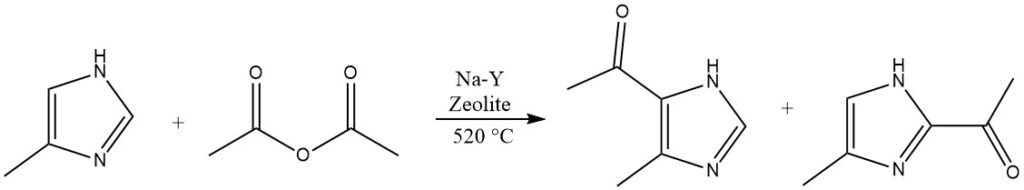
Les hétérocycles qui sont fortement désactivés et ne peuvent pas être acylés en phases liquides homogènes, tels que l’imidazole ou les pyrazoles, sont capables de réagir sur les zéolithes Na-Y à des températures élevées dépassant 500 °C.
4.5. Acylation des benzofuranes
Les hétérocycles hautement réactifs peuvent subir des acylations à l’aide de zéolithes dans un procédé continu en phase liquide. Par exemple, l’acylation du 2-méthylbenzofurane avec l’anhydride acétique est un exemple représentatif :
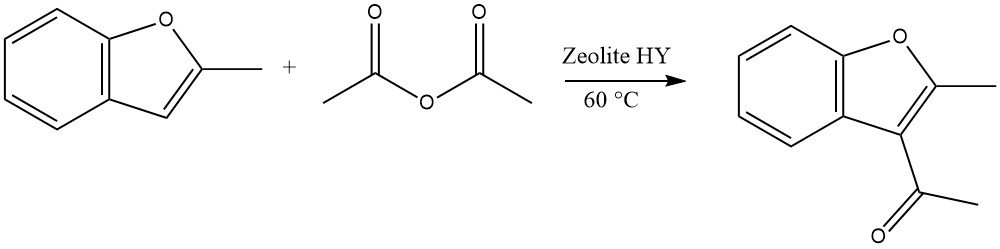
Dans le cas du dibenzofurane et du dibenzothiophène, l’acylation ou la diacylation peut se produire en position 2 ou 8. Pour le carbazole, l’acylation ou la diacylation se produit généralement en position 3 ou 6.
4.6. Divers
Les 4H-pyrones substituées ont démontré d’excellents rendements dans les réactions d’acylation lorsque l’acide trifluoroacétique est utilisé comme catalyseur. Notamment, même des réactions de diacylation sont réalisables.
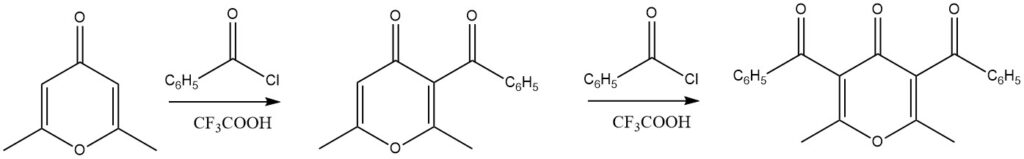
Une large gamme d’autres composés hétéroaromatiques, y compris le chromane, les xanthènes, le 1,3-benzodioxole et les dibenzodioxines, ont également été soumis avec succès à des réactions d’acylation.
5. Acylation des composés aromatiques non benzénoïdes
Le ferrocène subit facilement une acylation avec des halogénures d’acyle en présence de chlorure d’aluminium, présentant une réactivité comparable aux phénols. Les anhydrides peuvent également servir d’agents acylants. Avec BF3 comme catalyseur, la monoacylation du ferrocène peut être obtenue. Lorsqu’un excès d’agent acylant et d’AlCl3 est utilisé, la diacétylation hétéroannulaire devient la réaction prédominante.
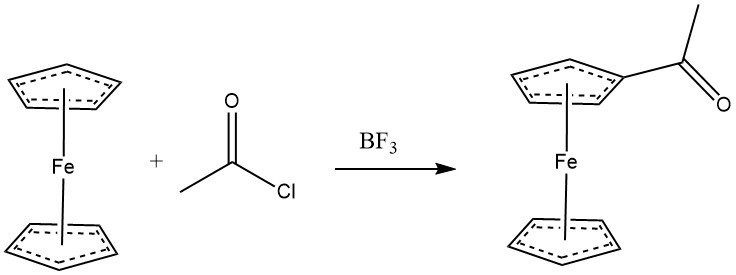
Divers dérivés de cyclopentadiényle peuvent être acylés. La réactivité de certains substrats aromatiques suit cet ordre : C6H5OH•(C5H5)2Fe > C6H5OCH3 > CH3C5H4Mn(CO)3 > C5H5Mn(CO)3 > C6H6.
L’azulène réagit en douceur avec l’anhydride acétique en présence de SnCl4 comme catalyseur, conduisant à l’acylation de la partie cyclopentadiényle et donnant le 1-acétylazulène. Dans des conditions plus rigoureuses et en présence de AlCl3 ou SnCl4, le 1,3-diacétylazulène est formé en utilisant du chlorure d’acétyle ou de l’anhydride acétique comme agent acylant.
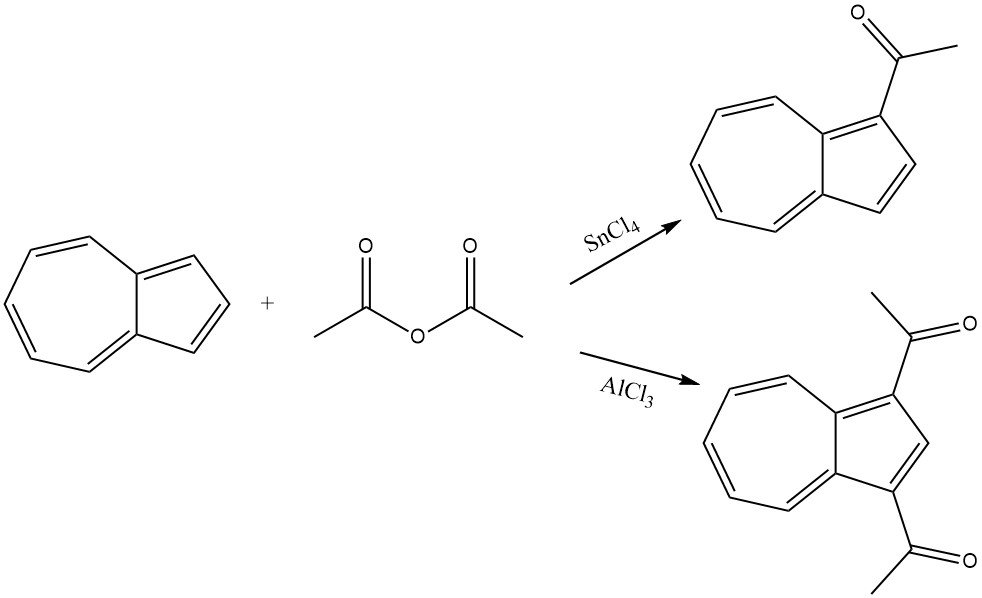
6. Diverses réactions d’acylation
Parmi les nombreuses réactions conduisant à des produits de C-acylation aromatiques, les réactions de formylation, la synthèse de Houben-Hoesch et le réarrangement de Fries sont particulièrement significatives.
6.1. formylation
La formylation de composés aromatiques est un type spécifique de réaction d’acylation qui se produit lorsqu’un halogénure de formyle ou un anhydride formique réagit avec un composé aromatique en présence d’un catalyseur de Friedel-Crafts, tel que AlCl3. Cependant, l’application de cette réaction est limitée en raison de l’instabilité de la plupart des agents de formylation.
La synthèse de Gattermann-Koch utilise un mélange de chlorure d’hydrogène et de monoxyde de carbone avec AlCl3 et du chlorure de cuivre (I) comme agent de formylation pour les composés aromatiques. Le benzène, ainsi que les benzènes substitués ou les aromatiques polycycliques, subissent une formylation pour donner des aldéhydes aromatiques, avec une préférence pour les isomères para.
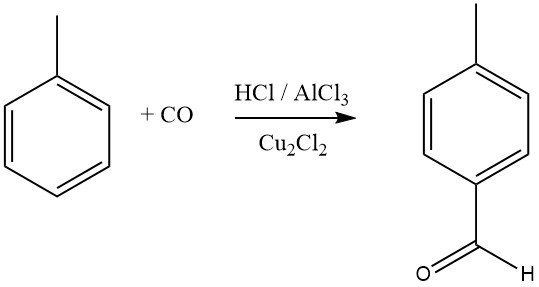
Les composés aromatiques avec des substituants méta-directeurs ne réagissent pas dans ce processus de formylation. Mitsubishi Gas Chemical explore une synthèse Gattermann-Koch modifiée pour la synthèse industrielle de l’acide téréphtalique.
Dans ce processus, le toluène réagit avec le CO et le HF-BF3 pour produire du p-tolualdéhyde avec un rendement élevé, qui est ensuite oxydé en acide téréphtalique. Des études récentes suggèrent que le véritable agent acylant dans ces réactions est [CHO]+, formé par protonation du CO ou de ses complexes.
Pour la synthèse des aldéhydes de Vilsmeier, les substrats aromatiques et hétérocycliques sont formylés par réaction avec des dialkyl- ou arylalkylformamides en présence de POCl3. Cette réaction permet la formylation d’une variété de composés, y compris les composés aromatiques polynucléaires réactifs, les éthers de phénol, les dialkylamines et les N-hétérocycles comme le pyrrole et l’indole.
La régiosélectivité de la formylation suit les principes des réactions de Friedel-Crafts, conduisant généralement à la formation de composés aromatiques 4-substitués. De plus, les substrats aromatiques peuvent être formylés en utilisant du dichlorométhyl méthyl éther ou de l’orthoformiate de trialkyle en présence de TiCl4 ou AlCl3, respectivement.
6.2. Synthèse de Houben-Hoesch
La synthèse de Houben-Hoesch, étroitement liée à la réaction de Gattermann, implique l’acylation de substrats aromatiques réactifs tels que les phénols, les éthers phényliques, les pyrroles, les thiophènes et les indoles à l’aide de nitriles. Ces réactions ont lieu en présence de chlorure d’hydrogène (HCl) et de chlorure de zinc (ZnCl2).
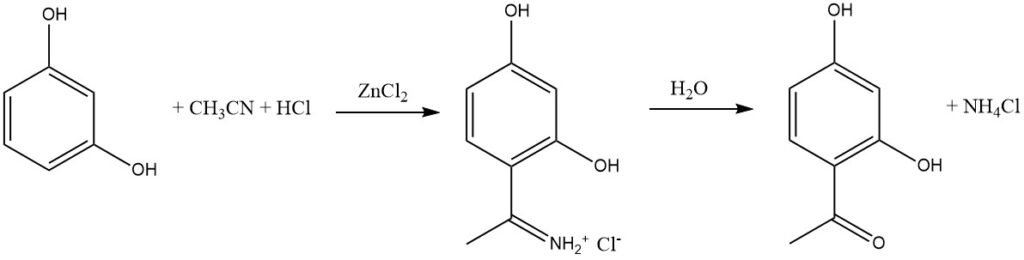
Dans cette synthèse, l’électrophile actif est l’ion imminium, qui est formé par l’addition de HCl au nitrile puis complexé par l’acide de Lewis (ZnCl2). Cet intermédiaire volumineux conduit majoritairement à une acylation en position 4 du substrat aromatique plutôt qu’en position 2.
Comparée à l’acylation de Friedel-Crafts avec des halogénures ou des anhydrides d’acyle, la synthèse de Houben-Hoesch est souvent une méthode plus simple pour acyler les phénols activés.
6.3. Réarrangement des frites
Le réarrangement de Fries des esters d’aryle, qui peut être préparé par acylation de phénols, est une méthode précieuse pour synthétiser les cétones phénoliques utilisées dans la production de produits chimiques fins. Cette réaction est largement utilisée dans l’industrie pharmaceutique pour la synthèse de médicaments comme l’adrénaline, la synéphrine, la buphénine et l’acébutolol.
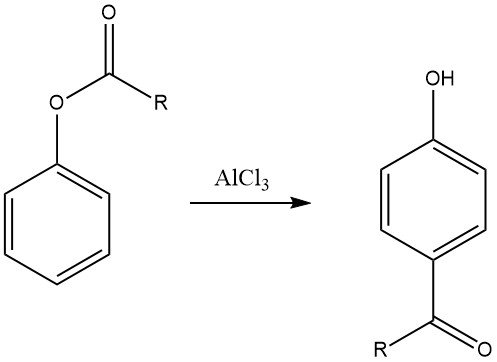
La régiosélectivité du réarrangement de Fries peut être contrôlée en ajustant les conditions de réaction. Généralement, la substitution para est favorisée à basse température, tandis que la substitution ortho est favorisée à haute température. Cependant, le choix du solvant ainsi que le type et la quantité de catalyseurs influencent également la régiosélectivité.
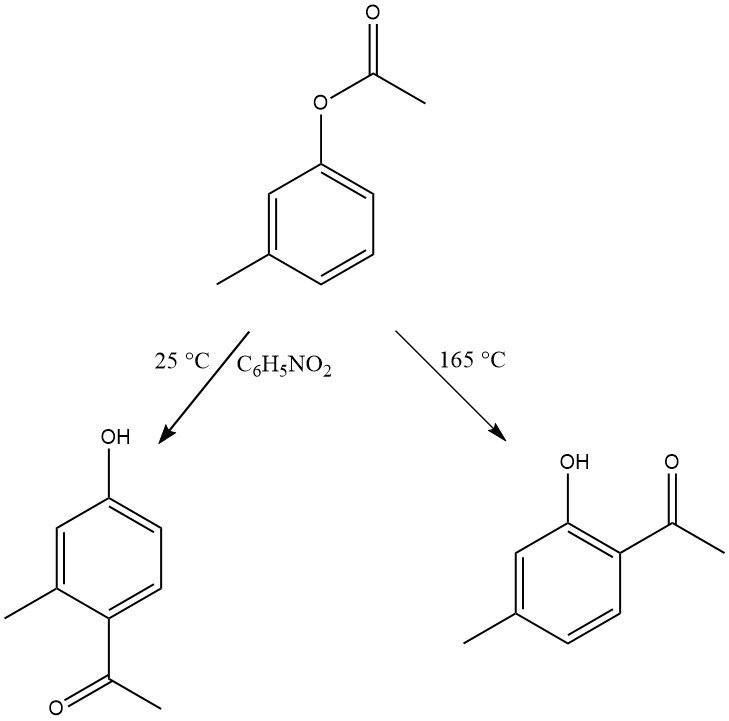
Une large gamme de substrats avec diverses substitutions à la fois dans les fragments phénol et acide peut subir ce réarrangement. Même les dérivés du phénol avec des groupes attracteurs d’électrons, comme le groupe nitro, ainsi que le naphtol et les esters hydroxy- ou dihydroxyphényliques, sont réactifs dans cette transformation.
Les N-acylanilines peuvent également être réarrangées pour donner des 4-acylanilines à des températures élevées. La partie acide des esters peut être variée, permettant l’utilisation de différents acides alkyliques ou aryliques, dont les esters diaryldicarboxyliques et les esters d’acides sulfoniques, qui conduisent à la formation de 4-hydroxyphénylsulfones.
AlCl3 est le catalyseur couramment utilisé, bien que SnCl4, TiCl4, FeCl3 et ZnCl2 soient également efficaces et parfois plus pratiques. Le réarrangement est généralement effectué en chauffant un mélange d’esters phénoliques et du catalyseur à des températures allant de 80 à 180 °C.
Selon la réactivité du substrat, la réaction peut être achevée en quelques minutes à quelques heures. Il est possible de conduire la réaction à des températures plus basses dans des solvants tels que C6H6NO2, (CH2Cl)2, CS2, C6H5Cl ou l’éther de pétrole, mais cela nécessite des temps de réaction plus longs.
En variante, le réarrangement peut être initié dans CS2, suivi d’une distillation pour éliminer le solvant, puis terminé à des températures plus élevées.
Pour isoler l’isomère ortho des mélanges de produits, une distillation à la vapeur est souvent utilisée. D’autre part, les produits volatils peuvent être séparés par distillation fractionnée et l’isomère para peut être obtenu à partir de mélanges de produits non volatils par cristallisation.
Référence
- Acylation and Alkylation; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_185
FAQ sur l'acylation
L’acylation de Friedel-Crafts est un type de réaction chimique organique qui implique l’introduction d’un groupe acyle (R-CO-) sur un cycle aromatique. Il porte le nom des chimistes Charles Friedel et James Crafts, qui ont développé la réaction au 19ème siècle.
L’acidification du mélange réactionnel avant l’acylation est souvent nécessaire pour générer un électrophile approprié qui peut réagir avec le substrat aromatique. Cette étape aide à l’activation de l’agent d’acylation (par exemple, halogénure ou anhydride d’acyle) et le prépare à subir une substitution aromatique électrophile, une étape clé de l’acylation de Friedel-Crafts. Le processus d’acidification implique l’ajout d’un catalyseur acide de Lewis comme AlCl3 ou FeCl3 pour générer l’ion acylium réactif (RCO+), qui facilite la réaction d’acylation.
L’acylation de Friedel-Crafts implique la substitution électrophile d’un groupe acyle sur un cycle aromatique. La réaction a lieu en générant d’abord un électrophile fort (ion acylium) à partir de l’agent acylant en présence d’un catalyseur acide de Lewis. Cet électrophile attaque alors le cycle aromatique riche en électrons, conduisant à la formation d’un carbocation intermédiaire. La réaction est complétée par la déprotonation de ce carbocation, qui se traduit par l’introduction du groupe acyle sur le cycle aromatique, donnant le produit acylé.
Les réactions d’acylation peuvent être réalisées dans une variété de solvants en fonction des conditions de réaction spécifiques et de la réactivité des substrats et des réactifs impliqués. Les solvants non polaires tels que CCl4, CS2, le benzène et le toluène sont couramment utilisés pour les réactions d’acylation de Friedel-Crafts. De plus, des solvants polaires comme le dichlorométhane et le nitrobenzène peuvent être utilisés pour des réactions spécifiques. Le choix du solvant peut influencer la réactivité, la régiosélectivité et le rendement de la réaction d’acylation.
Le fort effet désactivant du groupe acyle conduit à la formation de produits de monosubstitution principalement et la nature volumineuse du groupe acylant limite également la substitution supplémentaire, conduisant à la monosubstitution en tant que produit principal.
Les réactions d’acylation ont de larges applications dans la synthèse organique et la production de divers composés chimiques. Certaines utilisations courantes de l’acylation comprennent:
– Synthèse de cétones aromatiques, intermédiaires indispensables en pharmacie et agrochimie.
– Préparation de chimie fine, teintures et parfums.
– Formation d’intermédiaires réactifs pour une fonctionnalisation ultérieure de molécules organiques.
– Production de produits chimiques industriels comme l’acide téréphtalique et les anthraquinones.
– Synthèse de composés biologiquement actifs, tels que des médicaments et des produits naturels.
Bien que l’acylation de Friedel-Crafts soit une méthode de synthèse précieuse, elle présente certaines limites. Une limitation importante est le potentiel de réactions secondaires, telles que la polyacylation, qui peut conduire à des produits indésirables et diminuer le rendement global. De plus, certains substrats peuvent ne pas subir une acylation efficace en raison d’un encombrement stérique ou d’une désactivation causée par certains substituants. De plus, l’utilisation de catalyseurs acides de Lewis forts peut conduire à des réactions secondaires indésirables ou à un empoisonnement du catalyseur.
Oui, l’acylation de Friedel-Crafts a été largement utilisée dans la synthèse de divers produits naturels et composés biologiquement actifs. Il permet l’introduction de groupes fonctionnels spécifiques dans les cycles aromatiques, facilitant la création de diverses structures chimiques présentes dans les produits naturels. La régiosélectivité et les conditions de réaction douces en font un outil précieux pour la synthèse efficace de molécules complexes avec des groupements aromatiques.
Les réactions d’acylation de Friedel-Crafts impliquent souvent l’utilisation d’acides de Lewis forts et d’agents acylants, qui peuvent être dangereux et réactifs. Les précautions de sécurité appropriées doivent être suivies, y compris l’utilisation d’équipements de protection appropriés, tels que des gants, des blouses de laboratoire et des lunettes de sécurité. Les réactions doivent être conduites sous une hotte bien ventilée pour éviter l’inhalation de vapeurs acides.

