L’acide borique est un hydrate d’oxyde borique, existant à la fois sous forme d’acide orthoborique trihydraté, H3BO3 (B2O3·3 H2O), et d’acide métaborique monohydraté, HBO2 (B2O3·H2O). L’acide orthoborique est la forme commerciale couramment rencontrée, souvent simplement appelée acide borique.
L’acide borique est également présent naturellement sous forme de sassolite minérale. La formule structurellement descriptive de l’acide borique est B(OH)3 et le nom systématique de l’IUPAC est trihydoxidoboron. Les termes « acide pyroborique » et « acide tétraborique » se retrouvent dans des publications plus anciennes mais ne représentent pas des composés en phase solide bien définis.
Table des matières
1. Propriétés physiques de l’acide borique
Les cristaux d’acide borique se forment sous forme de plaquettes blanches et inodores à partir d’une solution aqueuse. La structure cristalline dominante de l’acide orthoborique, qui a un point de fusion de 170,9 °C lorsqu’il est chauffé dans un espace clos, est triclinique, caractérisée par une disposition en forme de feuille.
Ces feuillets contiennent des molécules coplanaires B(OH)3 liées entre elles par des liaisons hydrogène. Les faibles forces de Van der Waals maintiennent les piles de feuilles de B(OH)3 ensemble, permettant ainsi de diviser facilement les cristaux en flocons glissants, une propriété qui contribue aux qualités lubrifiantes de l’acide borique.
L’acide métaborique existe sous trois formes cristallines. La déshydratation de l’acide orthoborique à 100-130 °C produit des cristaux feuilletés de HBO2 (III) orthorhombique (densité 1,784 g/cm³, point de fusion 176 °C). Après l’élimination du B(OH)3 restant à des températures allant jusqu’à 160 °C, il reste un HBO2 (II) monoclinique grossièrement cristallin (forme β, densité 2,044 g/cm³, point de fusion 201 °C).
À des températures plus élevées (200-250 °C), un liquide visqueux se forme, à partir duquel le HBO2 (I) cubique (forme γ, densité 2,486 g/cm³, point de fusion 236 °C) cristallise progressivement. Avec environ 1 % d’humidité restante, HBO2 (I) sert de germe pour la cristallisation de l’oxyde borique hexagonal (forme α).
Les structures de ces formes métaborates vont de tous les atomes de bore trigonaux dans HBO2 (III) à un tiers de bore tétraédrique dans HBO2 (II) en passant par tout le bore tétraédrique dans HBO2 (I).
La pression de vapeur de l’acide borique est principalement due à l’eau en équilibre de déshydratation. En dessous de 160 °C, la vapeur est constituée de molécules d’eau et d’acide borique. À des températures plus élevées, HBO2 est également présent en phase vapeur et (HBO2)3 devient une espèce significative au-dessus de 940 °C.
Dans les solutions aqueuses, l’acide borique se comporte comme un acide faible, avec un pKa de 9,23 à 25 °C. Le pH de ses solutions diminue avec l’augmentation de la concentration en raison de la formation d’espèces trimères et tétramères. Le pH augmente également avec la température.
La solubilité de l’acide borique dans l’eau est améliorée en ajoutant des sels comme KCl, KNO3, RbCl, K2SO4 et Na2SO4, tandis que LiCl, NaCl et CaCl2 réduisent la solubilité.
L’acide borique se volatilise avec la vapeur et le distillat d’une solution saturée bouillante contient environ 0,18 % d’acide borique. Notamment, l’acide borique est très volatil à partir de solutions concentrées rendues acides par des acides forts, entraînant des pertes de solution dans les alcools de faible masse moléculaire en raison de la formation d’esters de borate volatils.
| T (°C) | Solubilité de B(OH)3 dans % en poids d'eau |
|---|---|
| 0 | 2.4 |
| 10 | 3.5 |
| 20 | 4.7 |
| 30 | 6.2 |
| 40 | 8.8 |
| 50 | 10.3 |
| 60 | 13.0 |
| 70 | 15,8 |
| 80 | 19.1 |
| 90 | 23.3 |
| 100 | 27,5 |
| Concentration en % en poids d'acide borique | Valeurs pH à 20 °C |
|---|---|
| 0,1 | 6.1 |
| 0,5 | 5.6 |
| 1.0 | 5.1 |
| 2.0 | 4.5 |
| 4.0 | 3.9 |
| Solvant | T (°C) | Solubilité de B(OH)3 (g/100 g de solvant) |
|---|---|---|
| Méthanol | 20 | 20.68 |
| Éthanol | 25 | 94,4 |
| n-Butanol | 25 | 42,8 |
| n-Propanol | 25 | 59,4 |
| 2-méthylbutanol | 25 | 35.3 |
| Alcool isoamylique (3-méthyl-1-butanol) | 25 | 2.39 |
| Éthylène glycol | 25 | 18,5 |
| Propylène glycol | 25 | 15.06 |
| Diéthylèneglycol | 25 | 13.6 |
| Glycérol (86,5 %) | 20 | 21.1 |
| Glycérol (98,5 %) | 20 | 19.9 |
| Glycérol | 25 | 17.55 |
| Mannitol (10 %) | 25 | 6.62 |
| Acétone | 25 | 0,6 |
| Méthyléthylcétone | 20 | 0,7 |
| Méthylbutylcétone | 20 | 0,23 |
| Acétate d'éthyle | 25 | 1.5 |
| Acide acétique (glacial) | 30 | 6.3 |
| Éther diéthylique | 20 | 0,008 |
| Dioxane | 25 | 15 |
| Aniline | 20 | 0,15 |
| Pyridine | 25 | 70 |
| Ammoniac (liquide) | 25 | 1,88 |
| Fioul | 25 | 2.46 |
2. Propriétés chimiques de l’acide borique
Un acide faible
Se distinguant par sa nature faiblement acide, l’acide borique a une valeur pKa de 9,24 à 25°C. Cette propriété dicte son comportement dans les solutions aqueuses, où il se dissocie partiellement en protons (H+) et en ions borate (B(OH)4–).
Cette dissociation, bien que limitée, contribue aux propriétés antiseptiques et antifongiques de l’acide borique.
L’acide borique réagit facilement avec les bases fortes, conduisant à la formation d’ions métaborate, B(OH)4–, qui agissent comme des bases conjuguées. Ses réactions avec les alcools aboutissent à la production d’esters de borate, démontrant son affinité pour les composés hydroxylés.
Réactions avec les ions fluorure et les diols
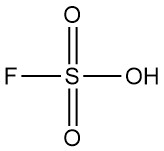
En présence d’ions fluorure, l’acide borique subit une transformation donnant naissance à l’acide tétrafluoroborique.
Les interactions entre l’acide borique et les diols, en particulier ceux contenant des fonctionnalités 1,2- ou 1,3-diol, jouent un rôle important dans la chimie des borates. Ces diols peuvent former des esters cycliques stables à cinq et six chaînons avec l’acide borique, démontrant sa tendance à se complexer avec des molécules organiques spécifiques.
Applications en chimie analytique
L’acide borique est un acide relativement faible qui pose des défis pour un titrage précis, une technique courante en chimie analytique. Pour surmonter cette limitation, l’ajout d’agents complexants de polyol, tels que le mannitol ou le sorbitol, à des solutions aqueuses d’acide borique améliore considérablement son acidité. Cette modification permet un titrage précis à l’aide d’indicateurs colorimétriques, élargissant ainsi la gamme d’applications analytiques de l’acide borique.
La capacité de réticulation de l’acide borique avec deux équivalents de diols pour former des spiro-diesters trouve des applications dans divers domaines. Par exemple, le bore environnemental joue un rôle essentiel dans la réticulation du glucide complexe rhamnogalacturonane II dans les parois cellulaires végétales, un processus essentiel à la croissance des plantes.
Réaction avec les composés diols
Les interactions entre les substrats contenant du bore et des diols sont importantes dans les organismes marins, ce qui suggère que des réactions similaires avec les diols peuvent avoir des fonctions métaboliques importantes chez les plantes et les animaux.
La réticulation borate des glucides trouve des applications dans diverses utilisations commerciales, notamment les adhésifs à base d’amidon, les fluides rhéologiques pour les applications dans les champs pétrolifères et l’alcool polyvinylique réticulé par l’acide borique pour les films polarisants dans les panneaux d’affichage électroniques.
3. Production d’acide borique
La production d’acide borique repose sur les minéraux borates et les saumures comme matières premières primaires. Les borates, notamment le borax, la kernite, la colémanite, l’ascharite, l’ulexite et l’hydroboracite, réagissent avec des acides minéraux forts pour former de l’acide borique.
Les minéraux de borate de sodium sont la principale source de production d’acide borique aux États-Unis, tandis que la Turquie utilise largement la colémanite. Les borates extraits de la saumure saline du lac Searles en Californie sont transformés en acide borique.
La Russie produit de l’acide borique à partir de la datolite, un minéral borosilicaté ; occasionnellement, le borax raffiné penta- ou décahydraté sert de matière première.
L’usine d’acide borique à grande échelle exploitée par U.S. Borax Inc. à Boron, en Californie, lixivie le minerai de kernite broyé (Na2B4O7·4 H2O) avec de l’acide sulfurique dans une liqueur faible recyclée à chaud.
La gangue grossière est séparée et les fines particules sont décantées pour produire une liqueur forte concentrée d’acide borique, saturée de sulfate de sodium. Un contrôle minutieux du pH et de la température garantit une solubilité complète du sulfate de sodium.
La liqueur forte subit une filtration, suivie d’une cristallisation de l’acide borique en deux étapes dans des cristalliseurs continus. La température est ensuite abaissée pour précipiter les cristaux d’acide borique. Ces cristaux sont filtrés, lavés, séchés dans des séchoirs rotatifs, criblés et préparés pour l’expédition.
La datolite, un minéral borosilicate commun de formule CaB(SiO4)(OH) ou 2 CaO·B2O3·2 SiO2·H2O,, est une matière première pour la production d’acide borique. À Dalnegorsk, en Russie, le minerai de datolite est finement broyé et digéré avec de l’acide sulfurique. La solution obtenue, après coagulation de la silice par chauffage, est séparée puis l’acide borique est cristallisé.
À Searles Lake, en Californie, le borax est présent dans la saumure à une concentration d’environ 1,5 % (exprimée en borax anhydre) avec divers sels. Une méthode d’extraction liquide-liquide sépare sélectivement le borate de la saumure.
Le borate est extrait dans un solvant insoluble dans l’eau, tel que le kérosène, à l’aide d’un polyol aromatique qui complexe efficacement l’ion borate.
La phase organique est isolée et acidifiée avec de l’acide sulfurique, donnant une solution aqueuse contenant de l’acide borique et du sulfate de sodium. La liqueur est concentrée par évaporation puis refroidie pour induire la cristallisation de l’acide borique.
4. Utilisations de l’acide borique
Les borates, y compris l’acide borique, sont des ingrédients clés dans divers fluides industriels tels que les antigels/liquides de refroidissement automobiles, les liquides de frein, les huiles lubrifiantes, les graisses, les fluides de travail des métaux et les fluides hydrauliques. Ils contribuent à améliorer la lubrification, la réduction de l’usure, le tampon, l’inhibition de la corrosion, l’évacuation de l’eau et la stabilité thermique.
L’acide borique est utilisé dans les adhésifs commerciaux, en particulier dans les adhésifs à base d’amidon et de dextrine. Ces adhésifs sont utilisés dans la fabrication de produits en papier et en carton, notamment les boîtes en carton ondulé, les cartons, les tubes et les sacs d’épicerie. L’acide borique sert d’agent de réticulation, améliorant la viscosité, le collant et les propriétés fluides.
L’acide borique trouve des applications dans la récupération du pétrole et du gaz. Il est utilisé dans la production de fluides rhéologiques pour les applications sur les champs pétrolifères, contribuant aux opérations de fracturation hydraulique et retardant le taux de prise des ciments Portland utilisés dans les applications de construction de puits de pétrole et de gaz.
L’acide borique en solutions alcalines est utilisé pour inhiber la corrosion dans les systèmes de traitement de l’eau, notamment les systèmes de recirculation d’eau, les chaudières à vapeur, les échangeurs de chaleur et les systèmes de chauffage/refroidissement. Il empêche la corrosion grâce à des mécanismes de passivation anodique et de tampon.
L’acide borique est un nutriment essentiel pour les plantes et son apport en supplément dans les sols déficients est une pratique agricole courante. L’acide borique est appliqué à diverses cultures, notamment le palmier à huile, les arachides, les pommes, les raisins, les olives, la luzerne, le coton, le canola, la betterave sucrière et d’autres cultures fruitières et maraîchères, pour améliorer la qualité et les rendements des cultures.
L’acide borique est utilisé dans la lutte antiparasitaire, en particulier contre des espèces d’insectes spécifiques, notamment les termites, les blattes, les fourmis charpentières et les coléoptères destructeurs du bois. Il est appliqué sous forme de solution aqueuse concentrée dans le traitement curatif des infestations de termites dans les habitations résidentielles.
Les borates, y compris l’acide borique, sont utilisés depuis longtemps dans les applications de nettoyage et de lessive et comme ingrédients dans les produits de soins personnels. Ils contribuent au tamponnage, à la suspension, à l’anti-reposition des particules de saleté et de taches, à l’adoucissement de l’eau, au contrôle de la viscosité, à l’émulsification, à la stabilisation de la mousse, au contrôle des odeurs et à l’inhibition de la corrosion.
L’acide borique est largement utilisé dans les applications ignifuges. Il est efficace pour réduire l’inflammabilité des matériaux cellulosiques, tels que les produits en bois, les isolants cellulosiques et les ouates de coton. L’acide borique est ajouté à divers matériaux, notamment aux polymères, pour améliorer la résistance au feu.
Les borates et l’acide borique ont de multiples utilisations en métallurgie, notamment les opérations de fusion pour la récupération de métaux précieux et non ferreux, le tréfilage, la boruration, le brasage, le soudage et la fabrication d’alliages.
L’acide borique est utilisé dans les réacteurs à eau sous pression de l’industrie nucléaire. Différentes concentrations d’acide borique dans le liquide de refroidissement primaire sont utilisées pour contrôler l’état stable du réacteur ainsi que des barres de commande. L’acide borique et d’autres borates sont également utilisés dans les systèmes d’arrêt d’urgence des réacteurs.
L’acide borique est particulièrement utilisé dans l’industrie de la pâte kraft, en utilisant un procédé connu sous le nom d’autocaustification partielle du borate (PBAC).
5. Toxicologie de l’acide borique
- L’acide borique a une faible toxicité aiguë.
- L’acide borique n’est pas un irritant ni un sensibilisant cutané.
- L’acide borique n’est ni cancérigène ni mutagène.
- L’acide borique peut avoir des effets sur le développement des rats, des souris et des lapins.
- L’acide borique peut avoir des effets néfastes sur la reproduction mâle chez les animaux de laboratoire, mais il n’existe aucune preuve claire d’effets sur la reproduction mâle chez l’homme imputables au bore.
- Les limites d’exposition professionnelle à l’acide borique sont de 2 mg/m³.
Référence
- Boric Oxide, Boric Acid, and Borates; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a04_263.pub2