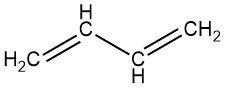
Le 1,3-Butadiène est un gaz incolore avec une odeur semblable à celle de l’essence. C’est le membre le plus simple de la série des diènes conjugués, qui contiennent la structure C=C-C=C, le C étant le carbone.
Le butadiène fait généralement référence au 1,3-butadiène (106-99-0), un hydrocarbure insaturé en C4 très important. Son homologue thermodynamiquement moins stable, le 1,2-butadiène (590-19-2), a une pertinence industrielle négligeable.
1,3-Butadiène : CH2=CH–CH=CH2
1,2-Butadiène : CH2=C=CH–CH3
Le butadiène est un produit pétrochimique crucial, avec une production mondiale dépassant les 10 millions de tonnes par an.
Table des matières
1. Propriétés physiques du butadiène
Le butadiène est un gaz incolore dans des conditions normales. Certaines propriétés physiques sont résumées dans le tableau suivant :
| Propriété | Valeur |
|---|---|
| Point d'ébullition à 101,3 kPa | -4,4 °C |
| Point de fusion à 101,3 kPa | -108,9 °C |
| Température critique | 425 000 |
| Pression critique | 4,32 MPa |
| Volume molaire critique | 221 cm³/mol |
| Densité (liquide, 0 °C) | 0,646 g/cm³ |
| Densité (liquide, 25 °C) | 0,616 g/cm³ |
| Densité (liquide, 50 °C) | 0,582 g/cm³ |
| Densité du gaz (par rapport à l'air) | 1,87 |
| Pression de vapeur (-4,4°C) | 101,3 kPa |
| Pression de vapeur (0 °C) | 120,0 kPa |
| Pression de vapeur (25 °C) | 273,6 kPa |
| Pression de vapeur (50 °C) | 537,9 kPa |
| Pression de vapeur (75 °C) | 986,7 kPa |
| Pression de vapeur (100 °C) | 1 733 kPa |
| Viscosité (liquide, 0 °C) | 0,25 mPa·s |
| Viscosité (liquide, 50 °C) | 0,20 mPa·s |
| Enthalpie de vaporisation (25 °C) | 20,86 kJ/mol |
| Enthalpie de vaporisation (-4,4 °C) | 22,47 kJ/mol |
| Enthalpie de formation (gazeux, 298 K, 101,3 kPa) | 110,0 kJ/mol |
| Enthalpie libre de formation (gazeuse, 298 K, 101,3 kPa) | 151,5 kJ/mol |
| Enthalpie de combustion (gazeux, 298 K, 101,3 kPa) | 2 541,5 kJ/mol |
| Enthalpie d'hydrogénation en butane (gazeux, 298 K, 101,3 kPa) | 235,7 kJ/mol |
| Entropie de formation (liquide, 298 K, 101,3 kPa) | 199,0 J·mol⁻¹·K⁻¹ |
| Enthalpie de fusion (164,2 K, 101,3 kPa) | 7,988 kJ/mol |
Le butadiène a une solubilité limitée dans l’eau. Il est soluble dans le méthanol et l’éthanol, et hautement soluble dans les solvants polaires à point d’ébullition élevé comme la méthylpyrrolidone.
Plusieurs propriétés techniques sont cruciales pour une manipulation sûre du butadiène. Ceux-ci incluent :
- Point d’éclair : -85 °C
- Température d’inflammation : 415 °C
Le butadiène non stabilisé ou insuffisamment stabilisé peut réagir avec l’oxygène atmosphérique pour former des peroxydes explosifs.
2. Propriétés chimiques du butadiène
Le butadiène, possédant deux doubles liaisons conjuguées, participe à diverses réactions, notamment les additions 1,2 et 1,4 avec lui-même (polymérisation) et d’autres réactifs, la dimérisation linéaire, la trimérisation et la formation de cycles.
Polymérisation :
La réaction la plus importante pour le butadiène implique une polymérisation par addition 1,2 et 1,4, conduisant à une variété de polymères. La nature de ces polymères dépend des méthodes de préparation et du système catalytique utilisé, ce qui donne lieu à des caoutchoucs synthétiques et à des résines polymères d’importance industrielle.
Autres réactions d’addition :
Le butadiène subit une addition 1,2 ou 1,4 avec divers réactifs, les proportions de produits d’addition dépendant des conditions de réaction. Ces produits d’addition servent d’intermédiaires cruciaux dans la production de substances telles que le chloroprène et l’hexaméthylènediamine.
Réactions spécifiques :
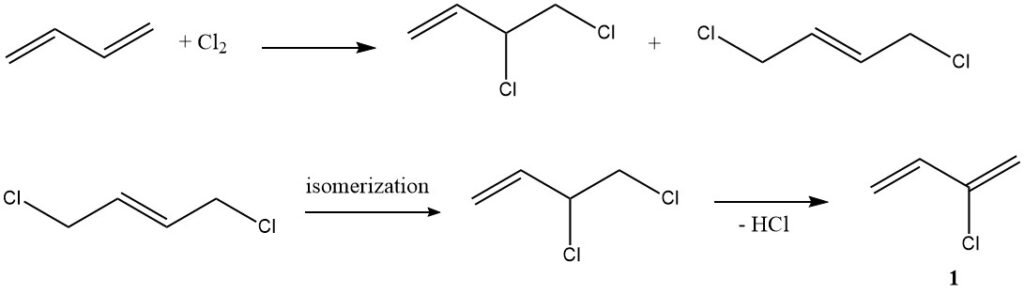
1. Chloration (production de chloroprène) : dans un exemple typique d’addition électrophile, le butadiène réagit avec le chlore pour donner du chloroprène (1), un composé aux multiples applications industrielles.
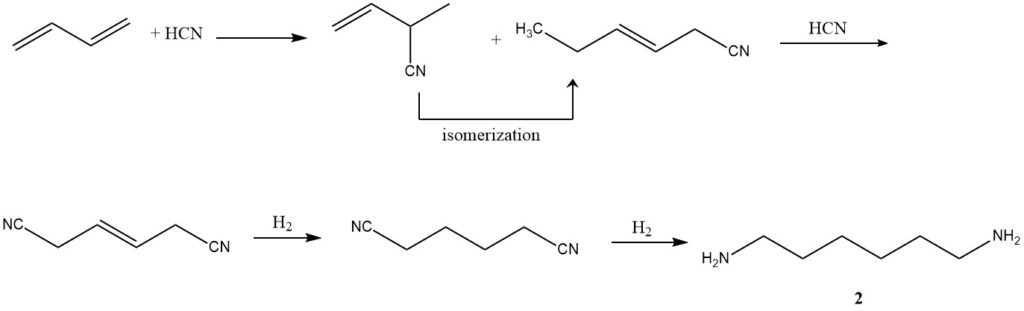
2. Hydrocyanation (production d’adiponitrile) : employant un processus en trois étapes développé par Du Pont, le butadiène subit une hydrocyanation pour former un mélange de nitriles de pentène isomères linéaires et ramifiés. L’isomérisation ultérieure et l’hydrocyanation ultérieure donnent l’adiponitrile (2).
3. Carboalcoxylation (production d’ε-caprolactame) : DSM et Du Pont ont exploré un procédé alternatif pour la production d’ε-caprolactame à partir du butadiène. Ce processus en plusieurs étapes implique une carboalcoxylation, une hydroformylation et une amination réductrice. Même s’il n’est pas encore mis en œuvre à l’échelle industrielle, il présente une voie prometteuse pour un développement futur.
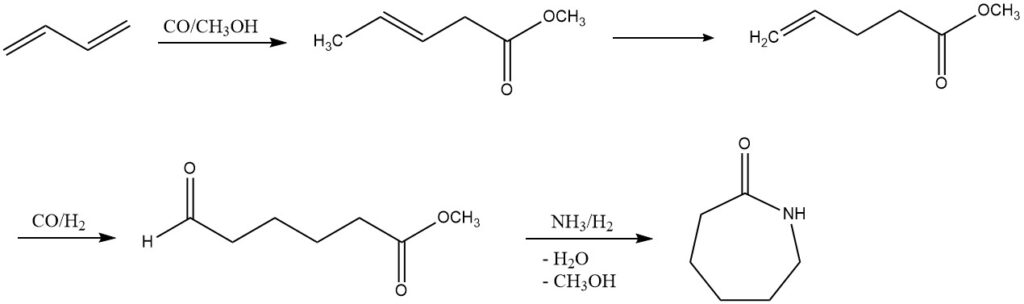
4. Acétoxylation (production de 1,4-butanediol ou de tétrahydrofurane) : Par acétoxylation, le butadiène conduit à la synthèse du 1,4-diacétoxy-2-butène, qui, dans un procédé Mitsubishi en plusieurs étapes, est converti en 1,4- butanediol ou tétrahydrofuranne. Ces processus, sous l’influence de catalyseurs spécifiques, mettent en valeur le potentiel de diverses transformations chimiques.
5. Autres réactions d’oxydation : Des procédés innovants, tels que le procédé Toyo Soda et l’oxydation directe avec de l’air ou de l’oxygène, représentent des méthodes économiques pour la production de divers dérivés C4. L’introduction du 3,4-époxy-1-butène par oxydation ouvre la voie à la création d’intermédiaires chimiques précieux.
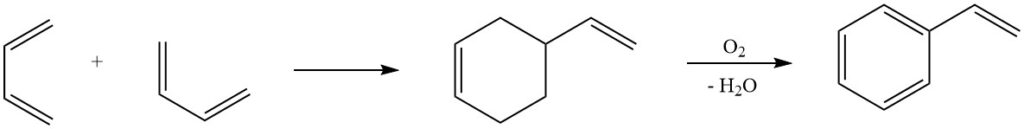
6. Réaction Diels-Alder : L’une des réactions les plus connues du butadiène, la réaction Diels-Alder, joue un rôle crucial dans les processus industriels de production de styrène. La dimérisation du butadiène et sa conversion ultérieure en styrène mettent en évidence la polyvalence de cette réaction dans la synthèse de composés chimiques précieux.
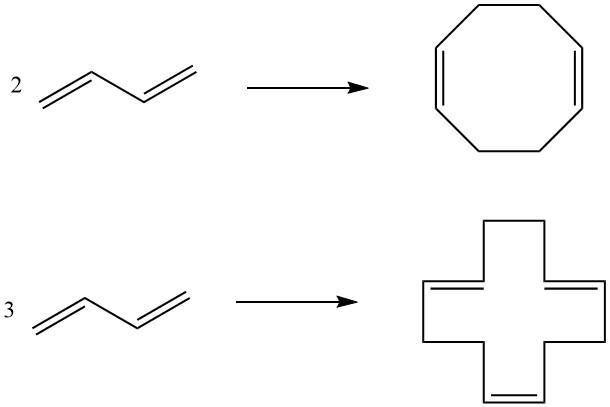
7. Cyclodimérisation, cyclotrimérisation : Deux molécules de butadiène peuvent subir une cyclodimérisation pour produire du 1,5-cyclooctadiène, tandis que trois molécules donnent du 1,5,9-cyclododécatriène. Ces composés cycliques, facilités par des catalyseurs spécifiques, servent d’intermédiaires dans la production de polyamides supérieurs.
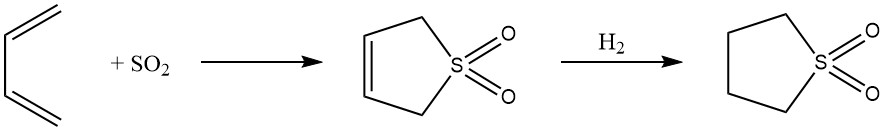
8. 1,4-cycloaddition : L’addition 1,4 réversible de butadiène avec du dioxyde de soufre conduit à la formation de sulfone cyclique 2,5-dihydrothiophène-1,1-dioxyde, ensuite convertie en sulfolane. Ce procédé met en valeur l’adaptabilité du butadiène dans la synthèse de solvants hautement polaires.
9. Dimérisation et trimérisation linéaire ; Télomérisation : sous l’influence de catalyseurs Ni, Co, Pd ou Fe, le butadiène subit une dimérisation ou une trimérisation linéaire. Les oligomères linéaires résultants, séparés par longueur de chaîne, offrent divers composés, tels que le 1,3,7-octatriène.
La réaction de télomérisation est la di- et l’oligomérisation d’un 1,3-diène sous addition d’un composé nucléophile. Il est catalysé par Pd, Ni ou Pt et donne un large spectre de produits en fonction du nucléophile utilisé.
10. Hydrogénation : L’hydrogénation sélective du butadiène génère du 1-butène ou du 2-butène, et un ajustement minutieux des conditions de réaction garantit une conversion suffisante sans surhydrogénation en n-butane. Les processus commerciaux d’entreprises comme Axens, UOP et Lummus proposent des approches personnalisées pour maximiser le rendement d’isomères spécifiques du butène.
11. Formation de complexes : le butadiène forme des complexes avec divers composés métalliques, tels que les sels de Cu(I). Bien qu’historiquement utilisées dans l’extraction du butadiène, les techniques modernes de distillation extractive ont largement remplacé cette méthode.
Les complexes avec d’autres métaux de transition comme Fe, Ni, Co, Pd et Pt sont bien établis et contribuent aux études mécanistiques sur la catalyse de polymérisation des alpha-oléfines.
3. Production de Butadiène
Historiquement, diverses méthodes existaient pour la production de butadiène. Aujourd’hui, quatre voies principales demeurent :
- Craquage du naphta : cette voie dominante capture le butadiène en tant que sous-produit de la production d’éthylène.
- Déshydrogénation du butane/butène : ce processus joue un rôle mineur, basé sur les campagnes, en fonction des prix des matières premières et du butadiène.
- Production d’éthanol : Cette méthode a perdu de son importance.
- Production d’acétylène : cette voie n’est plus commercialement viable.
Des approches biosourcées émergentes sont en cours d’exploration.
L’économie de la production de butadiène est fortement influencée par la production couplée d’éthylène et de propylène. Lorsque ces oléfines C2 et C3 sont peu coûteuses, la production dédiée de butadiène à partir de butènes et de butane devient plus attractive.
3.1. Production à partir d’acétylène
Historiquement, deux voies étaient utilisées pour produire du butadiène à partir de l’acétylène. Les deux sont désormais obsolètes en raison de la nature coûteuse et énergivore de la production d’acétylène. Seules les premières étapes du procédé Reppe, conduisant au 1,4-butanediol et au tétrahydrofurane, restent commercialement pertinentes.
3.2. Production à partir d’éthanol
Les procédés IPATJEW et OSTROMISLENSKY, modifiés par la suite par LEBEDEW, ont autrefois servi de source clé de butadiène, notamment en Allemagne et en Europe de l’Est pendant la Seconde Guerre mondiale. Ce processus est illustré par la réaction :
2 CH3CH2OH → CH2=CHCH=CH 2 + 2 H2O + H2
et exploité à des températures allant de 370 à 450 °C en utilisant MgO – SiO2 ou SiO2 – Catalyseurs Al2O3, il atteint des sélectivités allant jusqu’à 70 %.
Bien qu’il ne soit plus compétitif pour une production à grande échelle, il peut encore être viable dans les régions disposant d’éthanol bon marché ou d’alcool agricole excédentaire.
3.3. Déshydrogénation du Butane et des Butènes
La déshydrogénation du butane et des butènes pour produire du butadiène présente des défis uniques en raison de sa nature endothermique. Pour maximiser le rendement et la sélectivité, plusieurs considérations clés doivent être prises en compte :
Le principe de Le Chatelier : L’abaissement de la pression partielle des produits souhaités, le butadiène et l’hydrogène, fait avancer la réaction. Ceci peut être réalisé par opération sous vide ou en ajoutant de la vapeur au mélange réactionnel.
Avantages de Steam :
- La vapeur aide à atténuer la désactivation du catalyseur en empêchant la formation de coke à la surface du catalyseur.
- La nature endothermique de la réaction de déshydrogénation nécessite un apport de chaleur externe. La vapeur se condense facilement, libérant une chaleur importante pour déclencher la réaction.
- La vapeur condensée peut être facilement séparée du flux de produit, garantissant ainsi une contamination minimale.
Bien que des températures plus élevées favorisent la formation de butadiène, elles augmentent également le risque de réactions secondaires indésirables telles que la fissuration, l’isomérisation et la polymérisation. Trouver l’équilibre optimal de température entre rendement et sélectivité est crucial.
Les composés sensibles aux réactions secondaires susmentionnées sont éliminés avant le processus de déshydrogénation afin de minimiser leur influence.
Comme la réaction de déshydrogénation n’est pas terminée, le flux de produit nécessite une séparation pour isoler le butadiène. Les matières premières n’ayant pas réagi sont recyclées dans le processus pour maximiser l’efficacité.
En contrôlant soigneusement ces aspects, la déshydrogénation du butane et des butènes peut être optimisée pour une production efficace et sélective de butadiène.
3.3.1. Déshydrogénation du n-Butane
Il existe deux méthodes principales pour déshydrogéner le n-butane en butadiène :
1. Procédé Houdry-Catadiène :
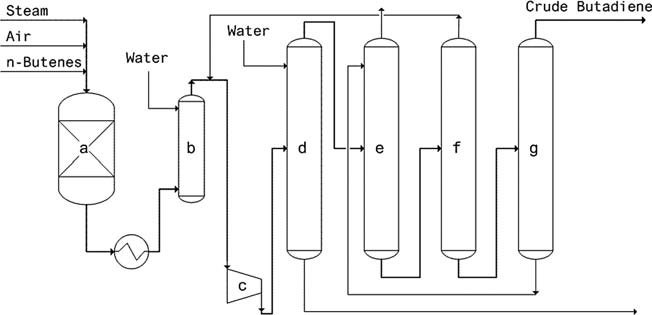
Ce procédé établi en une seule étape est utilisé commercialement depuis 1943. Plusieurs réacteurs à lit garni, disposés en parallèle, alternent entre les phases de réaction et de régénération. Un catalyseur à base d’oxyde d’aluminium contenant 20 % d’oxyde de chrome facilite la déshydrogénation du n-butane pur ou de son mélange avec des n-butènes à 550-650 °C et 10-25 kPa.
Les températures élevées favorisent la production de butadiène mais génèrent également des sous-produits indésirables tels que des hydrocarbures en C1-C3, de l’hydrogène et du coke encrassant les catalyseurs.
Après chaque cycle de réaction (5 à 15 minutes), le réacteur subit une régénération : la combustion du dépôt de coke libère de la chaleur, stockée dans le catalyseur et le matériau inerte, pour la phase réactionnelle suivante.
Ce procédé donne une concentration de butadiène de 15 à 18 % en sortie de réacteur. Les étapes de récupération ultérieures, notamment la trempe, la compression, le stripping et la séparation, augmentent la concentration de butadiène jusqu’à 30 à 50 %. A partir de 1 000 tonnes de n-butane, on obtient environ 550 tonnes de butadiène. Le butadiène pur peut être isolé par distillation extractive.
2. Processus Phillips Petroleum :
Ce processus en deux étapes offre des avantages tels qu’une durée de vie plus longue du catalyseur et des rendements en butadiène plus élevés.
- Déshydrogénation en butène : le n-Butane subit une déshydrogénation catalytique en butène à 600°C et 1 bar sur un Cr2O3– Catalyseur Na2O-Al2O3.
- Séparation du butène : les n-butènes sont extraits à l’aide d’auxiliaires comme l’acétone, l’acétonitrile ou le furfural.
- Formation de butadiène : les n-butènes séparés sont déshydrogénés en butadiène dans un réacteur tubulaire isotherme. Le réacteur est chauffé par les gaz de combustion à 600 °C et fonctionne à 1 bar de pression avec ajout de vapeur surchauffée sur un Catalyseur Fe2O3-K2O-Al2O3.
- Récupération et purification du butadiène : la distillation extractive avec les auxiliaires susmentionnés récupère et purifie le butadiène.
Le procédé Phillips présente des durées de fonctionnement plus longues (pas de régénération du catalyseur) et un rendement en butadiène de 65 % sur la base du n-butane, démontrant son efficacité et sa sélectivité améliorée par rapport au procédé Houdry-Catadiène.
3.3.2. Déshydrogénation des n-Butènes
Les n-butènes, que l’on trouve couramment dans l’essence de craquage, la production d’oléfines et la déshydrogénation du GPL, sont souvent présents dans un mélange d’hydrocarbures en C4. Alors que les paraffines C4 peuvent être séparées des oléfines C4 par distillation extractive (comme dans la récupération du butadiène), la séparation de l’isobutène et du n-butène pose un défi unique en raison de leurs points d’ébullition proches.
Plusieurs méthodes résolvent cet obstacle à la séparation :
1. Processus BASF : utilise 40 à 45 % de H2SO4 pour convertir sélectivement l’isobutène en tert-butanol, permettant une séparation plus facile.
2. L’isobutène peut être converti en méthyltert-butyléther ou en oligomères d’isobutène pour un traitement et une séparation ultérieurs.
3. Distillation avec hydroisomérisation : des procédés comme l’Isopure d’Axens et le CD DeIB de CD-Tech combinent la distillation avec l’hydroisomérisation du 1-butène en 2-butène. Étant donné que le 2-butène présente un point d’ébullition distinct de celui de l’isobutène, la distillation devient réalisable.
4. Procédé Dow : utilise la déshydrogénation des n-butènes avec de la vapeur sur un catalyseur au phosphate Ca/Ni stabilisé avec Cr2O3. La vapeur surchauffée fournit la chaleur nécessaire à la réaction, permettant d’obtenir une conversion du butène de 50 % et une sélectivité en butadiène jusqu’à 90 %.
5. Approche des réacteurs parallèles : Comme le procédé Dow nécessite une régénération du catalyseur après 15 minutes, des réacteurs parallèles sont utilisés, permettant un fonctionnement continu.
Des procédés similaires ont également été développés par Shell et Phillips Petroleum, mettant en valeur les diverses approches disponibles pour la déshydrogénation du n-butène et la production de butadiène.
3.3.3. Déshydrogénation oxydative des n-butènes
La déshydrogénation oxydative (ODH) offre plusieurs avantages par rapport aux processus de déshydrogénation conventionnels pour la production de butadiène. En éliminant l’hydrogène de l’équilibre par oxydation, l’ODH améliore considérablement la conversion et la sélectivité :
2 C4H8 + O2 → 2 C4H6 + 2H2O
Cette réaction exothermique fournit de la chaleur pour la déshydrogénation endothermique, réduisant ainsi davantage les besoins énergétiques. De plus, la présence d’oxygène et de vapeur contribue à minimiser la cokéfaction du catalyseur.
Processus ODH historiques :
- Procédé Oxo-D (Petro-Tex) : ce procédé, utilisé depuis 1965, utilise un catalyseur en ferrite et fonctionne sous une légère pression. Les avantages incluent une faible consommation de vapeur et d’énergie de chauffage, une conversion/sélectivité élevée, une longue durée de vie du catalyseur et aucune exigence de régénération.
- Procédé O-X-D (Phillips) : en fonctionnement depuis 1976, ce procédé utilise un catalyseur Li-Sn-P-O et atteint une conversion du butène de 75 à 80 % avec une sélectivité en butadiène de 88 à 92 %.
Développements récents en matière d’ODH :
- Procédé Nippon-Zeon : ce procédé utilise un mélange de n-butène/butane et d’air/dégagement gazeux comme alimentation, offrant une flexibilité dans la composition de l’alimentation. Un catalyseur à base d’oxydes métalliques mixtes permet d’obtenir un rendement en butadiène de 85 % sur la base des butènes.
- Procédé chimique Mitsubishi : ce procédé utilise un catalyseur Mo/Bi/Co et convertit un mélange C4 contenant 70 % de n-butène avec de l’air, de la vapeur et de l’azote. L’ajout d’azote permet d’obtenir un rapport oxygène/butane élevé, minimisant ainsi la cokéfaction. La conversion du butadiène dépasse 80 % avec une sélectivité supérieure à 90 %.
- Autres développements : Asahi Kasai et Mitsui Chemicals ont également développé des procédés ODH avec des résultats prometteurs, notamment des réacteurs à lit fluidisé et des stratégies de conversion de l’éthylène en butadiène.
Avantages globaux de l’ODH :
- Conversion et sélectivité supérieures par rapport aux processus de déshydrogénation classiques.
- Besoins énergétiques réduits grâce à la réaction d’oxydation exothermique.
- Réduire la cokéfaction du catalyseur.
- Possibilité d’utiliser des flux C4 mixtes comme matière première.
Limites :
- Les processus ODH sont généralement plus complexes que la déshydrogénation conventionnelle.
- Les températures élevées requises peuvent entraîner la formation de sous-produits indésirables si l’oxygène est utilisé avec le butane
3.4. Isolement du butadiène des fractions de vapocraqueur C4
Le butadiène est isolé principalement des fractions C4 générées lors du vapocraquage des hydrocarbures. Le choix de la matière première, comme le naphta en Europe occidentale et le GPL aux États-Unis, joue un rôle important dans le processus, tandis que la gravité du craquage influence principalement la composition de la fraction C4.
Séparer le butadiène de ce mélange présente un défi en raison de son comportement azéotropique avec le butane. Par conséquent, des techniques spécialisées sont nécessaires.
Le procédé à l’acétate d’ammonium cuivreux, utilisant sa capacité à former un complexe avec le butadiène, résout ce problème pour les fractions à faible teneur en butadiène et en acétylène C4. Cependant, des niveaux plus élevés d’acétylènes nécessitent un prétraitement via une hydrogénation sélective.
La distillation extractive apparaît comme la méthode privilégiée pour l’isolement du butadiène. Cette technique exploite les différentes affinités de différents composants envers des solvants organiques spécifiques en fonction de leur degré d’insaturation.
Les solvants populaires incluent l’acétonitrile (de Shell/KBR et LyondellBasell), la N-méthylpyrrolidone (de BASF), le diméthylformamide (de Nippon Zeon Chemicals) et le furfural (de ConocoPhillips). ).
Ces processus, impliquant une ou deux étapes de distillation extractive couplées à une distillation conventionnelle, séparent le butadiène et d’autres composants de haute affinité des butanes et butènes moins solubles. D’autres étapes de purification éliminent les impuretés restantes pour atteindre la pureté du butadiène.
Le procédé BASF, qui utilise le NMP comme solvant, présente des propriétés non corrosives et des rendements élevés en butadiène, tandis que le procédé Nippon Zeon DMF présente des avantages similaires.
Les avancées récentes dans ce domaine incluent la technologie des parois de séparation, combinant deux étapes de distillation dans une seule unité pour améliorer l’efficacité, ainsi que des composants internes de distillation et un contrôle de processus améliorés pour augmenter la capacité et les performances des unités existantes.
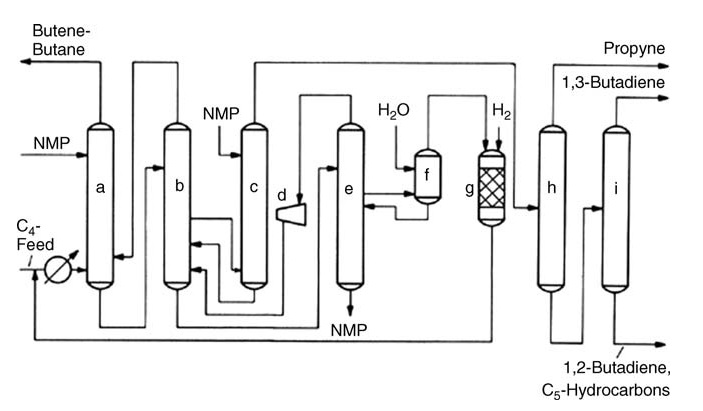
a) Lavage principal ; b) Redresseur ; c) Après le lavage ; d) Compresseur centrifuge ; e) Tour de dégazage ; f) Laveuse à eau ; g) Réacteur d'hydrogénation ; h) Première distillation ; i) Deuxième distillation
Des approches alternatives telles que l’hydrogénation sélective des acétylènes en C4 offrent divers avantages. Le procédé KLP d’UOP élimine les acétylènes avant l’extraction, simplifiant ainsi le processus et augmentant le rendement en butadiène. Le procédé CDHYDRO de CDTECH offre une flexibilité en permettant différents niveaux de conversion de l’acétylène, minimisant ainsi la perte de butadiène.
3.5. Butadiène issu de ressources biologiques
La tendance croissante à utiliser des ressources renouvelables pour la production pétrochimique s’étend au butadiène. Bien qu’il existe diverses voies, celles utilisant les bioalcools sont les plus prometteuses.
La production de bioéthanol, établie par la fermentation de canne à sucre, de maïs ou la matière lignocellulosique, a atteint 68 millions de tonnes dans le monde en 2011. Les technologies existantes permettent de convertir le bioéthanol en butadiène.
Bien qu’il n’existe actuellement aucune production de biobutadiène à grande échelle, l’intérêt croissant pour le biobutanol en tant qu’additif pour carburant alimente le développement continu de procédés. Déshydratation et déshydrogénation du biobutanol en n-butène.
Une autre voie potentielle implique la fermentation gazeuse du monoxyde de carbone, obtenu à partir de la gazéification de matières organiques ou de gaz résiduaires industriels. Ce processus bactérien produit du 2,3-butanediol, un précurseur du butadiène. Cependant, cette technologie en est encore à ses débuts.
Actuellement, la production de butadiène d’origine biologique manque de compétitivité économique par rapport à la voie pétrochimique. Cependant, la hausse des prix du pétrole et du gaz naturel, associée à de nouveaux progrès technologiques, pourrait favoriser les voies de biotransformation à l’avenir.
4. Utilisations et importance économique du butadiène
Le butadiène est principalement utilisé comme monomère ou comonomère dans la production de caoutchouc synthétique. Il contribue au caoutchouc styrène-butadiène (SBR), au caoutchouc polybutadiène (BR), au caoutchouc acrylonitrile-butadiène (NBR) et au caoutchouc chloroprène (CR).
Au-delà de la production de caoutchouc, le butadiène joue un rôle crucial dans plusieurs plastiques. Il constitue l’épine dorsale du polystyrène résistant aux chocs, un système biphasé combinant polystyrène et polybutadiène. De plus, le butadiène contribue aux polymères ABS, un mélange d’acrylonitrile, de butadiène et de styrène, et de copolymères MBS. , utilisé comme modificateurs pour le chlorure de polyvinyle.
De plus, le butadiène sert d’intermédiaire dans diverses synthèses chimiques.
Aux États-Unis, au Japon et en Europe occidentale, l’industrie automobile constitue le principal consommateur de caoutchouc butadiène.
Les prix du butadiène ont connu une baisse significative au début des années 1990 en raison d’une offre excédentaire due à l’augmentation des capacités de craquage. Cela a conduit à l’hydrogénation du butadiène et à son utilisation comme matière première de craquage.
Depuis la fin des années 1990, la demande croissante de produits en caoutchouc et de polymères, notamment en Asie, a alimenté une augmentation exponentielle de la demande de butadiène et une hausse constante des prix.
La récession économique mondiale de 2008 a déclenché une chute spectaculaire de la demande de butadiène, suivie d’une reprise. Les prix du butadiène ont dépassé ceux de l’éthylène, un phénomène rare, jusqu’à ce que la volatilité conduise à des pics dépassant les 2 000 euros la tonne.
Ces fluctuations de prix peuvent être attribuées à l’arrivée de craqueurs à base d’éthane au Moyen-Orient et au déplacement des craqueurs américains vers des matières premières gazeuses plus légères. Ces changements entraînent une réduction du rendement en butadiène malgré une demande mondiale croissante.
5. Toxicologie du butadiène
Exposition et toxicité :
- L’exposition professionnelle au butadiène est la plus élevée dans les industries pétrochimiques, de purification et de transformation du butadiène, ainsi que dans la fabrication de produits en caoutchouc et en plastique.
- Le butadiène pénètre principalement dans l’organisme par inhalation, le contact avec la peau étant moins fréquent.
- L’exposition non professionnelle peut survenir à proximité de sources ponctuelles telles que les incendies, la fumée de cigarette et les émissions des véhicules, bien qu’à des niveaux beaucoup plus faibles qu’en milieu professionnel.
Études sur les animaux :
- Le butadiène présente une faible toxicité aiguë, avec des doses élevées provoquant une narcose précédée d’une excitation et d’une hyperventilation.
- Une exposition répétée à court terme à des concentrations élevées (4 000 à 8 000 ppm) provoque la salivation chez les rats mais n’affecte pas la croissance, la consommation alimentaire ou d’autres paramètres.
- Les souris exposées à des niveaux similaires présentent une diminution du poids corporel et une mortalité accrue, avec une sensibilité plus élevée au butadiène par rapport aux rats.
- Une exposition à long terme chez le rat (jusqu’à 111 semaines) entraîne une sécrétion nasale transitoire, une ataxie et une mortalité précoce à la concentration la plus élevée (8 000 ppm). Cela augmente également le poids du foie et suggère un potentiel de métaplasie dans les poumons et une incidence plus élevée de certaines tumeurs.
- Les souris exposées à des concentrations plus faibles (625 à 1 250 ppm) pendant 60 à 61 semaines présentent des lésions toxiques et prolifératives dans la cavité nasale, une nécrose du foie et une atrophie des organes reproducteurs. . Notamment, ils développent diverses tumeurs, y compris des tumeurs malignes, plus tôt et à des taux plus élevés que les témoins.
- Une étude de deux ans avec des concentrations encore plus faibles (6,25 à 625 ppm) révèle le développement précoce de lymphomes étendus, de tumeurs cardiaques inhabituelles et de tumeurs pulmonaires chez la souris.
Métabolisme et mutagénicité :
- Le butadiène est métabolisé dans le foie pour former des intermédiaires époxydes, qui sont soupçonnés d’être les principaux contributeurs à sa toxicité et à sa cancérogénicité.
- La formation de ces métabolites est plus prononcée chez la souris que chez le rat et l’homme.
- Le butadiène présente un pouvoir mutagène dans le test d’Ames uniquement en présence d’enzymes, suggérant la formation d’un intermédiaire mutagène.
Données humaines :
- Des données humaines limitées sont disponibles sur les effets de l’exposition au butadiène.
- Les volontaires exposés à une concentration très élevée (8 000 ppm) ont ressenti une irritation temporaire, une vision floue et des symptômes respiratoires, mais aucun effet cumulatif n’a été observé.
- Les études hématologiques réalisées sur des travailleurs exposés à des niveaux moyens de 20 ppm de butadiène n’ont montré aucune anomalie significative.
- Les premières études de mortalité des travailleurs de l’industrie du caoutchouc styrène-butadiène n’ont pas suggéré d’augmentation du risque de cancer.
- Des revues récentes d’études épidémiologiques fournissent des preuves d’un risque accru de tumeurs malignes hématolymphatiques, en particulier de leucémie, en cas d’exposition élevée au butadiène.
Classification et limites d’exposition sur le lieu de travail :
- Sur la base de données animales et humaines, le butadiène est classé comme cancérogène du groupe 1 par le Centre international de recherche sur le cancer (CIRC).
- Les limites d’exposition professionnelle varient légèrement selon les différents organismes de réglementation, avec des limites allant de 0,5 à 4,4 mg/m3.
- Des efforts continus sont déployés pour réduire les niveaux d’exposition sur les lieux de travail manipulant du butadiène.
Référence
- Butadiene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_431.pub2


