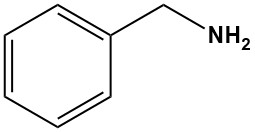
Benzylamin ist eine organische Verbindung mit der chemischen Formel C6H5CH2NH2. Es ist eine farblose Flüssigkeit mit einem charakteristischen Amingeruch. Es ist ein primäres Amin mit einem daran befestigten Benzolring.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Benzylamin
| Eigenschaft | Wert |
|---|---|
| Synonyme | α-Aminotoluol, Phenylmethylamin |
| Chemische Formel | C7H9N |
| Molekulargewicht | 107,16 g/mol |
| Physisches Erscheinungsbild | Farblose Flüssigkeit mit schwach aminartigem Geruch |
| Löslichkeit | Mischbar mit Wasser, Alkohol und Diethylether |
| Siedepunkt | 184,5 °C bei 101,3 kPa 90 °C bei 1,6 kPa |
| Erstarrungspunkt | < -30 °C |
| Dampfdruck | ca. 60 Pa bei 20 °C ca. 130 Pa bei 30 °C 520 Pa bei 50 °C |
| Verdampfungswärme | 49 kJ/mol |
| Verbrennungswärme | 4058,7 kJ/mol bei 101,3 kPa und 20 °C |
| Brechungsindex bei 20 °C | 1.5401 |
| Dichte bei 20 °C | 0,9813 |
| Dielektrizitätskonstante | 4,6 bei 20,6 °C |
| Elektrolytische Dissoziationskonstante in Wasser | 2,35 × 10-5 bei 20 °C |
| Viskosität | 1,78 mPa·s bei 21,2 °C 0,295 mPa·s bei 178,2 °C |
| Oberflächenspannung | 38,82 × 10-5 N/cm bei 21,1 °C 31,70 × 10-5 N/cm bei 88 °C |
| Selbstentzündungstemperatur | 390 °C |
| Flammpunkt | 65 °C |
| Explosionsgrenze | 0,9 % (unten) bis 14 % (oben) |
| Dipolmoment (20 °C) | 1,18 D (rein), 1,25 D in Toluol, 1,29 D in Hexan, 1,30 D in Cyclohexan, 1,33 D in Benzol |
| Dynamische Viskosität | 0,01596 g cm-1 s-1 bei 25 °C |
| Absorptionsmaximum lmax in Wasser | 255,9 nm (e 249 L mol-1 cm-1) |
| Magnetische Suszeptibilität | −75,3 × 10-6 cm3/mol |
2. Chemische Reaktionen von Benzylamin
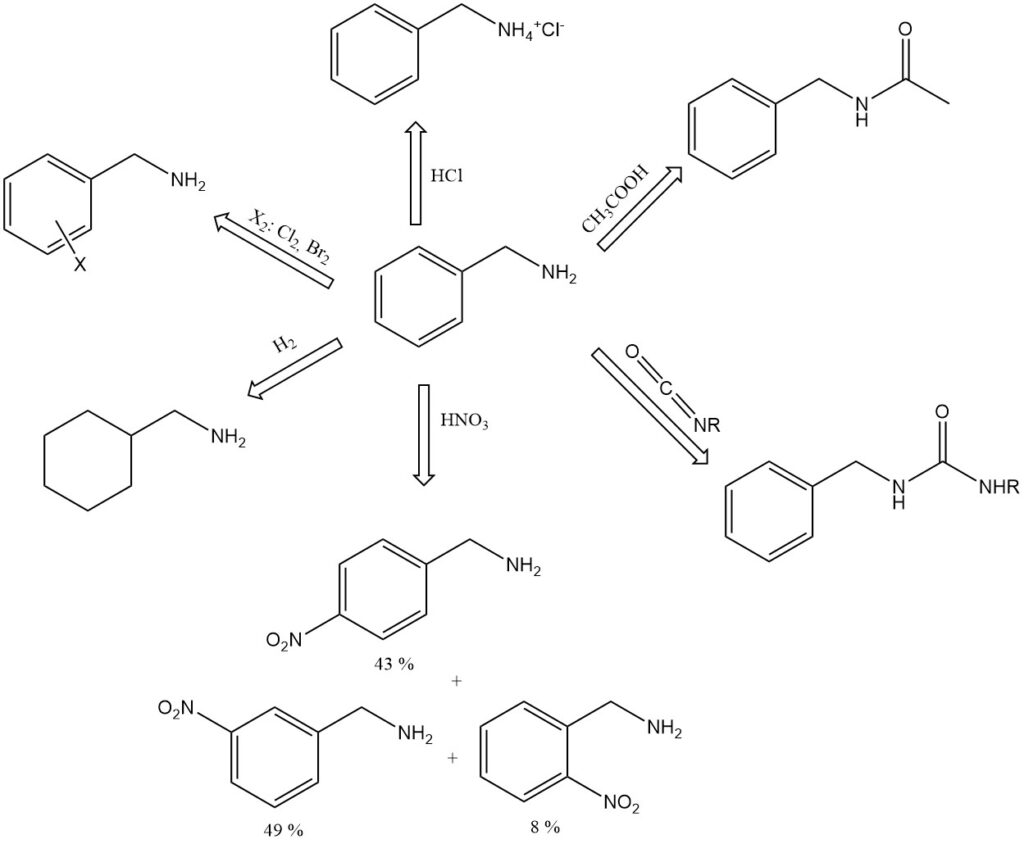
Benzylamin ist eine stärkere Base als seine Toluidin-Isomere und ist selbst bei Verdünnung mit etwas Wasser stark alkalisch (pH 11,6 in 100 g/L Wasser).
Es bildet Additionsverbindungen mit Phenol (1:3, Fp. 15,3 °C), p-Kresol (1:1, Fp. −6 °C) und Ameisensäure (1:1, Fp. 81 °C). Beispiele für Benzylaminsalze sind das Hydrochlorid, C6H5CH2NH+3 Cl−, Fp. 260 °C (Zersetzung), und das Pikrat, Fp. 194 °C.
Benzylamin absorbiert Kohlendioxid aus der Luft und bildet ein festes Carbaminsäuresalz.
Beim Kochen mit Eisessig bildet Benzylamin N-Acetylbenzylamin.
Benzylamin reagiert mit Isocyanaten zu substituierten Harnstoffen, C6H5CH2NHCONHR.
Salpetersäure nitriert Benzylamin am aromatischen Kern und ergibt 8 % ortho-, 49 % meta- und 43 % para-Nitrobenzylamin.
Die katalytische Hydrierung von Benzylamin ergibt Hexahydrobenzylamin, C6H11CH2NH2.
Benzylamin kann am Benzolring aromatische Reaktionen wie Alkylierung, Acylierung, Sulfonierung und Halogenierung eingehen.
3. Herstellung von Benzylamin
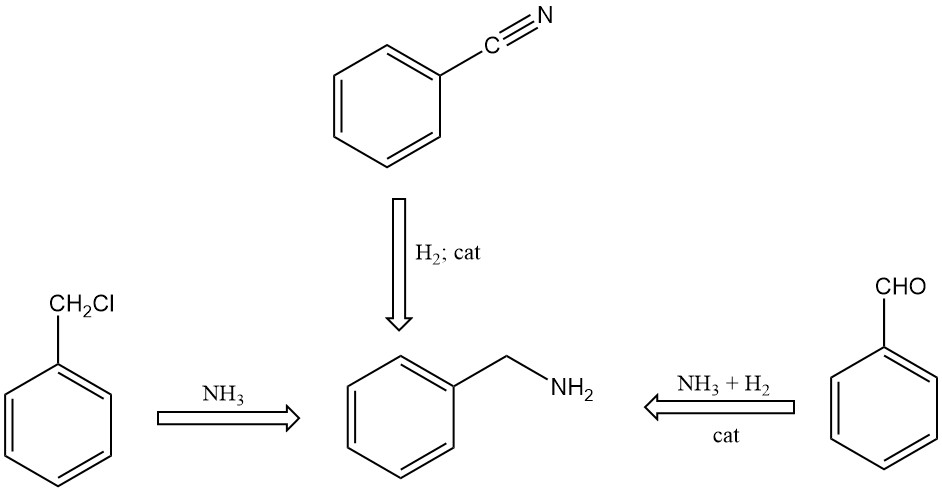
Es gibt verschiedene Methoden zur Synthese von Benzylamin:
- Reaktion von Benzylchlorid mit Ammoniak in einer wässrigen Lösung
- Katalytische Hydrierung von Benzonitril
- Reaktion von Benzaldehyd mit Ammoniak in Gegenwart von Wasserstoff und Katalysatoren unter Verwendung organischer Lösungsmittel im Reaktionsgemisch
Benzylamin wird auf dem Benzaldehyd-Weg wie folgt hergestellt:
- Kombinieren Sie 8 kg Raney-Nickel (entspricht etwa 4 kg 100 % Ni), 10 g Eisessig, 110 kg Ammoniak und eine Mischung aus 250 kg Methanol und 500 kg Benzaldehyd in einem 1200-l-Stahlautoklaven .
- Hydrieren Sie die Mischung 3 bis 5 Stunden lang bei 100 °C und 15 MPa und füllen Sie den Wasserstoff etwa alle 10 Minuten auf. Nachdem der Wasserstoffverbrauch aufgehört hat, halten Sie das Reaktionsgefäß weitere 30 Minuten lang auf der gleichen Temperatur und dem gleichen Druck.
- Trennen Sie den Katalysator mithilfe eines Druckfilters von den Reaktionsprodukten. Das Filtrat enthält etwa 470 kg Benzylamin, was einer Ausbeute von 93 % entspricht, zusammen mit Spurenmengen an Benzylalkohol, Dibenzylamin, Schiff-Base (N-Benzalbenzylamin), Methanol, Reaktionswasser und Ammoniak, was einer Ausbeute von 93 % entspricht.
- Um Benzylamin in der erforderlichen technischen Reinheit zu erhalten, wird Vakuumdestillation eingesetzt.
Benzylamin wurde auch in den Blättern und Blüten der Pflanze Reseda media nachgewiesen.
4. Verwendung von Benzylamin
Benzylamin wird bei der Herstellung synthetischer Textilien, Farben und Korrosionsinhibitoren verwendet. Es wird auch als Zwischenprodukt bei der Herstellung von Arzneimitteln und Pestiziden verwendet. In diesen Fällen wird Benzylamin häufig als geschützter Stickstoff verwendet.
Benzylamin ist ein vielseitiges Zwischenprodukt und Baustein in einer Vielzahl von Anwendungen, einschließlich Beschichtungen und Pflanzenschutz.
Es wird bei der industriellen Herstellung zahlreicher Arzneimittel verwendet, darunter Alniditan, Lacosamid, Moxifloxacin und Nebivolol.
Benzylamin wird auch zur Herstellung des militärischen Sprengstoffs Hexanitrohexaazaisowurtzitan (HNIW) verwendet.
5. Toxikologie von Benzylamin
Benzylamin ist biologisch leicht abbaubar, jedoch schädlich für Wasserlebewesen mit schwacher Wirkung (Gewässergefährdungsklasse 1, WGK 1).
Die akute Toxizität von Benzylamin variiert je nach Organismus:
- Pseudomonas fluorescens (Bakterien): EC0 500 mg
- Scenedesmus quadricauda (Alge): 96-h EC10 6 mg
- Daphnia magna: 48-h EC50 60 mg
- Leuciscus idus (Fisch): 48-h EC0 20 mg
- Pimephals promelas (Fisch): 96-h EC50 102 mg
Benzylamin kann Haut- und Augenverbrennungen verursachen und zu einer Sensibilisierung führen. Bei Kontakt mit Benzylamin sofort mit Wasser abspülen und die Haut mit Seife waschen. Zur Neutralisierung kontaminierter Haut sollte eine 5 %ige wässrige Essigsäurelösung zur Verfügung stehen. Bei Verschlucken mit Trinkwasser verdünnen und den Mund ausspülen. Bei Inhalationsgefahr ABEK-Filter in Atemmasken verwenden (DIN 3181).
Benzylamin zeigte im Ames-Test ein negatives Ergebnis, was darauf hindeutet, dass keine mutagene Wirkung vorliegt. Die akuten oralen und perkutanen LD50-Werte für Ratten betragen 1130 mg/kg bzw. 1340 mg/kg. In der Schweiz ist es in die Giftigkeitsklasse 3 eingestuft.
Ratten überlebten einen Zeitraum von zwei Wochen nach 3-stündiger Inhalation des gesamten Körpers gegenüber Benzylamin, aber 17 % der Ratten starben nach 5-stündiger Exposition.
Verweise
- Benzylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_009.pub2
- https://products.basf.com/global/en/ci/benzylamine.html