Chloramine sind stickstoffhaltige Verbindungen, entweder anorganisch oder organisch, bei denen ein oder mehrere Chloratome direkt an ein Stickstoffatom gebunden sind. Ein bekanntes Beispiel ist Monochloramin (NH2Cl), das im frühen 19. Jahrhundert entdeckt wurde.
Chloramine sind chlorierende und oxidierende Substanzen, die in synthetischen Reaktionen sowie als Bleichmittel, Desinfektionsmittel und Bakterizide verwendet werden. Im Vergleich zu Chlorgas oder metallischen Hypochloriten bieten sie eine sicherere Handhabung und höhere Stabilität.
Aus diesem Grund werden sie in der Trinkwasseraufbereitung und Schwimmbadhygiene eingesetzt. N-Chlorisocyanursäuren und 1-Brom-3-chlor-5,5-dimethylhydantoin gewinnen auf den Desinfektions- und Desinfektionsmärkten zunehmend an Bedeutung als Calciumhypochlorit, 1,3-Dichlor-5,5-dimethylhydantoin und Chloramin-T.
Inhaltsverzeichnis
1. Chemische Eigenschaften von N-Chloraminen
N-Chloramine besitzen Oxidationsfähigkeiten und nehmen zwei Elektronen auf, um sie in Chloridionen umzuwandeln. Diese Eigenschaft ermöglicht es ihnen, Jodwasserstoffsäure zu oxidieren und Jod in einer Reaktion freizusetzen, die für die quantitative Analyse verwendet wird:
2 HI + RR’NCl → HCl + RR’NH + I2
Der theoretische Chlorgehalt in einem N-Chloramin wird als doppelter Chlormassenanteil berechnet. In praktischen Anwendungen wird es jedoch aufgrund seiner tatsächlichen Oxidationsfähigkeit als Äquivalent zu elementarem Chlor ausgedrückt.
N-Chloramine werden in Wasser hydrolysiert, wobei unterchlorige Säure (HOCl) freigesetzt wird. Die quantitative Hydrolysekonstante (K-Wert), die zwischen 10-4 und 10-10 liegt (Tabelle 1), spiegelt diese Reaktion wider:
RR’NCl + H2O ⇌ RR’NH + HOCl
K = [RR’NH][HOCl] / [RR’NCl]
| N-Chloramin | K-Wert |
|---|---|
| Trichlorisocyanursäure | 6,7 × 10-4 |
| 1,3-Dichlor-5,5-dimethylhydantoin | 2,5 × 10-4 |
| N-Chlorsuccinimid | 6,6 × 10-5 |
| Dichloramin-T | 8,0 × 10-7 |
| Chloramin-T | 4,9 × 10-8 |
| Monochloramin | 2,8 × 10-10 |
Dieser K-Wert bezieht sich auf die bakterizide Wirkung von N-Chloraminen, da ihre Wirksamkeit von der Bildung von unterchloriger Säure im Wasser abhängt.
N-Cl-Bindungen in N-Chloraminen sind kovalent und hydrolysieren leicht, wobei hypochlorige Säure freigesetzt wird. Sie weisen eine thermische Instabilität auf, schmelzen häufig nicht gleichmäßig und können bei hohen Temperaturen explodieren. Trichloramin (NCl3) ist eine besonders instabile Verbindung und kann bereits als Verunreinigung Explosionen verursachen.
Die ordnungsgemäße Lagerung von N-Chloraminen erfordert kühle Temperaturen und Schutz vor Licht, Wasser, Aminen und Ammoniumverbindungen, starken Säuren und Basen sowie leicht oxidierbarem organischem Material.
2. Reaktionen von Chloraminen
Viele N-Chloramine spielen eine wertvolle Rolle als Reagenzien oder Zwischenprodukte in verschiedenen organischen Reaktionen.
Hofmann-Abbau: Von organischen Carbonsäuren abgeleitete N-Chloramide werden mit Alkali reduziert, um mit hoher Effizienz die entsprechenden Amine zu ergeben. Diese als Hofmann-Abbau bekannte Reaktion wird für die Synthese von aromatischen Aminen, heterozyklischen Aminen und alizyklischen Aminen verwendet .
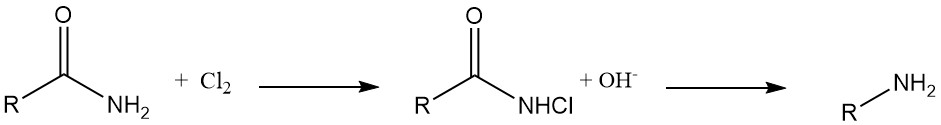
Hydrazin-Synthese: N-Chlorharnstoffe wandeln sich bei Behandlung mit einer Base in Alkohol- oder Wasserlösungen in Hydrazine um.
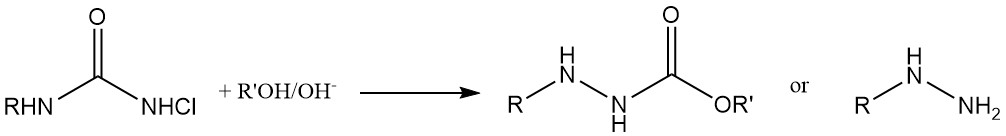
Chlorierungsmittel und Dien-Addition: N,N-Dichlorcarbamate (Cl2NCOOR) werden als Chlorierungsmittel verwendet Wirkstoffe und gehen auch Additionsreaktionen mit Dienen ein. Sie dienen außerdem als Ausgangsmaterialien für die Synthese von N-Halogen-N-Metallcarbamidaten, wichtigen Zwischenprodukten bei der Herstellung von Carbamatderivaten physiologisch aktiver Verbindungen.
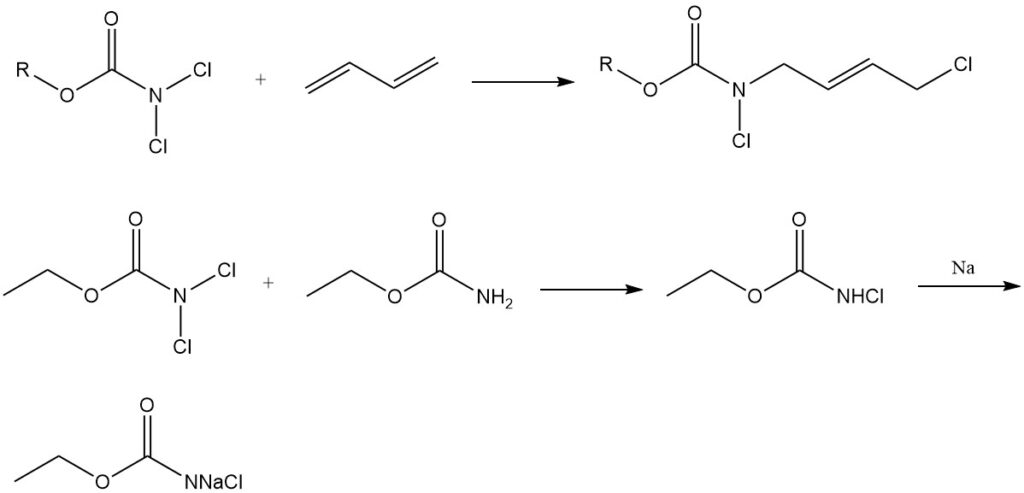
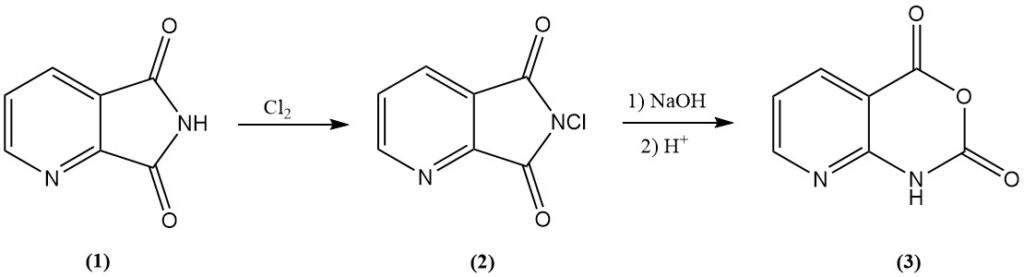
8-Azaisatosäureanhydrid (3), ein Zwischenprodukt in verschiedenen Agrarchemikalien, wird effizient durch Chlorierung von 2,3-Pyridindicarboximid (1) zu N-Chlor-2,3-pyridindicarboximid (2) und anschließende alkalische Behandlung gewonnen.
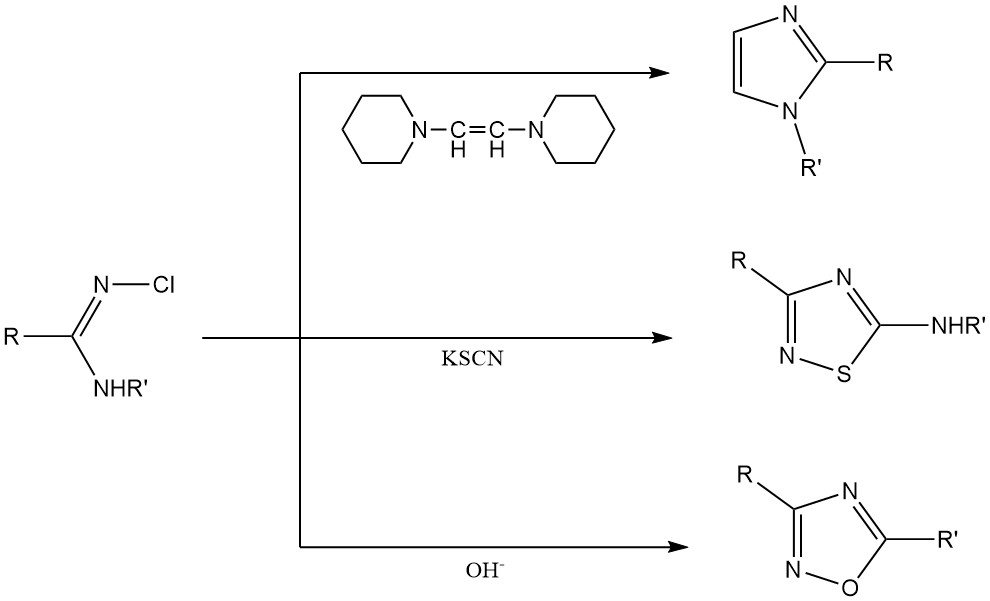
Heterocyclische Ringsynthese: N-Chloramidine und N-Chlorguanidine werden als Rohstoffe für die Herstellung heterocyclischer Ringsysteme wie Imidazole, Thiazole und Oxadiazole verwendet.
3. Anorganische N-Chloramine
Monochloramin (NH2Cl) ist eine farblose, stark riechende Flüssigkeit, die in wässrigen Lösungen stabiler ist als andere N-Chloramine wie Dichloramin (NHCl2) und Trichloramin (NCl3). Seine Hauptanwendung liegt in der Trinkwasserdesinfektion. Es wird auch als Oxidationsmittel in der organischen Synthese verwendet, insbesondere für trisubstituierte Phosphine.
N-Chloramine werden durch kontrollierte pH-Reaktionen zwischen Ammoniumsalzen und hypochloriger Säure oder Chlor synthetisiert.
Beim Umgang mit reinen N-Chloraminen ist aufgrund ihrer inhärenten Instabilität und Explosivität, selbst bei Raumtemperatur, äußerste Vorsicht geboten.
N-Chlorsulfaminsäure (ClSO2NH2), N,N-Dichlorsulfaminsäure und Natrium-N-chlorimidodisulfonat (ClSO2NNaSO2) werden als Desinfektionsmittel und Bleichmittel für Papier oder Stoffe verwendet. Sie werden aus Sulfaminsäure und hypochloriger Säure hergestellt.
4. N-Chlorisocyanursäuren
N-Chlorisocyanursäuren (Chlorisocyanurate), wie Trichlorisocyanursäure (Symclosene oder TCC) und Natriumdichlorisocyanurat (DCC-Na), verzeichnen einen bemerkenswerten Anstieg ihrer Verwendung als Desinfektionsmittel. Diese zunehmende Beliebtheit ist auf ihre überlegene Stabilität und Benutzerfreundlichkeit im Vergleich zu herkömmlichen Metallhypochloriten zurückzuführen.
Tabelle 2 listet einige wichtige physikalische Eigenschaften von TCC und DCC-Na auf.
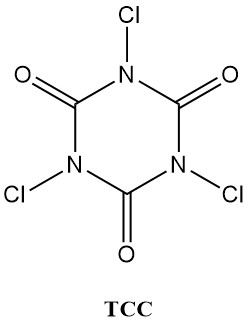
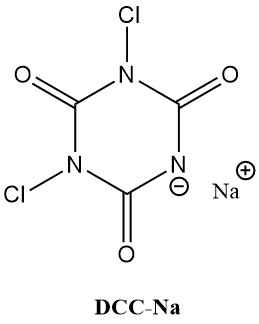
| Eigenschaft | TCC | DCC-Na |
|---|---|---|
| CAS-Nummer | [87-90-1] | [2893-78-9] |
| Physische Form | Weißes Pulver | Weißes Pulver |
| Formel | (ClNCO)3 | Cl2Na(NCO)3 |
| Herr | 232,44 | 219,98 |
| Schmelzpunkt | 234 °C (Zersetzung) | 225 °C (Zersetzung) |
| Theoretisch verfügbares Chlor (%) | 91,5 | 64,5 |
| Verfügbares Chlor Typischer Wert | 90,0 | 62,0 |
| pH-Wert (1 %ige wässrige Lösung) | 2,7 – 3,3 | 6,2 – 6,8 |
| Löslichkeit in Wasser (25 °C) (g/100 g) | 1.0 | 30,0 |
| Löslichkeit in Aceton (30 °C) | 35,0 | 0,5 |
TCC und DCC-Na haben einen bedeutenden Marktanteil erobert, der in der Vergangenheit von Calciumhypochlorit, Kiefernölen, quartären Ammoniumsalzen und Phenolen dominiert wurde.
N-Chlorisocyanursäuren werden durch eine kontinuierliche Chlorierungsreaktion von Isocyanursäure in wässrigem Natriumhydroxid bei niedrigen Temperaturen (0–15 °C) hergestellt. Eine genaue Kontrolle des pH-Werts und der Reaktionstemperatur ist wichtig, um die Bildung des hochexplosiven Trichloramins (NCl3) zu verhindern.
Trichlorisocyanursäure (TCC) zersetzt sich allmählich in einem alkalischen Medium und erzeugt Nebenprodukte wie Trichloramin (NCl3) und Dichloramin (NHCl2) und Monochloramin (NH2Cl).
Sowohl Natriumdichlorisocyanurat (DCC-Na) als auch sein Dihydrat weisen im Vergleich zu TCC eine höhere Wasserlöslichkeit auf. DCC-Na-Dihydrat wird durch Abkühlen einer gesättigten wässrigen Lösung von DCC-Na (45 °C) auf 10 °C erhalten; Diese Form bietet im Vergleich zur wasserfreien Form eine erhöhte thermische Stabilität.
Die desinfizierende und sanitäre Wirkung von N-Chlorisocyanursäuren beruht auf ihrer allmählichen Freisetzung von hypochloriger Säure (HOCl) in Wasser, die sowohl oxidierende als auch biozide Eigenschaften aufweist.
Diese Verbindungen werden für viele Zwecke verwendet, darunter:
- Nicht schrumpfende Behandlung von Wolle: Sie schützen Wollfasern vor dem Schrumpfen während der Verarbeitung.
- Schwimmbaddesinfektion: N-Chlorisocyanursäuren beseitigen wirksam schädliche Mikroorganismen in Schwimmbädern und sorgen so für die Wasserhygiene.
- Reinigung und Desinfektion von Badezimmern.
- Wäschebleiche: Sie werden als wirksame Wäschebleiche verwendet, um Flecken zu entfernen und den Weißgrad zu verbessern.
Reiniger und Desinfektionsmittel auf N-Chlorisocyanursäurebasis enthalten häufig zusätzliche Komponenten wie Phosphate, Natriummetasilikate, Tenside und neutrale Salze (Natriumsulfat, Natriumcarbonat).
Diese Kombination verbessert ihre Fähigkeit zur Öl- und Proteinentfernung und macht sie ideal für verschiedene Reinigungsaufgaben. Aufgrund ihrer Wirksamkeit gegen verschiedene Mikroorganismen werden sie zum Geschirrspülen in Hotels, Krankenhäusern, Restaurants und Lebensmittelverarbeitungsbetrieben empfohlen.
5. Organische N-Chloramine
Verschiedene organische N-Chloramin-Verbindungen und ihre Anwendungen sind unten aufgeführt:
1,3-Dichlor-5,5-dimethylhydantoin (Dactin) (4)
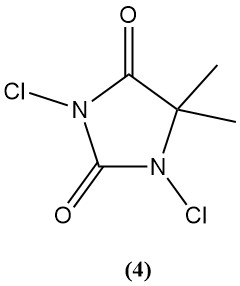
- Molekulargewicht: 197,03 g/mol
- Schmelzpunkt: 132°C
- Theoretischer Chlorgehalt: 77,6 %
- Löslichkeit in Wasser: 2,1 g/L
- Es wird durch Chlorierung von wässrigem 5,5-Dimethylhydantoin hergestellt.
- Es wurde früher als Bakterizid und Desinfektionsmittel verwendet, seine Verwendung ging jedoch aufgrund der Konkurrenz durch TCC und Di-Halo zurück.
1-Brom-3-chlor-5,5-dimethylhydantoin (Di-Halo) (5)
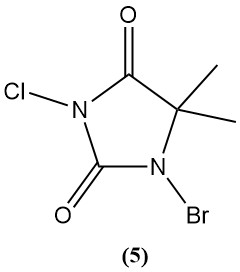
- Molekulargewicht: 241,48 g/mol
- Schmelzpunkt: 130 °C (Zersetzung)
- pH-Wert: 2,88 (0,1 % Lösung)
- Wasserlöslichkeit (20°C): 2 g/L
- Es wird durch sequentielle Bromierung und Chlorierung von 5,5-Dimethylhydantoin hergestellt.
- Es ist ein stabiles weißes Pulver ohne Chloraminbildung in schwach basischen Lösungen.
- Aufgrund seiner Stabilität, seines breiten Aktivitätsspektrums und seiner langen Haltbarkeit wird es häufig als Desinfektionsmittel für Schwimmbäder (0,5–3 mg/l aktives Halogen) verwendet.
1-Chlor-2,5-pyrrolidindion (N-chlorsuccinimid) (6)
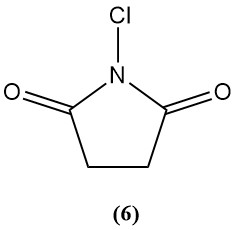
- Molekulargewicht: 133,54 g/mol
- Schmelzpunkt: 150–151 °C
- Es ist in verschiedenen organischen Lösungsmitteln schwer löslich.
- Verfügbares Chlor: 50–54 %
- Es wird hauptsächlich als Chlorierungsmittel für die organische Synthese verwendet.
N-Chloroglykolurile
- Sie werden als Schutzmittel gegen Giftgas untersucht.
- Sie werden durch 1,2-Diketon-Kondensation mit Harnstoff und anschließende Chlorierung hergestellt.
- 2,4,6,8-tetrachlor-2,4,6,8-tetrazabi-cyclo[3.3.0]octan-3,7 -dione (7) ist ein wichtiges Beispiel dieser Klasse.
![2,4,6,8-tetrachloro-2,4,6,8-tetrazabi-cyclo[3.3.0]octane-3,7-dione structure](https://chemcess.com/wp-content/uploads/2024/02/2468-tetrachloro-2468-tetrazabi-cyclo3.3.0octane-37-dione-structure.jpg)
1,3,4,6-Tetrachlor-3α,6α-diphenylglycoluril (Iodogen) (8)
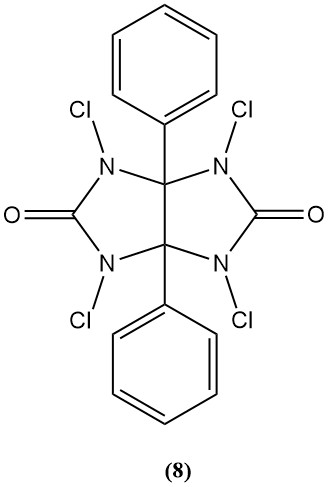
- Molekulargewicht: 431,94 g/mol
- Es wird als Bakterizid und Oxidationsmittel bei der Peptidsynthese verwendet.
3-Chlor-4,4-dimethyl-2-oxazolidinon (9)
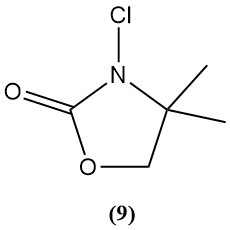
- Molekulargewicht: 149,50 g/mol
- Es ist ein Beispiel für eine neue Klasse von N-Chloraminen, die als Desinfektionsmittel untersucht werden.
Natrium-N-chlor-p-toluolsulfonamid (Chloramin-T) (10)
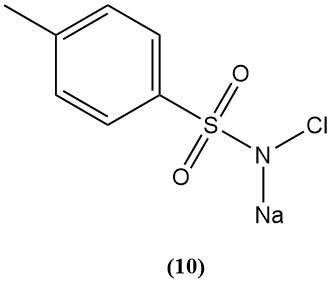
- Molekulargewicht: 227,67 g/mol (Hydrat)
- Schmelzpunkt: 175 °C; explosiv
- Verfügbares Chlor: 25 %
- Es wird durch Chlorierung von p-Toluolsulfonamid in Natriumhydroxid hergestellt.
- Es ist ein starker Elektrolyt in Säuren, ein gutes Oxidationsmittel in Basen und ziemlich löslich in Wasser und unlöslich in benzol.
- Es reagiert mit Senfgas unter Bildung harmloser Sulfimidkristalle.
- Ihre Derivate werden zum Schutz vor Giftgasen untersucht.
N,N‘,N“-Trichlormelamin (11)
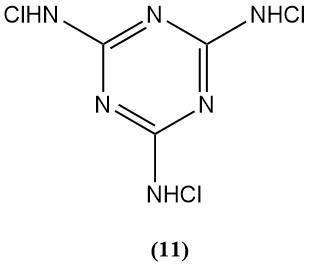
- Molekulargewicht: 229,46 g/mol
- Schmelzpunkt: 175°C (Zersetzung)
- Theoretischer Chlorgehalt: 92,8 %
- Es wird als Sterilisationsmittel verwendet, begrenzt durch seine geringe Wasserlöslichkeit.
N-chlorierte Aminosäurederivate werden derzeit auf ihr Potenzial als Bleichmittel und Bakterizide untersucht.
6. Toxikologie von N-Chloraminen
N-Chloramine werden häufig in Trinkwasser, Schwimmbädern und der Lebensmittelverarbeitung eingesetzt, was eine sorgfältige Abwägung ihrer möglichen toxikologischen Auswirkungen erfordert.
Bei der Verwendung in Wasser mit hohem Gehalt an organischen Stoffen ist besondere Vorsicht geboten, um die Bildung schwach krebserregender Halomethanverbindungen zu verhindern. Ihre Anwesenheit wird oft durch Headspace-, Purge-Trap- oder Lösungsmittelextraktionsmethoden quantifiziert, gefolgt von einer GC-Analyse mit Elektroneneinfangdetektoren oder GC-MS.
Die meisten N-Chloramine wirken lokal reizend auf die Augen, die feuchte Haut und die oberen Atemwege. Verdünnte Lösungen (bis zu 100 ppm verfügbares Chlor) von N-Chlorisocyanursäuren stellen in der Regel keine Bedenken hinsichtlich Toxizität, Reizung oder Sensibilisierung dar.
Allerdings kann die Einnahme reiner Feststoffe oder konzentrierter Suspensionen die Magenschleimhaut schädigen. Darüber hinaus besitzt Isocyanursäure, die bei der Hydrolyse entsteht, eine geringe inhärente Toxizität. Eine Zusammenfassung der akuten Toxizitätswerte für ausgewählte N-Chloramine finden Sie in Tabelle 3.
| Verbindung | LD50 (mg/kg, Ratte, oral) |
|---|---|
| TCC | 1300 |
| DCC-Na | 1420 |
| 1,3-Dichlor-5,5-dimethylhydantoin | 542 |
| N-Chlorsuccinimid | 2700 |
- Chloramin-T: Diese Verbindung ist zwar hautreizend, weist jedoch bei Aufnahme in den Blutkreislauf eine erhebliche Toxizität auf, sodass ihre Verwendung nur in verdünnten Lösungen erforderlich ist.
- Monochloramin: Obwohl das Risiko der Bildung von Halomethan geringer ist, gibt seine weitverbreitete Verwendung bei der Trinkwasserdesinfektion Anlass zur Sorge aufgrund potenzieller mutagener und aquatischer Toxizität. Die US-Umweltschutzbehörde hat sogar ein Verbot seiner Verwendung im Trinkwasser vorgeschlagen.
Studien deuten darauf hin, dass 1-Brom-3-chlor-5,5-dimethylhydantoin im Vergleich zu 1,3-Dichlor-5,5-dimethylhydantoin eine geringere Toxizität gegenüber bestimmten Fischarten aufweist.
Referenz
- Chloroamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_553