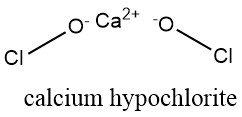
Festes Hypochlorit ist ein weißes, weiches und trockenes Pulver. Es ist praktisch geruchlos, kann aber aufgrund der Zersetzung bei der Lagerung mehr oder weniger stark nach Chlor oder Salzsäure riechen.
Die Stabilität von Hypochlorit hängt hauptsächlich von seinem Wassergehalt ab, der normalerweise weniger als 1 % beträgt.
Tropenbleiche enthält sogar weniger als 0,3 %. Sie bleiben bis zu 80 °C stabil, während tropische Bleichmittel sogar bis zu 100 °C stabil bleiben. Beim Erhitzen auf 180 °C zerfallen sie in Chlorid und Sauerstoff.
Die Stabilität von Hypochloriten wird durch Metalle wie Eisen, Nickel oder Kobalt verringert. Daher müssen die für die Hypochloritproduktion verwendeten Rohstoffe frei von diesen Metallen sein.
Richtig gelagertes, schwermetallfreies tropisches Bleichmittel (< 0,3 % Wasser) ist über zwei Jahre haltbar.
Inhaltsverzeichnis
1. Herstellung von Calciumhypochlorit
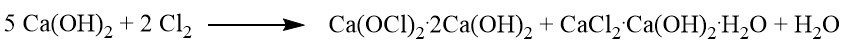
1.1 Standard-Bleichpulver
Das Standardbleichpulver ist eine Mischung aus Calciumhypochlorit (Ca(OCl)2), Calciumchlorid, Calciumhydroxid und unterschiedlichen Mengen Wasser. Der Produktionsprozess beinhaltet die Durchleitung von Chlorgas über gelöschten Kalk.
Der Herstellungsprozess des Bleichpulvers von Dynamit Nobel in Rheinfelden erfolgt als Batch-Prozess. Trockenes, pulverförmiges Kalkhydrat wird in einer horizontalen Reaktionstrommel bei 45 °C und niedrigem Druck (5,3 kPa) chloriert, wobei Chlor in flüssiger Form eingedüst wird. Mit einem langsam rotierenden Rechen wird das Reaktionsgemisch permanent durchmischt.
Durch die Reaktion zwischen dem festen Kalkhydrat und Chlor entsteht eine Mischung aus dibasischem Calciumhypochlorit (Ca(OCl)2·2Ca(OH)2) und basischem Calciumchlorid, was 40 % des verfügbaren Calciumhydroxids entspricht.
Eine weitere Chlorierung führt zur Bildung von halbbasischem Calciumhypochlorit (Ca(OCl)2·1/2 Ca(OH)2) und neutralem Calciumchloridhydrat. Die Bleichpulverreaktion stoppt, nachdem etwa 60 % des verfügbaren Calciumhydroxids umgewandelt sind.
Durch die exotherme Reaktion entstehen pro kg umgewandeltes Chlor 1100 kJ Wärme, die zusammen mit dem niedrigen Druck zur Verdampfung von Wasser und flüssigem Chlor führt.
Anschließend wird die Reaktionsmischung vollständig unter Vakuum bei einer maximalen Temperatur von 85 °C getrocknet, wodurch ein Standard-Bleichpulver mit einem Gehalt an verfügbarem Chlor von 35–37 % entsteht.
Alternativ kann gasförmiges Chlor für die Reaktion verwendet werden, allerdings ist die Reaktionsgeschwindigkeit langsamer, die Chlorverluste höher und der verfügbare Chlorgehalt des Produkts geringer.
1.2 Tropisches Bleichmittel
Fein gemahlener Branntkalk (CaO) wird dem üblichen Bleichpulver zugesetzt, um den Wassergehalt weiter zu reduzieren. Der Branntkalk nimmt vorhandenes Restwasser auf und wird in Calciumhydroxid umgewandelt.
Obwohl dieser Vorgang den verfügbaren Chlorgehalt um 1–2 % verringert, ergibt die zusätzliche Trocknung ein tropisches Bleichmittel, das bis zu Temperaturen von 100 °C stabil ist.
ICI hat ein kontinuierliches Verfahren zur Herstellung von Bleichpulver entwickelt, bei dem Calciumhydroxid und Chlor im Gegenstrom in einer rotierenden Trommel reagieren.
Die bei der Reaktion entstehende Wärme wird durch Besprühen der Trommel von außen mit Wasser abgeführt und das Chlor mit gekühlter Luft verdünnt. Dieser Gasstrom entfernt auch das bei der chemischen Reaktion entstehende Wasser.
1.3 Hochprozentiges Hypochlorit
Durch Chlorieren von Aufschlämmungen aus Calciumverbindungen wie Calciumhydroxid oder Bleichpulver erhält man feste Hypochlorite mit einem verfügbaren Chlorgehalt von 70 % oder mehr. Das zunächst gebildete Produkt ist halbbasisches Calciumhypochlorit (Ca(OCl)2·1/2 Ca(OH)2), das bei weiterer Chlorierung neutrales Calciumhypochlorit-Dihydrat (Ca(OCl)2·2 H2O) ergibt.
Anschließend wird das neutrale Calciumhypochlorit-Dihydrat zum gewünschten hochprozentigen Hypochlorit getrocknet.
Bei all diesen Reaktionen entsteht als Nebenprodukt Calciumchlorid. Bei einigen Verfahren wird der Calciumgehalt durch Zugabe von Natriumhypochlorit zu den Aufschlämmungen wiederhergestellt. Das Ergebnis ist ein Produkt, das hauptsächlich aus Calciumhypochlorit, Natriumchlorid und Wasser besteht und dann entfernt wird.
2. Verwendung von Bleichpulver
Bei der Papierherstellung findet Calciumhypochlorit im einstufigen Bleichprozess Anwendung.
Beim mehrstufigen Verfahren, das Chlorierung, Laugenextraktion und Hypochloritoxidation umfasst, wird hingegen das teurere Natriumhypochlorit eingesetzt.
Wenn Natriumhypochlorit anstelle von Calciumhypochlorit zum Bleichen von Kraftzellstoff verwendet wird, werden ein höherer Weißgrad und eine größere Festigkeit erreicht.
In der Wäscherei wird Bleichpulver zunächst in Wasser suspendiert und anschließend dekantiert. Es wird nur die Lösung verwendet, da die unlöslichen Stoffe die Fasern beschädigen können.
Referenz
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2


