
Le 2-chloroéthanol, également connu sous le nom d’éthylène chlorhydrine, est un composé chimique organique de formule HOCH2CH2Cl. Il s’agit d’un liquide incolore à l’odeur agréable qui était un intermédiaire important utilisé dans le passé pour produire de l’oxyde d’éthylène, mais ce n’est plus le cas.
Table des matières
1. Propriétés physiques du 2-chloroéthanol
Les solutions diluées de 2-chloroéthanol dans l’eau ont une odeur légèrement sucrée et agréable. C’est un liquide inflammable qui peut former un azéotrope avec de l’eau qui bout à 97,8 avec 42 % de H2O en poids. La chlorhydrine d’éthylène est miscible avec l’eau, l’éthanol, l’acétone et le benzène.
Les propriétés physiques générales du 2-chloroéthanol sont répertoriées dans le Tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro de registre CAS | [107-07-3] |
| Poids moléculaire | 80,52 g/mol |
| Point de fusion (mp) | -69 °C |
| Point d'ébullition (pb) | 129 °C |
| Densité à 20 °C | 1,2133 g/mL |
| Indice de réfraction | 1.44 |
| Viscosité (η) | 3,43 mPa.s |
| Pression de vapeur | 700 Pa (à 20 °C) |
| Point éclair | 57 °C |
| Température d'auto-inflammation | 425 °C |
| Limite explosive | 5 à 16 % |
2. Réactions chimiques du 2-chloroéthanol
Le 2-chloroéthanol subit des réactions caractéristiques à la fois des alcools et des chlorures d’alkyle. La réaction la plus courante du 2-chloroéthanol est la déshydrochloration pour former de l’oxyde d’éthylène, qui a été utilisé industriellement mais est devenu moins important en raison de méthodes alternatives.
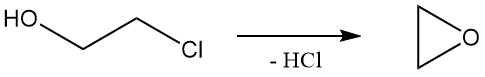
Le taux relatif de solvolyse de la chlorhydrine d’éthylène dans l’eau à 97 °C est de 1,0.
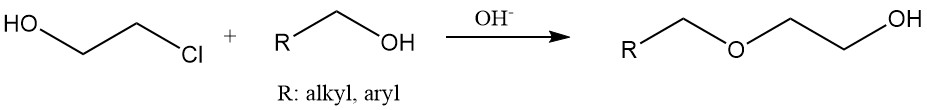
Les éthers hydroxyéthyliques sont produits en faisant réagir du 2-chloroéthanol avec des alcools ou des phénols dans des conditions basiques. L’hydroxyéthylcellulose et l’amidon modifié sont fabriqués en traitant ces matériaux avec de la chlorhydrine d’éthylène.
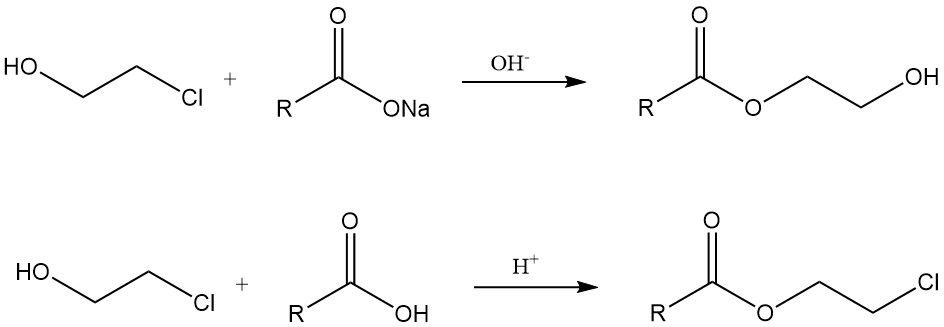
Les chlorohydrines réagissent avec les carboxylates métalliques en présence d’une base pour donner des esters d’hydroxyéthyle. D’autre part, les β-chloroesters sont formés par des réactions avec des acides carboxyliques dans des conditions acides ou à partir de chlorures d’acide.
Le carbonate cyclique peut être produit par la réaction du 2-chloroéthanol avec du dioxyde de carbone en présence d’une amine.
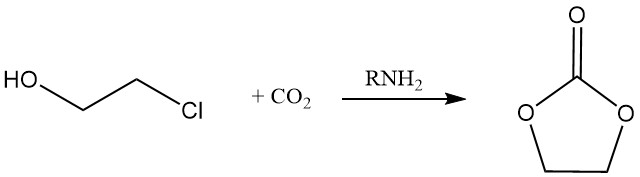
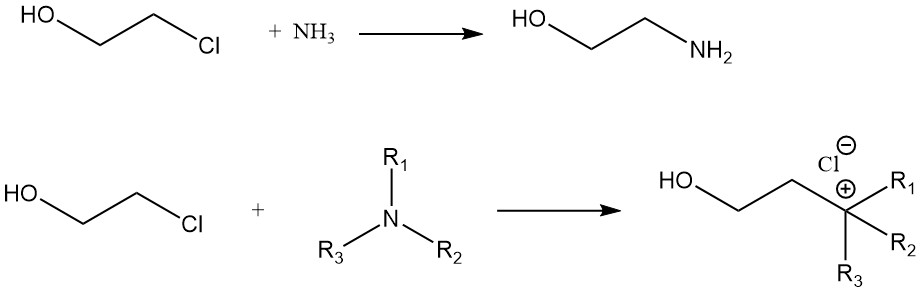
Une comparaison de la vitesse de réaction de l’éthylène chlorhydrine avec diverses amines donne l’ordre suivant : n-amylamine > cyclohexylamine > aniline. La réaction de l’éthylène chlorhydrine avec l’ammoniac donne de la monoéthanolamine. Les composés d’ammonium quaternaire sont formés à partir d’éthylène chlorhydrine et d’amines tertiaires.
D’autres réactions du 2-chloroéthanol comprennent la formation de nitriles à partir de cyanures, d’acétals à partir d’aldéhydes, d’oxazolidinones à partir de cyanates et l’oxydation de la chlorhydrine d’éthylène en acide monochloroacétique.
La réaction du 2-chloroéthanol avec le phosgène forme du chloroformiate de 2-chloroéthyle.
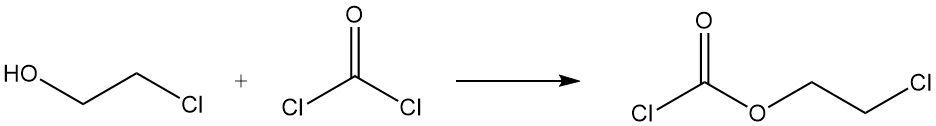
3. Production de 2-chloroéthanol
Dès 1904, BASF produisait du 2-chloroéthanol en faisant réagir de l’éthylène et du CO2 dans une solution aqueuse de poudre décolorante.
Aujourd’hui, le 2-chloroéthanol est produit par hypochloration de l’éthylène avec de l’acide hypochloreux, formé par la réaction réversible du chlore et de l’eau, ce qui entraîne une efficacité limitée.
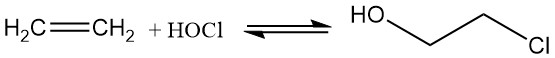
Cl2 + H2O ⇌ HOCl + HCl ; K = 4.2 x 10-4
La réaction entre l’éthylène et l’acide hypochloreux est plus rapide que la réaction de l’éthylène et du chlore pour former du dichloroéthane, de sorte que lorsque l’éthylène est ajouté au système aqueux, la chlorhydrine est produite préférentiellement.
Une quantité minimale de dichloroéthane se forme sous bonne agitation dans la phase gazeuse si la concentration en 2-chloroéthanol ne dépasse pas 6 à 8 %. Cependant, l’augmentation de la concentration de HCl réduit le HOCl disponible, conduisant à une formation significative de dichloroéthane une fois que le HCl est supérieur à 3 %.
En raison de la faible solubilité du dichloroéthane dans l’eau (0,869 g/100 ml à 20 °C), il forme une phase séparée, dissolvant à la fois le chlore et l’éthylène pour une formation ultérieure de dichloroéthane.
Etudes en laboratoire et optimisation des réacteurs
Une étude en laboratoire a étudié les paramètres d’hypochloration à l’aide d’installations à colonne unique et de réacteur de recyclage. Les résultats montrent que des températures de 35 à 50 °C et un excès d’éthylène de 50 % ont été préférés pour un stripping efficace au dichloroéthane.
Un rendement de 88 % en 2-chloroéthanol a été obtenu en utilisant un fonctionnement continu à une concentration de 6,4 % d’éthylène chlorhydrine, une température de 35 °C, un rapport éthylène : chlore de 1,42 et une alimentation en chlore de 71 g/h.
La production de 2-chloroéthanol pour l’oxyde d’éthylène a été remplacée par l’oxydation directe de l’éthylène avec des catalyseurs à l’argent. Cependant, l’oxyde de propylène et l’épichlorhydrine sont toujours fabriqués par oxydation directe de l’oléfine mère.
Dans la production à l’échelle industrielle de chlorhydrine d’éthylène, le chlore, l’éthylène et l’eau sonté co-introduits vers le haut via des tours à garnissage. Ces réacteurs minimisent le contact éthylène-chlore et maximisent le contact hydrocarbure-phase liquide.
Les conduites d’alimentation sont stratégiquement positionnées pour assurer une dissolution complète du chlore avant l’introduction de l’éthylène. Certaines usines utilisent des colonnes de mélange séparées pour le chlore et l’eau avant la tour de réaction d’éthylène.
Le flux de produit résultant contient une solution de 4,5 à 5,0 % de 2-chloroéthanol avec des rendements atteignant 85 à 89 % d’éthylène converti. Le dichloroéthane et l’éther bis(2-chloroéthyle) sont des sous-produits mineurs.
4. Utilisations du 2-chloroéthanol
Le 2-chloroéthanol était principalement utilisé pour la synthèse de l’oxyde d’éthylène, mais il trouve encore diverses applications dans diverses industries.
Le 2-chloroéthanol est utilisé comme catalyseur pour le métabolisme des oléfines et la polymérisation par ouverture du cycloalcène sous forme d’adduits avec des halogénures de tungstène ou de molybdène et des composés organoaluminium.
Il est utilisé dans la production de colorants, de produits pharmaceutiques, de biocides, de plastifiants et de thiodiglycol.
Il est utilisé comme matière première dans la production de cellulose modifiée (hydroxyéthylcellulose) et de strach, et pour dissoudre diverses matières, notamment acétate de cellulose et éthylcellulose utilisés dans les revêtements et les films.
Il trouve des applications dans l’impression textile pour dissoudre les colorants et dans des processus tels que le décirage des huiles, le raffinage de la colophane, l’extraction de la lignine de pin et même le nettoyage des machines.
5. Toxicologie du 2-chloroéthanol
La chlorhydrine d’éthylène présente des risques importants pour la santé. Une manipulation sûre nécessite une protection de la peau, des yeux et des voies respiratoires en raison de sa toxicité cutanée élevée et de sa toxicité modérée par voie orale et par inhalation.
2-chloroéthanol peut être absorbé par la peau, par inhalation et par ingestion. Les expositions aiguës peuvent être mortelles par contact cutané ou par inhalation. Les symptômes comprennent des lésions oculaires, une détresse respiratoire, une détresse gastro-intestinale et des lésions organiques.
Données de toxicité :
- Oral : modérément toxique, avec des valeurs DL50 autour de 60 à 95 mg/kg chez le rat.
- Peau : peut être absorbé par la peau, atteignant potentiellement des niveaux nocifs. L’irritation locale est minime.
- Œil : le contact peut causer de graves dommages, voire la cécité. Un rinçage immédiat est crucial.
- L’inhalation est mortelle à des concentrations de vapeur saturée. La CL50 estimée se situe entre 16 et 62 ppm.
- Il n’existe aucune preuve d’effets sur la reproduction ou le développement dans les études sur les animaux.
- Mutagénicité : Les résultats positifs et négatifs de divers tests suggèrent le potentiel de mutations par substitution de paires de bases.
- Cancérogénicité : Il n’y a aucune preuve de cancérogénicité dans les études sur les animaux. Les données humaines ne sont pas concluantes.
Le 2-chloroéthanol est classé comme inflammable, extrêmement toxique par diverses voies et provoque de graves lésions oculaires. Les limites d’exposition professionnelle varient selon les agences, allant de 1 à 5 ppm.
Référence
- Chlorohydrins; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_565.pub2




