L’aniline est la principale molécule du groupe des amines aromatiques. Il possède une douce odeur d’amine et se présente sous la forme d’un liquide huileux incolore qui brunit lorsqu’il est exposé à l’air et à la lumière.
Son isolement remonte au début du XIXe siècle et sa structure a été définitivement établie par A. W. Von Hofmann en 1843 par la réduction du nitrobenzène.
La première méthode industrielle de synthèse de l’aniline a été établie dès 1854. Au cours des 145 dernières années, l’aniline est devenue l’un des 100 principaux éléments constitutifs essentiels dans le domaine de la chimie.
L’aniline sert d’intermédiaire essentiel dans une grande variété d’applications, telles que les isocyanates, les agents de traitement du caoutchouc, les colorants et les pigments, les produits chimiques agricoles et les produits pharmaceutiques.
Table des matières
1. Propriétés de l’aniline
1.1. Propriétés physiques de l’aniline
L’aniline est partiellement soluble dans l’eau et miscible avec la plupart des solvants organiques (par exemple l’éthanol, l’acétone et le benzène).
Les propriétés physiques importantes de l’aniline sont les suivantes :
- Masse moléculaire (Mr) = 93,13 g/mol
- Point d’ébullition (101,3 kPa) = 184,4 °C
- Point de solidification = -6,2 °C
- Point d’éclair (DIN 51758) = 76 °C
- Température d’inflammation (DIN 51758) = 540 °C
- Seuil olfactif = 0,5 mL/m3
- Densité de liquide (20 °C) = 1,022 g/cm3
- Solubilité (20 °C) Aniline dans l’eau =3,6 %
- Valeur pH (3,6 g d’aniline par litre, 20 °C) = 8,8
1.2. Réactions chimiques de l’aniline
La chimie de l’aniline est déterminée par le groupe amino primaire (Fig. 1) et par le noyau benzénique activé (Fig. 2).
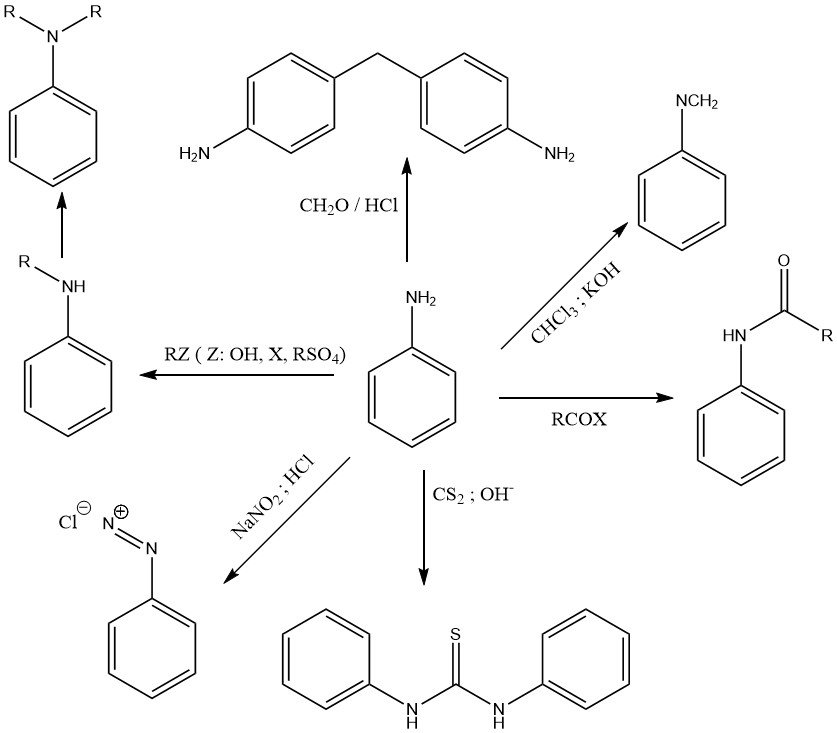
La paire d’électrons solitaire sur l’azote du groupe amino est partiellement délocalisée vers le système cyclique aromatique. Par conséquent, l’aniline n’est qu’une base faible (pKa = 4,60) par rapport aux amines aliphatiques telles que la cyclohexylamine (pKa = 10,64).
Néanmoins, l’aniline forme des sels stables et solubles dans l’eau avec des acides minéraux forts (par exemple, l’acide chlorhydrique ou sulfurique). La formation de sulfate d’aniline peut être utilisée pour protéger le groupe amino de l’aniline contre l’oxydation lors des étapes de synthèse ultérieures.
Divers agents alkylants (comme les alcools, les halogénures d’alkyle, les sulfates d’alkyle et les oléfines) alkylent le groupe amino pour former une N-alkyle et une N,N-dialkylaniline dans des réactions catalysées par l’acide de Lewis à température et pression élevées.
La réaction de l’aniline avec le chloroforme dans une solution de potasse caustique produit du phénylisocyanure.
La N,N-diphénylthiourée est le produit de la réaction de l’aniline et du disulfure de carbone dans une solution d’alcool alcalin.
Une réaction caractéristique des amines aromatiques primaires comme l’aniline est la formation de sels de diazonium avec l’acide nitreux.
L’aniline subit des réactions de condensation avec des alkylaldéhydes. La réaction la plus importante est la formation de 4,4′-méthylènedianiline (MDA) par condensation d’aniline avec du formaldéhyde en présence d’acide chlorhydrique.
L’aniline réagit avec les acides organiques et les dérivés acides pour former des amides.
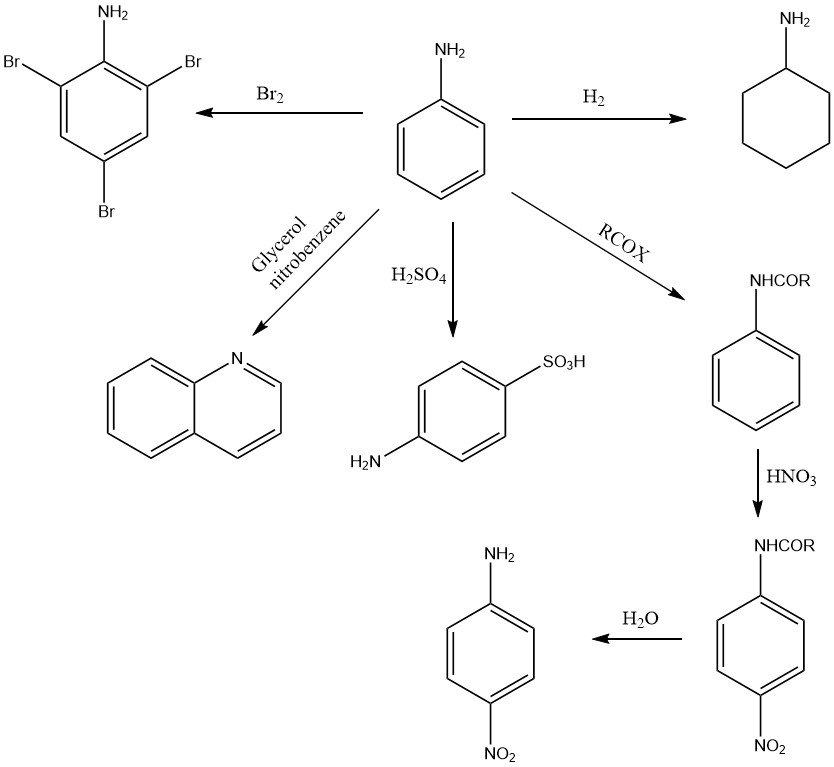
L’aniline subit diverses réactions d’oxydation, en fonction de l’agent oxydant et des conditions. Des produits mononucléaires comme la p-benzoquinone (MnO2, H2SO4), des composés bimoléculaires comme l’azobenzène (air) ou des substances polymères comme le noir d’aniline (Cu ou V, Na2Cr2O7 ou NaClO3) peuvent se former (voir Fig. 2).
Le cycle aromatique de l’aniline est hydrogéné catalytiquement pour donner de la cyclohexylamine et/ou de la dicyclohexylamine à température et pression élevées, selon les conditions et le type de catalyseur. La présence du groupe amino active les positions ortho et para du cycle aromatique et, par conséquent, l’aniline réagit facilement avec les substances électrophiles.
Par exemple, la bromation de l’aniline avec du brome donne la 1,3,5-tribromoaniline dans des conditions douces.
La réaction avec l’acide sulfurique à haute température forme presque exclusivement de l’acide 4-aminobenzène sulfonique (acide 4-sulfanilique).
La nitration de l’aniline (après avoir protégé le groupe amino contre l’oxydation par la formation d’acétanilide) forme le composé 4-nitro.
De nombreux composés N-hétérocycliques peuvent être obtenus à partir de l’aniline. Par exemple, la quinoléine est produite dans la synthèse de Skraup par condensation d’aniline avec du glycérol ou de l’acrylaldéhyde (acroléine) dans du nitrobenzène.
2. Production d’aniline
La plupart des synthèses d’aniline utilisées commercialement partent du benzène. Il existe une certaine littérature sur l’amination directe du benzène, mais la température et la pression élevées requises et la nécessité d’utiliser un excès extrême d’ammoniac n’ont jamais permis le développement d’un procédé économique.
DuPont et Mitsui Toatsu ont examiné le processus d’amination oxydative du benzène formant de l’eau en tant que sous-produit.
Le nitrobenzène est utilisé comme matière première pour la production d’aniline par tous les producteurs mondiaux à l’exception de Mitsui Petrochemicals Ind. (Japon) qui utilise en outre le phénol comme matière première et d’Aristech Chemical Corp. (États-Unis), qui n’utilise que la voie du phénol.
2.1. Hydrogénation catalytique du nitrobenzène
L’hydrogénation catalytique hautement exothermique (DH = -544 kJ/mol à 200 °C) du nitrobenzène est réalisée à la fois en phase vapeur et en phase liquide dans des procédés utilisés commercialement.
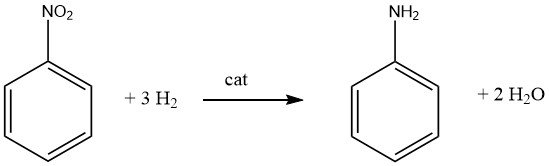
L’échange et l’utilisation de la chaleur de réaction est un point crucial pour tous les procédés utilisant le nitrobenzène comme matière première.
2.1.1. Hydrogénation catalytique en phase vapeur
Le nitrobenzène est hydrogéné en aniline, généralement avec un rendement supérieur à 99 %, à l’aide de procédés en phase vapeur à lit fixe ou à lit fluidisé.
Les catalyseurs les plus efficaces pour l’hydrogénation en phase gazeuse du nitrobenzène semblent être le cuivre ou le palladium sur charbon actif ou un support oxydé, en combinaison avec d’autres métaux (Pb, V, P, Cr) comme modificateurs ou promoteurs afin d’atteindre une activité élevée et sélectivité.
Dans le procédé Lonza, qui est exploité par First Chemical Corp., une alimentation homogénéisée d’hydrogène et de nitrobenzène est passée sur un catalyseur à lit fixe de cuivre sur pierre ponce avec une température d’entrée d’environ 200 °C.
L’homogénéisation est effectuée en pulvérisant le nitrobenzène à l’aide de l’alimentation en hydrogène frais dans le courant de gaz circulant chauffé (240 ° C) à une position fixe.
Le rapport molaire de la charge de nitrobenzène à l’hydrogène total est d’environ 1 : 100 à l’entrée du réacteur. Les produits de la réaction sortent du réacteur à une température supérieure à 300 °C (exemple : 325 °C).
La chaleur d’hydrogénation est utilisée pour la production de vapeur et pour chauffer le courant de gaz de recyclage. La sortie du réacteur est encore refroidie dans un condenseur ; l’hydrogène en excès, l’aniline brute et l’eau sont séparés. L’aniline est purifiée par distillation.
Bayer exploite des réacteurs à lit fixe conventionnels utilisant un catalyseur au palladium sur un support d’alumine, modifié dans son activité par l’ajout de vanadium et de plomb et revendique l’hydrogénation adiabatique du nitrobenzène sur un catalyseur à lit fixe de 1,5 à 4 % en poids de palladium sur coke avec 0,1 à 2 % en poids de plomb comme modificateur pour réduire l’hydrogénation du cycle aromatique.
À une pression de 100 à 700 kPa, un mélange de nitrobenzène vaporisé et d’hydrogène dans un rapport molaire de 1 : 120 à 1 : 200 est introduit dans le réacteur adiabatique avec une température d’entrée de 250 à 350 °C. La hauteur du lit de catalyseurs dans le réacteur est de 0,1 à 1,0 m.
Les produits de réaction quittent le réacteur sans refroidissement à une température maximale de 460 °C. A la sortie du réacteur, la chaleur de réaction est utilisée pour la production de vapeur à haute pression.
Une unité de production peut être constituée de plusieurs réacteurs adiabatiques en série et/ou en parallèle. Après refroidissement à 140 à 180 °C, la sortie du réacteur final est acheminée vers une unité de séparation, où, après un refroidissement supplémentaire, l’aniline brute, les eaux usées brutes et l’hydrogène recyclé sont séparés sous pression.
L’aniline brute est purifiée par distillation.
BASF exploite un procédé en phase vapeur à lit fluidisé. Le nitrobenzène est partiellement évaporé en l’atomisant à l’aide d’un courant gazeux chaud constitué essentiellement d’hydrogène.
Le courant de gaz est mis en circulation en présence d’un catalyseur fluidisé, les produits de réaction sont condensés et l’aniline est séparée des produits de réaction bruts isolés.
Un type de catalyseur préféré est le cuivre (= 15 % en poids) sur un support de silice activé avec du chrome, du zinc et du baryum.
Le mélange biphasique de nitrobenzène et d’hydrogène est injecté par des buses situées à plusieurs hauteurs dans le lit fluidisé et l’hydrogénation est effectuée à 250 – 300 °C et 400 – 1000 kPa en présence d’hydrogène en excès.
Le gaz produit chaud est refroidi en le faisant passer à travers un échangeur de chaleur et l’aniline est isolée dans un séparateur liquide-gaz. La chaleur de réaction est utilisée pour la production de vapeur.
Pour la régénération du catalyseur, après avoir balayé l’ensemble du système avec de l’azote, la matière organique déposée sur la surface du catalyseur est brûlée à 200 à 250 °C avec de l’air.
Après l’achèvement de la régénération et le remplacement ultérieur de l’air dans le système par de l’azote, le catalyseur est à nouveau activé en réduisant l’oxyde de cuivre en cuivre avec de l’hydrogène à 200 à 300 °C.
2.1.2. Hydrogénation catalytique en phase liquide
Les procédés industriels d’aniline d’ICI et de DuPont impliquent une hydrogénation en phase liquide. Les procédés d’hydrogénation en phase liquide fonctionnent à 90 – 200 °C et 100 – 600 kPa.
La réaction en phase liquide peut être réalisée en suspension ou dans des réacteurs à lit fluidisé. La conversion du nitrobenzène est normalement complète après un seul passage dans le réacteur avec des rendements de 98 à 99 %.
Dans les années 1960, ICI a développé un procédé continu d’hydrogénation en phase liquide, qui utilisait l’aniline comme solvant dans une proportion > 95 % en poids de la phase liquide.
En opérant à ou près du point d’ébullition du solvant (généralement à des pressions < 100 kPa), une partie ou la totalité de la chaleur de la réaction est dissipée en permettant au mélange réactionnel de s’évaporer.
L’eau est éliminée avec les vapeurs effluentes et une quantité suffisante d’aniline est renvoyée dans le récipient de réaction pour maintenir des conditions d’état stable. Un catalyseur préféré est le nickel finement divisé sur kieselguhr.
DuPont hydrogéne le nitrobenzène en phase liquide à l’aide d’un catalyseur platine-palladium sur un support de carbone avec du fer comme modificateur. Le modificateur offre une bonne durée de vie du catalyseur, une activité élevée et une protection contre l’hydrogénation du cycle aromatique.
Le procédé continu utilise un réacteur à écoulement piston qui atteint des rendements essentiellement quantitatifs, et le produit sortant du réacteur est pratiquement exempt de nitrobenzène.
Une comparaison de l’hydrogénation catalytique en phase liquide et en phase vapeur du nitrobenzène ne montre pratiquement aucune différence de rendement et de qualité du produit pour les deux procédés.
Le procédé en phase liquide présente l’avantage d’un rendement espace-temps plus élevé et ne nécessite pas de boucle de gaz de recyclage (besoin énergétique moindre), le procédé en phase vapeur présente l’avantage d’une utilisation très efficace de la chaleur de réaction (production de vapeur ), pas besoin de séparation produit-catalyseur et durée de vie plus longue du catalyseur.
2.2. Réduction du nitrobenzène avec du fer et des sels de fer
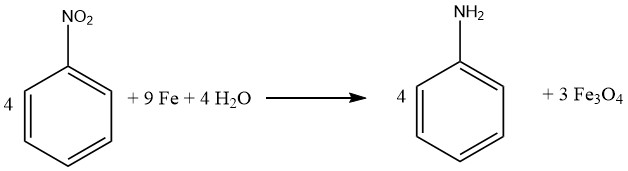
Une variante historique de la voie du nitrobenzène est le procédé Bechamp, qui utilise du fer et du chlorure de fer (II) pour la réduction. Ce procédé a plus de cent ans, mais est toujours utilisé dans deux usines d’aniline de Bayer.
Aujourd’hui, le produit d’intérêt n’est plus l’aniline, mais les pigments colorés d’oxyde de fer, qui se forment comme sous-produits. Dans le procédé Bechamp, le nitrobenzène est réduit dans un réacteur agité avec une solution de chlorure de fer (II) et des remplissages de fer broyés.
Le réacteur est rempli avec la quantité totale d’eau nécessaire à la réaction (eau d’aniline provenant de la distillation de l’aniline), 20 % du fer, la quantité totale de catalyseur nécessaire et environ 5 % à 10 % de l’alimentation totale en nitrobenzène.
Sous agitation intense, le contenu du réacteur est chauffé au reflux. Une fois la réduction commencée, le nitrobenzène et le fer restants sont ajoutés lentement pour éviter une accumulation excessive de température et de pression.
Pour l’achèvement de la réduction, le récipient est chauffé jusqu’à 100°C pendant deux heures supplémentaires après la fin de l’addition de fer/nitrobenzène. La réaction est terminée en environ 8 à 10 h.
Le mélange réactionnel est neutralisé à la chaux ; il est ensuite transféré dans un séparateur, et la phase organique contenant l’aniline est soutirée. L’aniline est récupérée de la phase organique par entraînement à l’eau et distillation.
L’aniline résiduelle est récupérée du matériau restant dans le séparateur avant que la bouillie de poudre d’oxyde de fer ne soit transformée en un pigment coloré à fines particules. La couleur du sous-produit d’oxyde de fer peut être contrôlée par des additifs au milieu réactionnel, par l’utilisation de différents types de fer et par des conditions de calcination ultérieures.
2.3. Amination du Phénol

Dans le procédé commerciale du phénol développée par Halcon, le phénol est aminé en phase vapeur à l’aide d’ammoniac en présence d’un catalyseur silice-alumine.
La réaction est légèrement exothermique (ΔH = -8,4 kJ/mol) et réversible, de sorte qu’une conversion élevée n’est obtenue qu’en utilisant un excès d’ammoniac (rapport molaire de 20 : 1) et une température de réaction basse, ce qui réduit également la dissociation de l’ammoniac .
Les impuretés des sous-produits comprennent la diphénylamine, la triphénylamine et le carbazole. Leur formation est également inhibée par l’utilisation d’un excès d’ammoniac. Les rendements basés sur le phénol et l’ammoniac sont ≥ 96 % et 80 %, respectivement.
Dans ce procédé, le phénol et l’ammoniac frais et recyclé sont vaporisés séparément (pour éviter les pertes de rendement) et combinés dans le réacteur d’amination à lit fixe contenant le catalyseur silice-alumine.
Après la réaction à 370 °C et 1,7 MPa, le gaz est refroidi, partiellement condensé et l’excès d’ammoniac est récupéré dans une colonne de séparation, comprimé et recyclé.
Le produit de condensation est passé dans une colonne de séchage pour éliminer l’eau, puis dans une colonne de finition pour séparer l’aniline du phénol résiduel et des impuretés sous vide (moins de 80 kPa). Le phénol, contenant de l’aniline (mélange azéotropique) est recyclé.
La comparaison de la voie du phénol à la voie du nitrobenzène, toutes deux partant du benzène, montre quatre étapes de production pour la première (le cumène vers le phénol implique deux étapes via l’hydroperoxyde de cumène intermédiaire) contre deux pour la seconde.
La voie du nitrobenzène présente un avantage global en termes de rendement et de besoins énergétiques totaux inférieurs. La voie du phénol a un avantage dans la durée de vie prolongée du catalyseur et la qualité du produit. C’est la méthode préférée si du phénol à faible coût est disponible (producteurs de phénol).
3. Utilisations de l’aniline
L’aniline est utilisée dans plus de 300 produits finaux différents, le plus important étant le bloc de construction polyuréthane 4,4-méthylène-di-paraphénylène isocyanate (MDI).
3.1. Isocyanate de méthylène diphénylène (MDI)
Le MDI est l’un des principaux isocyanates qui est mis à réagir avec des alcools tels que les polyols et les polyétherols pour produire des polyuréthanes (PU).
Les systèmes PU à base de MDI sont principalement utilisés dans la construction, l’ameublement, l’industrie automobile et l’isolation. En raison du large éventail d’utilisations finales traditionnelles et de nouveaux domaines d’application, le MDI-PU continuera à afficher une forte croissance, en particulier sur les marchés émergents.
Un processus MDI typique utilisé par les producteurs commerciaux est le suivant :
Un mélange de méthylènephénylamines polymères est préparé en condensant de l’aniline avec du formaldéhyde en présence de HCl. La réaction implique la formation intermédiaire de chlorhydrates d’amines, qui sont ensuite neutralisés avec de la soude caustique.
La réaction est généralement conduite avec un excès d’aniline à une pression inférieure à la pression atmosphérique et à des températures comprises entre 70 et 105 °C. Le rendement est d’environ 96 %.
Le produit polyamine est converti en un mélange brut d’isocyanates par réaction avec du phosgène dans un solvant. La température de réaction est d’environ 120 °C, la pression est de 345 kPa et le rendement env. 97 %. Le chlorobenzène est éliminé par distillation.
Le brut est séparé par distillation sous vide en MDI pur et MDI polymère. Le chlorure d’hydrogène est produit comme sous-produit de la réaction.
3.2. Produits chimiques de traitement du caoutchouc
Au cours de la première décennie de ce siècle, l’aniline pure était utilisée comme accélérateur de vulcanisation. L’appel à une plus grande efficacité et à une manipulation plus sûre a conduit au développement d’accélérateurs de mercaptothiazole et d’amide sulfénique à base d’aniline qui représentent actuellement env. 80 % de tous les accélérateurs de vulcanisation utilisés dans le monde.
Les antidégradants (c’est-à-dire les antioxydants, les antiozonants) tels que les paraphénylènediamines (PPD), les quinoléines et la diphénylamine revêtent une importance encore plus grande pour l’aniline dans le secteur des produits chimiques de traitement du caoutchouc. L’aniline est la matière première d’environ 70 % de tous les antidégradants consommés dans le monde.
L’utilisation future d’aniline dans l’industrie du caoutchouc devrait augmenter de 2 à 3 % par an, ce qui équivaut à la croissance mondiale de la demande de caoutchouc synthétique et naturel.
3.3. Colorants et Pigments
Les intermédiaires pour colorants et pigments couvrent plus de 50 % de toutes les formulations connues utilisant l’aniline comme matière première, bien que la plupart d’entre eux soient d’importance mineure. Les classes les plus importantes sont les composés mono-, di- et triazoïques.
La production de colorants et de pigments s’est déplacée vers les pays asiatiques, comme la Chine et l’Inde. Cependant, certaines usines de colorants et de pigments à l’échelle mondiale en Europe et dans l’ALENA (États-Unis, Canada, Mexique) utilisent encore l’aniline, par exemple pour la production d’indigo.
Depuis la réalisation industrielle des synthèses chimiques d’indigo à la fin du XIXe siècle par BASF, l’indigo est le colorant le plus important à base d’aniline. La croissance mondiale de cette application devrait se situer à un faible taux de 1 à 2 % par an.
3.4. Produits chimiques agricoles
Plus de 40 substances actives pour pesticides (herbicides, fongicides et insecticides) utilisent l’aniline comme matière première. Les plus importants sont les herbicides à base d’amide et d’urée. Les entreprises situées dans le cadre de l’ALENA représentent plus de 50 % de la consommation mondiale d’aniline pour les produits chimiques agricoles.
Les substances actives à base d’aniline se trouvent principalement dans la dernière étape de leur cycle de vie et sont sur le point d’être remplacées. La consommation mondiale devrait donc diminuer de 1 à 2 % par an.
3.5. Médicaments
En tant que débouché stable bien que petit, l’aniline est principalement utilisée pour la préparation d’analgésiques, d’antipyrétiques, d’antiallergiques et de vitamines.
Une certaine croissance de la demande de médicaments est attendue pour les cinq prochaines années, contrebalancée par une diminution de la consommation d’aniline pour la production de vitamines où la voie de l’aniline est abandonnée au profit de la technologie de la fermentation.
3.6. Cyclohexylamine/Dicyclohexylamine
Dans les années 1990, l’aniline est devenue la matière première de choix pour la production de ces amines. Les deux sont principalement utilisés comme intermédiaires pour les accélérateurs de vulcanisation au sulfénamide. La cyclohexylamine est également utilisée en grande quantité comme inhibiteur de corrosion et comme matière première pour les cyclamates.
Alors que l’utilisation de ces amines dans les accélérateurs et le traitement de l’eau devrait croître à un rythme d’env. 3 à 4 % par an, la consommation de cyclohexylamine pour la production de cyclamates a considérablement fluctué et est difficile à prévoir. On peut s’attendre à une augmentation de la demande si la FDA lève l’interdiction d’utiliser les cyclamates comme édulcorants artificiels aux États-Unis.
3.7. Divers
Parmi diverses autres applications (production d’alkylanilines, d’azurants optiques, d’acides sulfoniques, etc.), la consommation d’aniline pour la synthèse de fibres aramides mérite d’être mentionnée.
Les aramides conviennent à un large éventail d’applications, principalement en tant que substituts de l’acier, présentant des caractéristiques de renforcement équivalentes à un poids bien inférieur.
En raison d’une utilisation supplémentaire dans d’autres applications, par exemple le remplacement de l’amiante dans les garnitures de frein, on peut s’attendre à des taux de croissance sains pour les aramides.
Références
- Aniline; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_303.pub2


