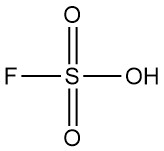
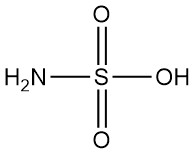
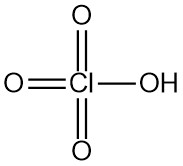
L’hydrazine est un composé inorganique de formule N2H4. C’est un liquide incolore hautement toxique avec une forte odeur d’ammoniaque.
L’hydrazine est principalement commercialisée sous la forme d’une solution aqueuse contenant jusqu’à 64 % de concentration, correspondant à l’hydrate d’hydrazine N2H4·H2O.
En 1875, EMIL FISCHER fit une prédiction concernant la présence d’hydrazine H2N–NH2. En 1887, CURTIUS réussit à l’isoler. Puis, en 1893, DE BRUYN parvient à isoler de l’hydrazine anhydre.
RASCHIG a inventé le premier processus de production commerciale en 1907, qui est toujours utilisé au Japon, en Russie, en Chine et en Corée.
L’utilisation intensive de l’hydrazine et de ses dérivés comme agents gonflants pour les mousses plastiques a conduit à l’émergence de diverses applications industrielles telles que le traitement de l’eau de chaudière, les initiateurs de polymérisation, les pesticides, les produits pharmaceutiques, les produits chimiques photographiques et les colorants.
Même après un siècle de sa découverte, la synthèse de l’hydrazine reste difficile principalement en raison de contraintes thermodynamiques. La majorité de l’hydrazine est fabriquée à l’aide de versions modifiées du procédé Raschig, impliquant l’oxydation de l’ammoniac par l’hypochlorite.
Néanmoins, les nouvelles usines construites depuis 1980 utilisent le procédé PCUK, qui utilise du peroxyde d’hydrogène comme oxydant.
Table des matières
1. Propriétés physiques de l’hydrazine
L’hydrazine est un liquide incolore avec une odeur d’ammoniac. Il présente une miscibilité complète avec l’eau et forme des solutions aqueuses fortement alcalines.
Notamment, des propriétés spécifiques telles que la viscosité et la densité atteignent leurs valeurs maximales lorsque la composition est à 64%, indiquant la présence de la forme monohydratée, N2H4·H2O, à la fois dans les phases solide et liquide.
L’hydrazine forme un azéotrope (point d’ébullition 120,5 ° C) avec l’eau, où le mélange azéotropique contient 58,5 % en moles d’hydrazine.
L’hydrazine est un composé endothermique, avec une chaleur de formation de +50,6 kJ/mol. Ses limites d’explosivité dans l’air vont de 4,7 % à 100 %. La limite supérieure indique que l’hydrazine anhydre est capable d’auto-explosion.
Cependant, le diluer avec un gaz inerte comme l’azote ou l’eau réduit considérablement la plage d’inflammabilité en augmentant la limite inférieure d’explosivité. Par conséquent, l’hydrate d’hydrazine (contenant 30,9 % en volume d’hydrazine) peut être manipulé en toute sécurité à la pression atmosphérique et à 120 °C en l’absence d’air.
Un aperçu de certaines propriétés physiques de l’hydrazine est fourni ci-dessous :
- Masse molaire = 32,05 g/mol
- point de fusion = 2 °C
- point d’ébullition = 113,5 °C
- densité = 1,0045 g/ml
- Indice de réfraction = 1,4644 à 25 °Cviscosité = 0,974 μPa.s
- pH (à 65% de solution aqueuse) = 12,75
2. Réactions chimiques de l’hydrazine
Les propriétés chimiques de l’hydrazine sont fortement influencées par les caractéristiques suivantes : sa nature endothermique, son alcalinité et ses fortes propriétés réductrices.
2.1. Décomposition thermique
Une décomposition importante de l’hydrazine nécessite une température relativement élevée (250 °C) en l’absence de catalyseurs. Cependant, la présence de certains catalyseurs tels que le cuivre, le cobalt, le molybdène et leurs oxydes abaisse la température de décomposition. Par conséquent, une manipulation prudente de l’hydrazine est nécessaire.
2.2. Réactions acido-basiques
L’hydrazine agit comme une base faible et réagit avec l’eau :

Le cation N2H6+ n’est observé que dans des solutions très acides ou à l’état solide.
L’hydrazine peut former des sels avec des acides, y compris des explosifs comme le nitrate, le perchlorate et l’azide. D’autre part, les sels disponibles dans le commerce comme le chlorhydrate, le bromhydrate et le sulfate peuvent être manipulés de la même manière que l’hydrate d’hydrazine.
2.3. Agent réducteur
L’hydrazine présente de fortes propriétés réductrices et réagit de manière exothermique avec l’oxygène :

De nombreuses applications de l’hydrazine sont basées sur cette réaction. L’oxydation de l’hydrazine par l’air dans des solutions alcalines est catalysée par plusieurs métaux.
Par conséquent, les solutions d’hydrazine doivent être distillées en l’absence ou la désactivation du cuivre, des métaux polyvalents ou de leurs sels. Les oxydes de cadmium, de magnésium, de zinc et d’aluminium assurent la stabilisation contre l’oxydation aérienne dans les solutions d’hydrazine.
Dans les solutions acides, l’hydrazine réagit avec les halogènes :

Ces réactions trouvent une utilité dans la détermination de N2H4 (en utilisant de l’iode), la purification des halogénures d’hydrogène bruts et l’élimination des traces d’halogènes dans les eaux usées. La même procédure peut être utilisée pour éliminer les traces d’hydrazine elle-même. L’hypochlorite de sodium ou le peroxyde d’hydrogène, en présence de sels de fer(III) ou de cuivre(II), sont des options pratiques pour le traitement des déchets ou des déversements.
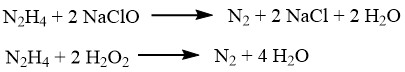
L’hydrazine peut réduire divers ions ou oxydes métalliques tels que le cuivre, l’argent, l’or, le mercure, le nickel et le platine, les transformant en métaux pulvérulents.
Les cétones et les aldéhydes subissent une réduction en présence d’hydrazine (connue sous le nom de réaction de Wolff – Kishner).
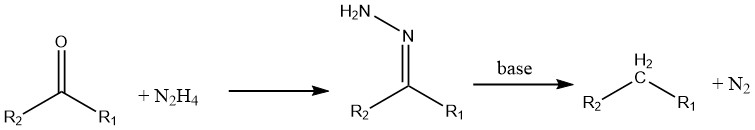
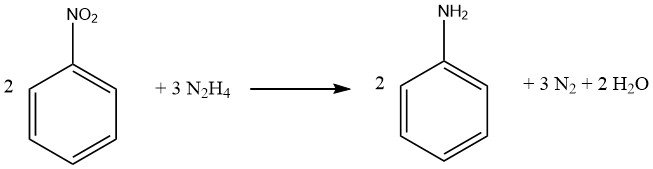
Les composés nitrés aromatiques peuvent être réduits en leurs amines correspondantes à l’aide d’hydrazine et d’un catalyseur d’hydrogénation comme le nickel de Raney.
L’hydrazine subit une oxydation en diimide en présence de peroxyde d’hydrogène. Le diimide réduit ensuite les acétylènes en cis-alcènes et hydrogène les doubles liaisons résiduelles dans le caoutchouc acrylonitrile – butadiène.

2.4. Réactions de diamine
L’hydrazine trouve une utilisation intensive dans la synthèse et la production de divers composés azotés à chaîne ouverte et hétérocycliques, y compris les composés hydrazo et azoïques, les pyrazoles, les triazoles, les urazoles, les tétrazoles, les pyridazines et les triazines.
3. Utilisations de l’hydrazine
La majeure partie de l’hydrazine disponible est vendue sous forme de solution dans l’eau. L’hydrazine anhydre, en revanche, est principalement utilisée comme carburant de fusée ou comme mono- ou bipropulseur pour les satellites et les engins spatiaux.
Environ 80 à 90 % de la production d’hydrazine est convertie en dérivés organiques. Ses autres applications reposent sur son rôle d’agent réducteur, de composé riche en énergie ou sur sa capacité de stockage d’hydrogène.
Les utilisations importantes de l’hydrazine et de ses dérivés comprennent leur utilisation comme initiateurs de polymérisation et agents gonflants pour les mousses plastiques, ainsi que dans la production de pesticides. Ils sont également utilisés comme blocs de construction synthétiques, produits pharmaceutiques, propulseurs et airbags pour les voitures.
3.1. Agents gonflants
La production industrielle d’agents gonflants à base d’hydrazine est importante, la consommation d’hydrate d’hydrazine à cet effet atteignant 50 000 tonnes par an en 1998. Ces agents gonflants sont principalement des dérivés hydrazoïques ou azoïques, ces derniers étant obtenus par oxydation des premiers à l’aide de chlore ou de peroxyde d’hydrogène. .
Lorsqu’ils sont chauffés, les agents gonflants se décomposent, libérant de l’azote et d’autres gaz, qui créent un effet moussant dans les polymères, entraînant la formation de pores ou de cellules. Divers agents gonflants à base d’hydrazine produits dans le commerce sont disponibles et leur température de décomposition dépend de facteurs tels que la taille des particules, le pH et la présence d’agents d’activation tels que les sels de baryum, de cadmium ou de zinc.
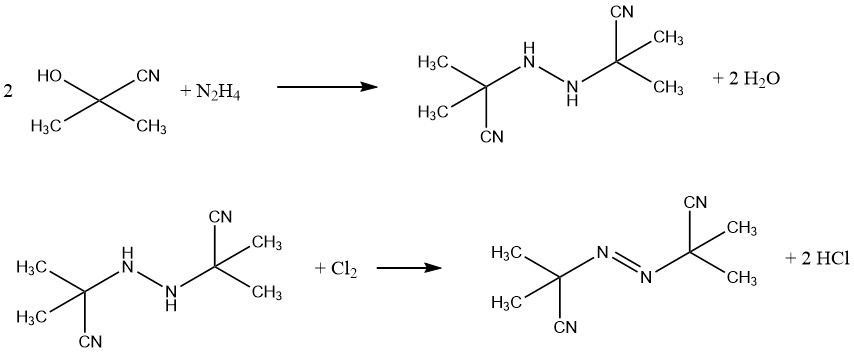
Un exemple d’agent gonflant commercial est l’azobis(isobutyronitrile) (AIBN), utilisé pour les produits en caoutchouc mousse et les mousses de PVC. Il agit également comme source de radicaux libres dans l’initiation de la polymérisation. L’AIBN est synthétisé à partir de cyanohydrine d’acétone et d’hydrazine, suivi d’une oxydation avec du chlore.
L’azodicarbonamide est un autre agent gonflant important produit à partir d’urée et d’hydrazine.

L’hydrazodicarbonamide intermédiaire peut être obtenu directement à partir d’urée et d’hypochlorite de sodium ou par oxydation avec du chlore ou du peroxyde d’hydrogène en présence d’une faible quantité d’ions bromure en milieu acide.
L’azodicarbonamide est l’agent gonflant le plus largement utilisé en raison de son grand volume de gaz dégagé lors de la décomposition et de ses caractéristiques de sécurité.
Pour répondre aux exigences de fabrication de nouveaux caoutchoucs ou de matières plastiques poreuses, les hydrazides d’acide sulfonique ont été introduits dans les années 1950.
Ces hydrazides sont supérieurs aux agents gonflants inorganiques précédemment utilisés (par exemple, le nitrite d’ammonium, le bicarbonate d’ammonium, le bicarbonate de sodium) en termes de dispersion, de tolérance aux températures plus élevées et de structure cellulaire de mousse améliorée.
Ils sont également incolores, inodores et sûrs, avec des produits de décomposition qui ne favorisent pas la combustion. Les mono- et dihydrazides d’acide sulfonique sont produits à partir d’hydrate d’hydrazine et du chlorure d’acide sulfonique correspondant.
3.2. Coussins gonflables
L’azoture de sodium est couramment utilisé comme précurseur de gaz dans la technologie des airbags. Un procédé de fabrication de l’azoture de sodium implique de l’hydrazine et un nitrite d’alkyle. Un autre dérivé de l’hydrazine, le 5-aminotétrazole, obtenu à partir de sels d’aminoguanidine, est en cours de développement pour la même application.
3.3. Initiateurs de polymérisation radicalaire
Les composés azoïques, en particulier les azodinitriles symétriques, sont largement utilisés comme initiateurs de polymérisation radicalaire.
Ces composés azoïques sont synthétisés à partir d’hydrazine, d’une cétone et de cyanure d’hydrogène (HCN). Le dérivé hydrazo est oxydé à l’aide de chlore ou de peroxyde d’hydrogène en présence d’un catalyseur au bromure.
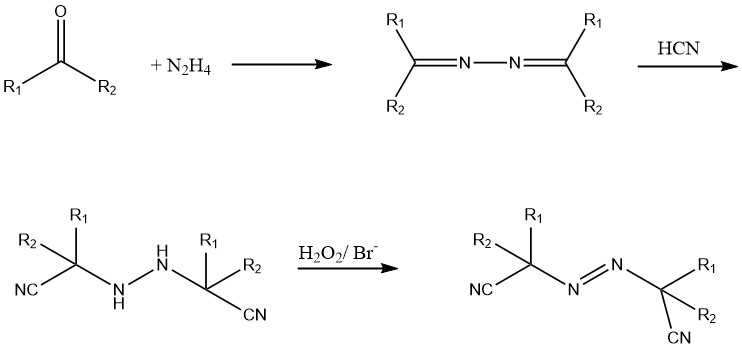
Des composés solubles dans l’eau comme le dichlorhydrate de 2,2′-azo bis(2-aminopropane) et des composés azoïques liquides comme le 2,2′-azobisisobutyrate de diéthyle sont actuellement en cours de développement.
3.4. Pesticides
Les pesticides à base d’hydrazine constituent une part importante de la consommation d’hydrazine. Le premier exemple est l’hydrazide maléique, synthétisé en faisant réagir l’anhydride maléique avec l’hydrazine.
Un autre herbicide à usage général est le 3-amino-1,2,4-triazole, obtenu à partir de cyanamide, d’hydrate d’hydrazine et d’acide formique. Cet herbicide est utilisé de manière sélective dans les vignes et les vergers, la consommation atteignant plusieurs milliers de tonnes par an.
De nombreux composés à base d’hydrazine sont produits commercialement pour les applications de pesticides, principalement des composés hétérocycliques comme les triazines, les oxadiazoles, les pyrazoles, les pyridazines et les thiadiazoles.
3.5. Médicaments
Bien que représentant un faible pourcentage de la production totale d’hydrazine, l’utilisation de l’hydrazine dans les produits pharmaceutiques est importante. Par exemple, l’isoniazide, l’hydrazide de l’acide isonicotinique, a été utilisé pour la première fois dans les années 1950 pour traiter la tuberculose.
Dans les années 1980 et 1990, d’autres produits pharmaceutiques à base d’hydrazine contenant le groupe 1,2,4-triazole ont été introduits, servant d’antidépresseurs, d’antihypertenseurs et d’agents antibactériens ou antifongiques.
Les développements récents se sont concentrés sur les produits pharmaceutiques contenant le groupe 4-amino-1,2,4-triazole, qui démontrent une efficacité améliorée.
3.6. Traitement de l’eau
L’hydrazine est utilisée dans le traitement de l’eau pour protéger l’acier de la corrosion dans les chaudières. Lorsque l’hydrazine réagit avec l’oxyde de fer(III), elle forme de la magnétite, qui sert de couche protectrice contre la corrosion par l’eau et l’oxygène.
Des concentrations résiduelles d’hydrazine inférieures à 0,1 ppm garantissent une protection complète contre la corrosion. Les formulations d’hydrate d’hydrazine catalysées disponibles dans le commerce, connues sous le nom d’hydrazine activée, sont efficaces même à température ambiante.
3.7. Propulseurs
L’utilisation initiale à grande échelle de l’hydrazine était comme carburant de fusée. L’hydrazine anhydre est un excellent propulseur, seul l’hydrogène dépassant son impulsion spécifique.
Les propulseurs de fusée actuels comprennent l’hydrazine anhydre, la monométhylhydrazine et la diméthylhydrazine asymétrique, principalement utilisées comme carburants bipropulseurs dans des fusées comme Titan ou Ariane.
L’hydrazine anhydre sert également de monergol pour les satellites et les engins spatiaux. Sa décomposition sur un catalyseur produit un mélange de gaz.
Les catalyseurs, souvent à base d’iridium ou de ruthénium déposés sur de l’alumine, sont classés comme spontanés (travaillant à température ambiante) ou non spontanés (travaillant au-dessus de 100 °C).
3.8. Réservoirs de carburant
Des recherches approfondies ont été menées sur les piles à combustible qui utilisent l’oxydation de l’hydrazine avec de l’oxygène ou du peroxyde d’hydrogène. Cependant, leur utilisation est principalement limitée aux applications militaires en raison du coût de l’hydrate d’hydrazine.
Référence
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177